蒽酮-硫酸法与苯酚-硫酸法测定苦瓜多糖的比较
2019-01-28张洁媛宁恩创
◎ 张洁媛,张 丽,宁恩创
(1.广西大学轻工与食品工程学院,广西 南宁 530000;2.南宁市第一职业技术学校,广西 南宁 530000)
1 材料及方法
1.1 材料
基本材料苦瓜粉,颜色为淡黄绿色,易溶于水,目数在100~150目,不含任何添加剂和防腐剂;试剂选择蒽酮、苯酚、硫酸和无水葡萄糖;仪器选择电子天平、紫外可见分光光度计、电磁炉。其余的试剂和仪器按照基本配备。
1.2 苦瓜多糖的提取
苦瓜多糖是苦瓜中的一种有效活性成分,在对苦瓜多糖提取方法的研究中,使用较多的是热水浸提法,以热水浸提,然后用乙醇进行沉淀。超声波提取法,操作方法与常规方法相同,只需增加使用超声波仪器,无需其他试剂,便可使多糖的提取率提高,粗多糖中多糖的含量也提高。在本次实验中,选取超声波浸提法对苦瓜多糖进行浸提[1]。超声波提取苦瓜多糖的主要过程为:苦瓜粉→乙醇回流→超声波浸提→过滤→浓缩→醇析→洗涤→干燥→苦瓜粗多糖。
1.3 苯酚-硫酸法测定苦瓜多糖
糖在浓硫酸作用下,水解成单糖,并迅速脱水生成糖醛衍生物,然后与苯酚缩合成橙黄色化合物,且颜色稳定,在最大吸收波长处和一定的浓度范围内,其吸光度与多糖含量呈正比关系,可以利用分光光度计测定其吸光度,并利用标准曲线定量测定样品的多糖含量。
1.3.1 单因素实验
影响苯酚-硫酸法测定苦瓜多糖的因素有5%苯酚的量、浓硫酸的量、反应时间、最大吸收波长,结合4个因素的影响设计单因素实验,确定最适的条件。
1.3.1.1 5%苯酚试剂的量
取11支具塞试管,其中一支做空白。10支分别加入0.5 mL的0.408 4 mg·mL-1的样品,加入1.5 mL的蒸馏水,空白加入2 mL蒸馏水,所有试管中再加入1 mL的苯酚试剂,再加入6 mL的浓硫酸;1号、2号试管加入0.6 mL的5%苯酚试剂;3号、4号试管加入0.8 mL的5%苯酚试剂;5号、6号试管加入1.0 mL的5%苯酚试剂;7号、8号加入1.2 mL的5%苯酚试剂;9号、10号加入1.4 mL的5%苯酚溶液。再每支试管中加入6 mL的浓硫酸,室温下放置30 min,在波长为490 nm的条件下进行实验。
1.3.1.2 浓硫酸的量
取11支试管,其中一支作为空白。10支分别加入0.5 mL的0.408 4 mg·mL-1的样品,加入1.5 mL的蒸馏水,空白加入2 mL蒸馏水,所有试管中再加入1 mL的苯酚试剂;每支试管中加入1 mL的5%苯酚试剂。1号、2号试管中加入5.0 mL的浓硫酸;3号、4号试管中加入5.5 mL的浓硫酸;5号、6号试管中加入6.0 mL的浓硫酸;7号、8号试管加入6.5 mL的浓硫酸;9号、10号试管中加入7.0 mL的浓硫酸。室温下放置30 min,在波长为490 nm的条件下进行实验。
1.3.1.3 反应时间
取11支试管,其中一支作为空白。10支分别加入0.5 mL的0.408 4 mg·mL-1的样品,加入的浓硫酸;1号、2号试管在常温下放置20 min后在490 nm的波长下进行测定;3号、4号试管在常温下放置25 min后在490 nm的波长下进行测定;5号、6号试管在室温下放置30 min后在490 nm的波长下进行测定;7号、8号试管在室温下放置35 min后在490 nm的波长下进行测定;9号、10号试管再室温下放置40 min后在490 nm的波长下进行测定。
1.3.1.4 最适波长的选择
取11支试管,其中一支作为空白。10支分别加入0.5 mL的0.408 4 mg·mL-1的样品,加入1.5 mL的蒸馏水,空白加入2 mL蒸馏水,所有试管中再加入1 mL的苯酚试剂,再加入6 mL的浓硫酸,室温下放置30 min,1号、2号试管在波长470 nm处进行测定;3号、4号试管在波长480 nm处进行测定;5号、6号试管在波长为490 nm处进行测定;7号、8号试管在波长500 nm处进行测定;9号、10号试管在波长为510 nm处进行测定。
1.3.2 正交试验
根据单因素实验确定设定正交实验因素水平,见表1。
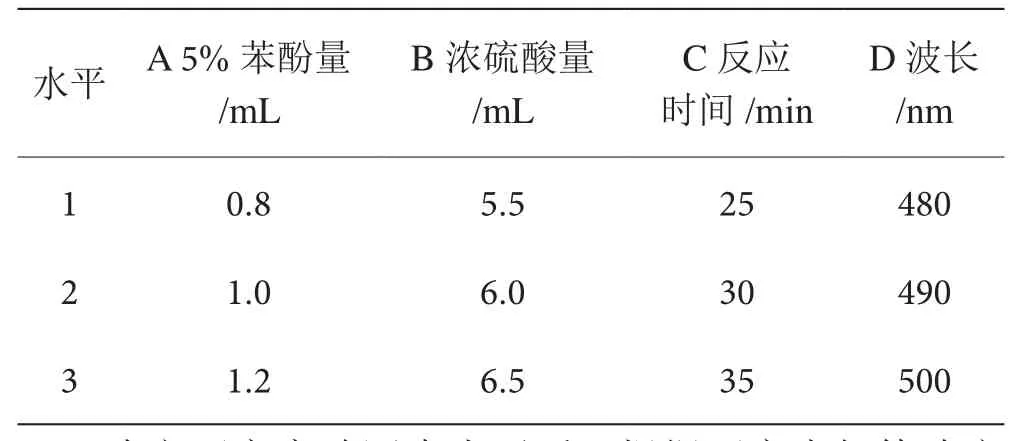
表1 苦瓜多糖含量的测定正交试验因素水平表
确定正交实验因素水平后,根据正交表规律确定正交表,见表2。

表2 L9(33)苦瓜多糖含量的测定正交试验表
取一支空白加入2 mL蒸馏水,再加入1 mL的苯酚试剂,再加入5 mL的浓硫酸,室温下放置30 min。1~9号试管按正交试验表中的安排进行试剂的添加,在规定的时间内进行测定。
1.4 蒽酮-硫酸法测定苦瓜多糖
糖类在较高温度下可与浓硫酸发生脱水反应生成糠醛,羟甲基糖醛后与蒽酮(C14H10O)脱水缩合,形成糠醛的衍生物,呈蓝绿色。该物质在620 nm处有最大吸收,在0~150 μg·mL-1,其颜色的深浅与可溶性糖含量成正比。蒽酮试剂:精密称取0.1 g蒽酮,加80%浓H2SO4100 mL使之溶解,摇匀[2]。
根据蒽酮-硫酸法测定苦瓜多糖的原理可知,影响实验结果的因素有蒽酮试剂的量、沸水浴的时间、最大吸收波长。通过3组单因素实验,确定单个因素的最适合条件。通过单因素实验的结果,再进行正交试验,通过对正交试验结果的分析,得到一个最适的组合,作为两种方法最后进行比较的条件。(具体测定与苯酚-硫酸法测定苦瓜多糖类似)
2 结果与分析
2.1 标注曲线的绘制
(1)苯酚-硫酸法测定苦瓜多糖的标准曲线的绘制。取6支试管,分别加入0.0、0.2、0.4、0.6、0.8 mL和1.0 mL的标准葡萄糖溶液,加入蒸馏水至2 mL,再加入5%苯酚0.8 mL,浓硫酸6 mL,室温下反应30 min,使用紫外可见分光光度计在480 nm的波长下进行测定,试验结果绘制成曲线如图1所示。

图1 苯酚硫酸法的标准曲线图
(2)蒽酮-硫酸法测定苦瓜多糖的标准曲线的绘制。取6支试管,分别加入0.0、0.2、0.4、0.6、0.8 mL及1 mL的标准葡萄糖溶液,加蒸馏水至2 mL,再加入5.0 mL的蒽酮试剂,沸水浴15 min后冰水浴15 min,使用紫外可见分光光度计在620 nm的波长下进行测定,得到图2结果。

图2 蒽酮硫酸法的标准曲线图
2.2 实验结果与讨论
根据图1和图2所得数据,通过计算得出多糖含量,然后计算得出每种方法的RSD值。苯酚-硫酸法测定苦瓜多糖的稳定性、精密度和回收率都比蒽酮-硫酸法高,但是重复性没有蒽酮-硫酸法好。所以,苯酚-硫酸法更适合用于苦瓜多糖的测定[3]。
所以,两种方法中苯酚-硫酸法相比于蒽酮-硫酸法回收率较高。
由表3、表4、表5和表6可知,苯酚-硫酸法测定苦瓜多糖比蒽酮-硫酸法测定苦瓜多糖的稳定性、精密度和回收率都比蒽酮-硫酸法高,但重复性没有蒽酮-硫酸法好。所以,苯酚-硫酸法更适合用于苦瓜多糖的测定。

表3 蒽酮-硫酸法与苯酚硫酸法测定苦瓜多糖的稳定性比较表

表4 蒽酮-硫酸法与苯酚硫酸法测定苦瓜多糖的精密度比较表
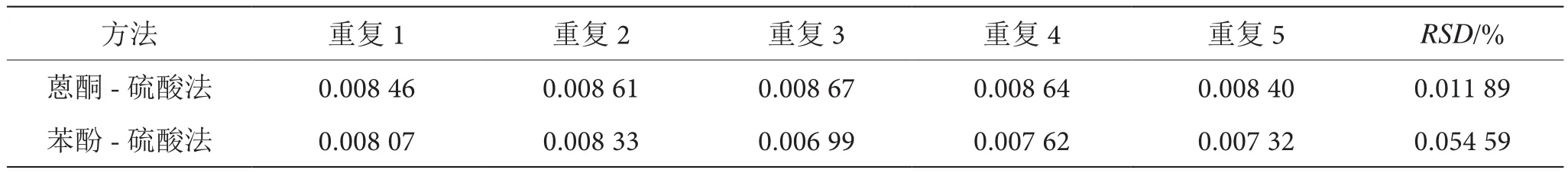
表5 蒽酮-硫酸法与苯酚硫酸法测定苦瓜多糖的重复性比较表

表6 蒽酮-硫酸法与苯酚硫酸法测定苦瓜多糖的回收率比较表
3 讨论
因为苯酚-硫酸法加入苯酚试剂和浓硫酸是分开加入,两者之间互相影响较小,而且是先加入苯酚试剂,再加入浓硫酸,反应从加入浓硫酸开始进行。反应的进行不再需要进行外界加热,浓硫酸与溶液反应放出的热量足够让反应得以进行。反应进行30 min后基本结束,生成了稳定的橙黄色化合物,再继续放置不会再发生反应,所以稳定性和精密度比较好。反应进行得较为完全,所以回收率也比较高。而加入的试剂次数较多,每次加入试剂都会带来误差,导致重复性偏低。
在蒽酮-硫酸法测定苦瓜多糖的过程中,蒽酮试剂的加入标志着反应的开始,而11支试管不可能同时加入蒽酮试剂,在沸水浴之前,由于浓硫酸与溶液的反应放出的热使反应提前进行。所以样品的反应进行不同步,由于操作的不同,每次的反应时间不一样,所以精密度比较低。冰水浴后进行测定时,随着时间的推移,温度的回升,反应又得以进行,吸光值会变动,所以稳定性较差。在最适的反应条件下反应进行的不彻底,导致回收率偏低。由于单支试管进行实验时,只需加入蒽酮试剂,反应时间得到准确的控制,测定时可以得到一个稳定的值,所以蒽酮-硫酸法的重复性比较好。
