红芽芋超低温疗法脱毒苗基因组DNA 甲基化的MSAP分析
2019-01-24尹明华万志庭
尹明华,廖 玉,万志庭
(上饶师范学院 生命科学学院,江西上饶 334001)
表观遗传学(Epigenetics)是指在DNA序列没有发生变异的情况下基因表达的可遗传改变,且可随细胞有丝分裂和(或)减数分裂遗传给后代[1]。DNA 甲基化是一种表观遗传现象,即在 DNA 甲基转移酶的催化下,以 S-腺苷甲硫氨酸为甲基供体,将甲基转移到 DNA分子中特定碱基上的过程,主要形成5-甲基胞嘧啶[2]。DNA甲基化通过改变染色质结构、DNA 构象、DNA 稳定性及DNA 与蛋白质相互作用方式,关闭某些基因的活性从而控制基因表达[3]。DNA甲基化参与植物的生长发育和组织分化[4]。DNA甲基化作为细胞记忆的一种机制,是表观遗传学研究的“主角”[5]。
红芽芋(ClocasiaescalentaSchott),单子叶植物,属天南星科,为多年生宿根性草本植物。江西铅山素有种植红芽芋的传统,种植历史悠久,药食兼优。食用,肉质松,品质鲜美、细腻,粉而不粘,口感好;药用,增强人体的免疫功能,润肠通便,防止便秘[6]。长期以来,红芽芋多采用无性繁殖方法,不仅繁殖系数低,而且易积累病毒,如芋花叶病毒、黄瓜花叶病毒和芋羽状斑驳病毒等,导致种性退化,品质变差,产量下降[7]。超低温疗法(Cryotherapy)是近年发展起来的基于超低温保存(Cryopreservation)的一种新型高效的脱毒技术,相比传统脱毒法具有脱毒率高和脱毒率不依赖茎尖大小等两个显著优点[8]。现有研究表明,超低温保存实质是一种逆境胁迫的过程,在这个过程中,存在多种渗透胁迫,如PEG、甘露醇等,均能引发基因组 DNA 特异区段的甲基化[9]。但病毒是一种生物胁迫,用超低温保存的技术脱除病毒实际上是一种解除生物胁迫的过程。
有研究[10]表明,植物感染病毒导致的甲基化整体水平上升有利于病毒攻击时植物基因组的稳定。但超低温疗法脱毒后,再生脱毒苗的基因组DNA甲基化有何变化,尚无相关报道。检测DNA甲基化的方法主要有色谱法、酶切法、测序法、甲基化PCR检测法、芯片法等多种方法,MSAP(Methylation sensitive amplification polymorphism,甲基化敏感扩增多态性)技术是一种以甲基化修饰敏感性不同限制性内切酶和PCR为基础的新技术,灵敏度高,不受被测DNA序列信息限制,检测位点多,成本低,操作简单,重复性高,已成为检测植物基因组DNA甲基化水平和模式的重要方法[11]。本试验以红芽芋超低温疗法脱毒苗为研究对象,使用MSAP方法并结合毛细管自动电泳仪对其基因组DNA甲基化水平和甲基化模式进行分析,为超低温疗法脱毒的表观遗传研究提供基础资料。
1 材料与方法
1.1 材 料
江西铅山红芽芋带毒苗(对照组,编号为1~10);江西铅山红芽芋超低温疗法脱毒苗(处理组,编号为11~30)。以上30份材料均由上饶师范学院生命科学学院植物组织培养室提供。
1.2 方 法
1.2.1 DNA提取 采取改良的CTAB法进行DNA提取,每个样本采取0.5 g叶片进行DNA提取。
采取改良的CTAB法进行DNA提取,每个样本采取0.5 g叶片进行DNA提取。步骤如下:
①在65 ℃水浴锅中预热CTAB提取液。
②在液氮中迅速研磨样品,将粉末状材料转入2 mL离心管中,加入预热的CTAB提取液(每克样品加入3~5 mL的提取液),65 ℃保温30~60 min,每隔10 min轻轻颠倒混匀。
③11 000 r/min,离心5 min,取上清转入新的离心管中。
④加入等体积酚/氯仿,充分混匀,11 000 r/min,离心10 min,取上清转入新离心管。
⑤加入等体积氯仿,充分混匀,11 000 r/min,离心10 min,取上清转入新离心管。
⑥重复步骤④和⑤。
⑦加入2/3体积的异丙醇混匀,室温放置,沉淀15 min。
⑧11 000 r/min,离心6 min,弃上清。
⑨将沉淀用φ=70%的乙醇漂洗1次,室温条件下11 000 r/min离心2 min,弃上清,重复洗1次。
⑩往沉淀中加入50 μL 1×TE溶液,先混匀,再静置30 min,中间过程颠倒混匀1~2次。
⑪提取产物取2~3 μL,用20 g/L琼脂糖凝胶电泳检测,其余置于-20 ℃保存,备用。
1.2.2 酶切 用识别四碱基的HpaⅡ和MspⅠ同裂酶(NEB) 分别与识别六碱基的核酸内切酶EcoRⅠ(NEB) 组合对样本DNA进行双酶切,DNA 酶切反应体系为20 μL。第1个反应中,400 ng 样本DNA,2 μL 10×Buffer 4(NEB)[50 mmol/L KAc、20 mmol/L Tris-acetate、10 mmol/L MgAc2、1 mmol/L dTT(pH 7.9,25 ℃)],EcoRⅠ和HpaⅡ内切酶各0.8 μL,37 ℃保温过夜。第2个反应中,400 ng 样本DNA,2 μL 10×Buffer1(NEB) [10 mmol/L Tris-HCl、10 mmol/L MgCl2、1 mmol/L dTT(pH 7.0,25 ℃)],EcoRⅠ和MspⅠ内切酶各0.8 μL,37 ℃保温过夜。
1.2.3 连 接 在酶切片段的两端加上人工设计的与EcoRⅠ和HpaⅡ/MspⅠ酶切位点互补的人工接头(表1)。接头连接体系为20 μL:2 μL 10×T4Buffer、0.4 μL 20 μmol/LEcoRⅠ和HpaⅡ/MspⅠ接头,其余用ddH2O补齐,16 ℃过夜。
1.2.4 预扩增 预扩增反应体系为20 μL,其中含有0.4 μL 10 mmol/L dNTPs、2 μL 10×Buffer、0.2 μL 5 U/ μLTaq酶、0.5 μL 10 μmmol/L E00-primer、0.5 μL 10 μmmol/L M00-primer,其余用ddH2O补齐。反应条件为:94 ℃ 30 s,56 ℃ 1 min,72 ℃ 1 min,26 个循环,72 ℃延伸10 min。预扩增产物稀释20倍,供选择扩增用。
1.2.5 选择性扩增 选择扩增体系同预扩增体系。条件为:94 ℃预变性5 min,94 ℃ 30 s,65 ℃至56 ℃ 30 s,72 ℃ 1 min,13个循环,退火温度每个循环降0.7 ℃进行降式PCR扩增;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,23 个循环,72 ℃延伸10 min。
1.2.6 毛细管电泳 将甲酰胺与分子质量内标按100∶1的体积比混匀后,取9 μL加入上样板中,再加入1 μL稀释10倍的PCR产物。然后使用3730XL测序仪进行毛细管电泳。电泳结束后,利用GeneMarker 2.2 软件对得到的原始数据进行分析,将各泳道内分子量内标的位置与各样品峰值的位置做比较分析,得到片段大小。再根据无带和有带情况转化为0/1数据矩阵。最后进行甲基化率和甲基化模式比较分析。
2 结果与分析
2.1 DNA提取结果
琼脂糖凝胶电泳结果显示,所提取样本基因组 DNA主带清晰,无降解现象(图1)。再用紫外分光光度计测定,OD260/OD280比值为1.7~1.9,DNA的纯度较高,极少含有蛋白质,完全能满足试验对DNA的要求。
2.2 预扩增结果
预扩增产物通过20 g/L琼脂糖凝胶电泳检测,结果表明,预扩产物均匀弥散,且连续成片; 弥散带只在100~1 000 bp低分子质量区域出现,而在高分子质量区域没有出现,表明DNA消化完全,符合MSAP选扩模板的要求。

表1 试验所用接头和引物序列信息Table 1 Sequence information on adaptors and primers in this test
2.3 基因组DNA甲基化水平分析
依据HpaⅡ和MspⅠ对甲基化敏感程度不同,MSAP片段可分为4种类型:第Ⅰ类型EcoRⅠ/HpaⅡ和EcoRⅠ/MspⅠ中均有条带,甲基化的位点无改变;第Ⅱ类型EcoRⅠ/HpaⅡ有条带而EcoRⅠ/MspⅠ中无条带(仅有1条链甲基化的半甲基化位点);第Ⅲ类型EcoRⅠ/HpaⅡ无条带(两条链均甲基化)而EcoRⅠ/MspⅠ中有条带;第Ⅳ类型EcoRⅠ/HpaⅡ和EcoRⅠ/MspⅠ中均无条带[12]。本试验采用10对选择性扩增引物组合(E32MSP40、E32MSP48、E35MSP48、E36MSP43、E37MSP48、E39MSP44、E40MSP44、E50MSP43、E78MSP40、E86MSP48)对双酶切后的30个样本进行扩增(图2)。红芽芋超低温疗法脱毒苗基因组DNA甲基化水平分析见表2。从表2可知,对照组总扩增带数522条,甲基化总带数297条,总甲基化率57.06%,全甲基化带数194条,全甲基化率37.22%,半甲基化带数103条,半甲基化率19.84%;处理组总扩增带数504条,甲基化总带数339条,总甲基化率67.33%,全甲基化带数253条,全甲基化率50.2%,半甲基化带数86条,半甲基化率17.13%。表明超低温疗法脱毒后,总甲基化率提高10.27%,全甲基化率提高12.98%,但半甲基化率下降2.71%。

编号1~30和M分别表示样本1~30和Marker No. 1-30 and M represent samples 1-30 and marker,respectively
2.4 基因组DNA甲基化模式分析
红芽芋经过超低温疗法脱毒后,其基因组DNA甲基化模式有3种:第1种模式为甲基化条带数无变化,可分为A1(非甲基化→非甲基化)、A2(半甲基化→半甲基化)、A3(全甲基化→全甲基化)3种类型,其比例为29.94%。第2种模式为去甲基化模式,可分为B1(半甲基化→非甲基化)、B2(全甲基化→非甲基化)、B3(超甲基化→非甲基化)、B4(超甲基化→半甲基化)、B5(超甲基化→全甲基化)5种类型,其比例为48.53%,表明红芽芋经过超低温疗法脱毒后在去甲基化模式中主要由甲基化位点变为非甲基化位点。第3种模式为甲基化模式,可分为C1(非甲基化→半甲基化)、C2(非甲基化→全甲基化)、C3(非甲基化→超甲基化)、C4(半甲基化→超甲基化)、C5(全甲基化→超甲基化),其比例为18.20%。表明红芽芋经过超低温疗法脱毒后在甲基化模式中主要由非甲基化位点变为甲基化位点。在第2种去甲基化模式中由甲基化位点变为非甲基化位点的比例为48.53%,在第3种甲基化模式中由非甲基化位点变为甲基化位点的比例为18.20%(表3)。可见,在红芽芋经过超低温疗法脱毒后,甲基化和去甲基化并存,但主要是以去甲基化为主,说明超低温疗法脱毒后较多的基因表达被激活。
每个引物扩增图左为HpaⅡ,右为MspⅠ Left of amplification of each primer wasHpaⅡ,and the right wasMspⅠ
图2E32MSP40、E32MSP48、E35MSP48和E36MSP43引物组合对样本1的MSAP扩增产物检测
Fig.2MSAPamplificationproducttestofsample1basedonE32MSP40,E32MSP48,E35MSP48andE36MSP43
3 讨 论
病毒侵染植物是一种生物胁迫[13]。目前有关生物胁迫对植物的表观遗传影响的研究已有报道。一般集中于烟草花叶病毒等[14]。对感染烟草花叶病毒植物的后代进一步分析显示,它们的基因组已大幅度超甲基化[10]。后代的全基因组超甲基化被认为是抵抗胁迫的一般保护机制的一部分,而重组事件的增加和由病毒攻击导致的特异性甲基化模式可能是植物适应性反应的迹象[14]。而这种适应性反应的迹象将使植物的基因表达得到抑制,病毒的长期积累将使植物的某些基因甲基化从而无法表达,最终导致植物的种性退化、产量和品质下降。
研究表明,超低温处理对植物材料的甲基化有一定程度的影响。朱文涛等[15]的研究表明,超低温保存玻璃化法保存成活的五叶草莓甲基化水平降低6.73%,这与木瓜[16]、 蛇麻草[17]、拟南芥[18]等植物超低温保存后的甲基化变化趋势相类似。而超低温疗法脱毒是以超低温保存的技术来快速有效脱除植物病毒,实质上是解除病毒这种生物胁迫的过程。从理论上讲,超低温疗法脱毒是解除病毒的生物胁迫,将会使植物的某些基因去甲基化,从而在一定程度上恢复植物的种性,提高其产量和品质。

表2 红芽芋超低温疗法脱毒苗基因组DNA甲基化水平分析Table 2 Analysis of genomic DNA methylation level in virus-free plantlets by cryotherapy of red bud taro
注:总甲基化率=[(Ⅱ+Ⅲ+Ⅳ)]/(Ⅰ+Ⅱ+Ⅲ+Ⅳ)]×100%;全甲基化率=[(Ⅲ+Ⅳ)]/(Ⅰ+Ⅱ+Ⅲ+Ⅳ)]×100%;半甲基化率=[Ⅱ/(Ⅰ+Ⅱ+Ⅲ+Ⅳ)]×100%。
Note:Total methylation rate=[(Ⅱ+Ⅲ+Ⅳ)]/(Ⅰ+Ⅱ+Ⅲ+Ⅳ)]×100%;full-methylation rate=[(Ⅲ+Ⅳ)]/(Ⅰ+Ⅱ+Ⅲ+Ⅳ)]×100%; hemi-methylation rate=[Ⅱ/(Ⅰ+Ⅱ+Ⅲ+Ⅳ)]×100%.
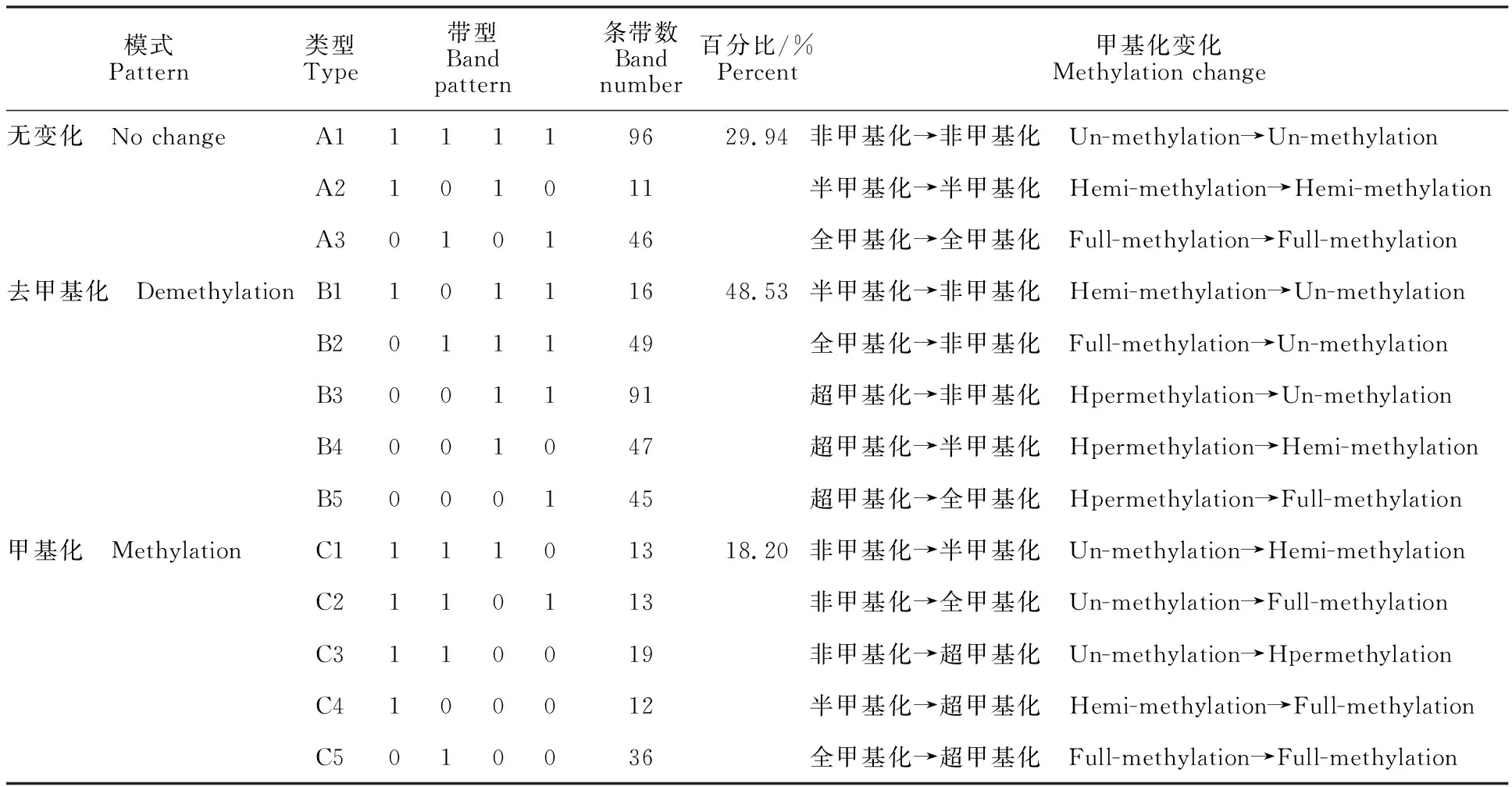
表3 红芽芋超低温疗法脱毒苗基因组DNA甲基化模式分析Table 3 Analysis of genomic DNA methylation patterns in virus-free plantlets by cryotherapy of red bud taro
但超低温疗法脱毒不同于茎尖常规培养脱毒,在超低温疗法脱毒过程中牵涉到超低温胁迫和渗透胁迫等非生物胁迫的因素,在解除病毒生物胁迫的同时,也遭受到超低温胁迫和渗透胁迫等非生物胁迫。但目前的研究偏重于对超低温保存后再生植株的甲基化研究,没有考虑到脱毒方面的效应,如王芳等[19]对马铃薯茎尖玻璃化法超低温保存后的 DNA 甲基化遗传变异进行研究,发现经超低温保存后去甲基化和甲基化都有发生,但以去甲基化变化为主。何艳霞等[20]在对拟南芥幼苗的超低温保存研究中,也发现有去甲基化现象。这些研究表明,超低温保存后植物材料存在去甲基化和甲基化,但去甲基化变化是主要趋势。在本试验中,以超低温疗法脱毒的红芽芋为研究对象,考察超低温保存和脱毒对红芽芋甲基化水平和甲基化模式的影响,发现超低温疗法脱毒苗总甲基化率提高10.27%,全甲基化率提高12.98%,但半甲基化率下降2.71%。红芽芋超低温疗法脱毒苗去甲基化模式和甲基化模式并存,但去甲基化模式高于甲基化模式,说明超低温疗法脱毒后有较多的基因表达被激活。究其原因,可能是脱毒和超低温保存两者平衡的结果,一是解除病毒生物胁迫,二是给予超低温胁迫和渗透胁迫等非生物胁迫,最终去甲基化模式高于甲基化模式可能也是植物适应性反应的迹象,导致更多的基因得到表达,低温疗法脱毒可恢复种性的机理可以从甲基化水平和甲基化模式去解释。这种变化趋势可能是植物对超低温保存这种逆境处理和病毒胁迫解除的一种综合适应,其内在机制目前未明,需要深入探讨。另外,超低温疗法脱毒中的甲基化能否引起基因的差异表达,也需要更深入地探讨。本研究结果可为红芽芋脱毒苗的种质保存和规模化生产提供理论依据。
