miR-9对人胃癌细胞株活化白细胞黏附分子基因表达的靶向调控作用
2019-01-24余丹纯聂玉强黄耀星孙小娟
余丹纯,聂玉强,黄耀星,孙小娟
广州市第一人民医院消化内科,广东 广州 510180
活化白细胞黏附分子(activated leukocyte cell adhesion molecule,ALCAM)也称CD166,是一种广泛存在于人体各个组织器官的糖蛋白,是免疫球蛋白超家族的成员之一,已有研究证实,其在胃癌组织中高表达,且与转移有关[1-3]。微小RNA(miRNA)是真核生物中一类21~25个核苷酸的非编码小分子RNA,在进化上具有高度保守性,通过与靶基因mRNA 3′端非编码区(3′untranslated region,3′UTR)互补而抑制或促进靶基因mRNA降解或抑制其翻译,从而对基因进行转录后的表达调控,作为一类潜在的癌基因或抑癌基因发挥作用[4-6]。探讨研究靶向调控ALCAM的miRNA,可能为胃癌的治疗提供新切入点。本研究运用生物信息学软件预测靶向调控ALCAM的miRNA,并通过双荧光素酶报告基因系统、SYBR Green荧光定量PCR和Western blotting等实验技术检测验证其靶向调控作用。
1 材料与方法
1.1细胞和主要试剂人正常胃黏膜GES-1细胞株和SGC-7901、MGC-803、BGC-823胃癌细胞株由ATCC引入,实验室冻存。质量浓度为100 g/L的胎牛血清、RPMI 1640培养基、DMEM培养基购自Gibco公司;DH 5α购自广州博川生物科技有限公司;限制性内切酶Sgf I和Not I购自NEB公司;pEASY-Blunt Cloning Vector购自北京全式生物技术有限公司;psiCHECK-2及Dual Luciferase Reporter Assay System购自Promega公司;miR-NC、miR-9 mimics、miR-9 inhibitor购自Ambion公司;总RNA和总蛋白提取试剂盒、PCR引物、Lipofectin 2000购自Invitrogen公司;逆转录试剂盒、SYBR Green试剂盒购自TaKaRa公司;鼠抗人ALCAM单克隆抗体购自Thermo Fisher Scientific公司。
1.2生物信息学预测调控ALCAM的miRNA采用MiRanda、TargetScan和Pictar 3个生物信息学软件对调控ALCAM的miRNA进行预测,选择3种计算方法预测结果的交集。
1.3细胞培养及实验对象确定将GES-1、SGC-7901、MGC-803和BGC-823细胞株置于质量浓度为100 g/L的胎牛血清的RPMI 1640培养液中,在37 ℃、体积分数为5%的CO2孵箱中培养,每2~3 d用质量浓度为2.5 g/L的胰酶消化传代,取对数生长期细胞进行实验。SYBR Green荧光定量PCR检测各细胞株ALCAM mRNA的表达量,确定实验对象。
1.4总RNA提取及RT-PCR收集细胞,Trizol试剂盒提取总RNA,在Bio Photometer Plus艾本德核酸蛋白测定仪上测定RNA的浓度和纯度,按M-MLV说明书进行逆转录合成cDNA备用。
1.5ALCAM双荧光素酶报告基因载体及突变载体构建运用Primer 5软件设计PCR扩增引物,ALCAM-3′UTR-F:5′-GCGATCGCCCAATTGAAGCATGAACGTGG-3′,ALCAM-3′UTR-R:5′-GCGGCCGCATCTTTTAGGCATAGACGGGTATG-3′,ALCAM-3′UTR-Mut-F:5′-GGGAAA-ATGGTTTCTTATTTGTTTTGCATGGCTAAGCC-3′,ALCAM-3′UTR-Mut-R:5′-CCCCTTTTAGAAACCATTAAATGTTGACCAAGATTC-3′,扩增合成ALCAM 3′UTR和ALCAM-mut 3′UTR片段,片段长度为 1 030 bp,两端带有Sgf I和Not I的酶切位点。将ALCAM 3′UTR和ALCAM-mut 3′UTR片段分别链接至T载体(pEASY-Blunt Cloning Vector),转化感受态大肠埃希菌DH 5α,LB/Kam培养基筛选克隆成功重组子,分别命名为ALCAM-T和ALCAM-mut-T,送华大基因公司进行基因测序。经测序鉴定后分别提取ALCAM-T/ALCAM-mut-T阳性克隆和psiCHECK-2载体质粒,双酶切质粒,将ALCAM 3′UTR/ALCAM-mut 3′UTR链接至psiCHECK-2,转化感受态大肠埃希菌DH 5α,LB/Kam培养基筛选克隆成功重组子,提取质粒,Sgf I和Not I双酶切鉴定,分别命名为psiCHECK-2-ACALM和psiCHECK-2-ALCAM-mut。
1.6双荧光素酶报告基因活性检测将SGC-7901细胞以1×105ml-1的密度接种于24孔板上(计数后,按5×104个细胞/孔接种),细胞汇合度为50%~60%时,根据Lipofectin 2000(Invitrogen公司)说明书,每孔加入20 μmol/L的miRNA 1 μl和0.5 μg质粒进行共转染。实验分组如下:(1)未转染的空白对照组;(2)共转染miR-NC、psiCHECK-2-ALCAM或psiCHECK-2-ALCAM-mut;(3)共转染miR-9 mimics、psiCHECK-2-ALCAM或psiCHECK-2-ALCAM-mut;(4)共转染miR-9 inhibitor、psiCHECK-2-ALCAM或psiCHECK-2-ALCAM-mut;每组设4个复孔。转染24 h后,每孔用PBS洗2次,加入100 μl的PLB(Passive Lysis Buffer),室温轻微振摇15 min,收集细胞裂解液,将20 μl细胞裂解液加入发光板后,用GloMax生物发光检测仪读取背景值2 s,每个样品加入100 μl LAR Ⅱ 工作液,快速混匀,读值2 s,读值完毕后,每样品再加入100 μl Stop & Glo®Reagent,快速混匀后,放入发光检测仪中,读值2 s。保存数据,检测结果分析,F:萤火虫萤光素酶;R:海肾萤光素酶,归一化值=(R/F)样品/(R/F)空白对照。
1.7SYBRGreen荧光定量PCR检测ALCAMmRNA的表达水平运用Primer 5软件设计PCR扩增引物,ALCAM-F:5′-TTTTACTTACCAGGACAGC-3′,ALCAM-R:5′-GACATAGTTTCCAGCATC-3′,扩增片段为327 bp;内参GAPDH-F:5′-GCACCGTCAAGGCTGAGAAC-3′,GAPDH-R:5′-TGGTGAAGACGCCAGTGGA-3′,扩增片段138 bp。总反应体系20 μl,PCR反应条件:95 ℃ 5 min,95 ℃ 15 s,60 ℃ 15 s,72 ℃ 32 s,40 循环,对60~95 ℃升温整个过程进行全程荧光信号收集,绘制融解曲线,每个样本重复3次。2-△△Ct法分析样品中ALCAM基因的相对表达量。
1.8Westernblotting检测ALCAM蛋白的表达水平收集细胞,用RIPA裂解细胞样品并提取总蛋白,BCA法测量蛋白浓度;煮沸变性,经SDS-PAGE凝胶电泳后,将蛋白转膜至PVDF,洗涤封闭,4 ℃冰箱孵育一抗(鼠抗人1∶1 000 ALCAM单克隆抗体)过夜,TBST洗涤,然后室温孵育二抗(羊抗鼠1∶10 000)1 h,以GAPDH为内参,最后用ECL化学法进行曝光、显影;采用灰度分析软件计算ALCAM蛋白相对表达量,实验重复3次。

2 结果
2.1预测miR-9是ALCAM潜在的靶向调控基因应用3个生物信息学数据库(MiRanda、TargetScan和Pictar)预测靶向调控ALCAM的miRNA,结果显示,miR-9是ALCAM潜在的调控miRNA,ALCAM 3′UTR含有1个miR-9的结合位点。
2.2各细胞株中ALCAM基因mRNA的表达SGC-7901、MGC-803和BGC-823胃癌细胞株ALCAM mRNA表达量分别为1.006±0.132、0.675±0.089和0.768±0.078,明显高于人正常胃黏膜GES-1细胞株
(0.004±0.0006),差异有统计学意义(P<0.05),其中SGC-7901细胞株mRNA表达水平最高,确定其为实验细胞株。
2.3ALCAM3′UTR和ALCAM-mut3′UTR片段扩增合成成功将ALCAM-T和ALCAM-mut-T送华大基因公司进行基因测序,经测序确认扩增出来的ALCAM基因3′UTR序列是正确的,ALCAM 3′UTR突变后hsa-miR-9-5p结合部位已经突变,如红色框部位所示(见图1)。
2.4miR-9与ALCAM基因3′UTR的相互作用分组转染后通过双荧光素酶报告基因系统进行检测,结果显示,在SGC-7901细胞中,psiCHECK-2-ALCAM质粒共转染了miR-9 mimics的细胞组相对荧光素酶活性(3.717±0.0578)较psiCHECK-2-ALCAM质粒共转染了miR-NC、miR-9 inhibtor的细胞组或空白对照组(5.943±0.051、5.905±0.209、5.988±0.884)明显降低(P<0.05)。而共转染了psiCHECK-2-ALCAM-mut质粒的miR-NC、miR-9 mimics或miR-9 inhibitor的细胞组相对荧光素酶活性(4.572±0.075、4.683±0.157、4.380±0.108)与空白对照组(4.491±0.016)相比,差异无统计学意义(P>0.05),说明miR-9直接与ALCAM基因3′UTR互补结合而发挥调节作用(见图2)。

图1 ALCAM-mut-T质粒突变部位测序示意图Fig 1 ALCAM-mut-T sequencing of plasmid mutation sites
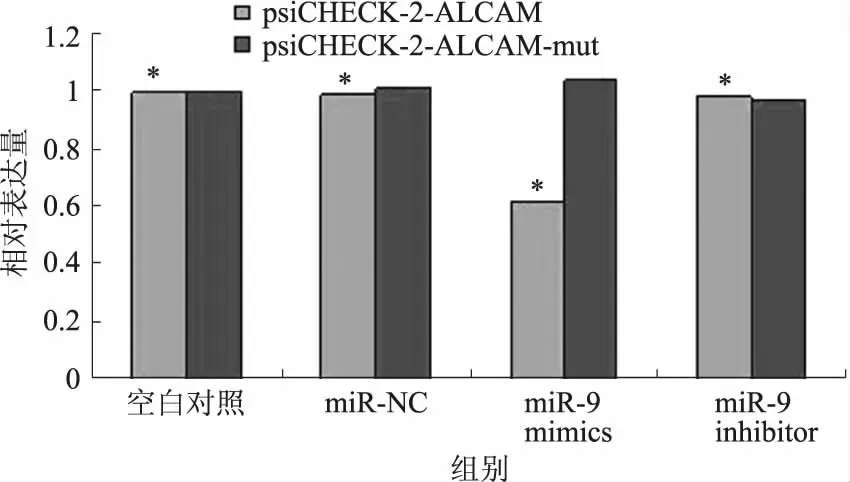
注:与miR-9 mimics细胞组相比,*P<0.05。图2 miR-9与ALCAM基因3′UTR的相互作用Fig 2 Interaction between miR-9 and ALCAM 3′UTR
2.5miR-9对ALCAM表达的影响通过SYBR Green荧光定量PCR和Western blotting检测miR-9对ALCAM表达水平的影响,结果显示,psiCHECK-2-ALCAM质粒共转染miR-9 mimics的细胞组ALCAM mRNA的表达水平(0.280±0.07)和蛋白表达水平(0.335±0.019)较psiCHECK-2-ALCAM质粒共转染miR-NC、miR-9 inhibitor的细胞组或空白对照组ALCAM mRNA的表达水平(1.015±0.452、2.232±0.522、1.006±0.132)和蛋白表达水平(0.507±0.021、0.754±0.113、0.559±0.029)明显降低(P<0.05)(见图3~4)。
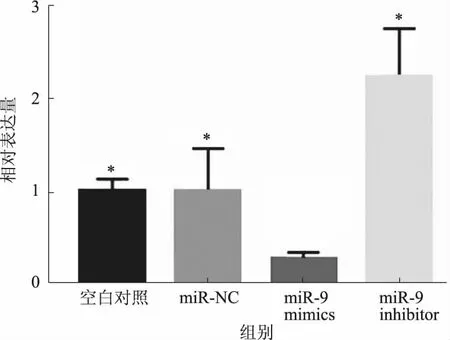
注:与miR-9 mimics细胞组相比,*P<0.05。图3 ALCAM mRNA的相对表达量Fig 3 Relative expression of ALCAM mRNA

注:与miR-9 mimics细胞组相比,*P<0.05。图4 ALCAM蛋白的相对表达量Fig 4 Relative expression of ALCAM protein
3 讨论
多项研究发现,ALCAM在多种肿瘤细胞包括乳腺癌、食管癌和结肠癌中高表达且与患者的预后有关[7-9]。而ISHIGAMI等课题组[1-3]的前期研究则发现了ALCAM在胃癌组织中高表达,且与转移有关。本研究通过SYBR Green荧光定量PCR检测对比人胃黏膜GES-1细胞株及SGC-7901、MGC-803和BGC-823等胃癌细胞株中ALCAM mRNA的表达水平,发现人胃黏膜GES-1细胞株中ALCAM基因的表达量极低,而各胃癌细胞株中ALCAM基因的表达水平升高,再次证实ALCAM在胃癌细胞中高表达,与前期实验结果一致。综上,ALCAM基因与胃癌的发生、发展有关,进一步研究其调控机制将有助于胃癌的治疗及改善预后。
发现和确认肿瘤相关的miRNA可为肿瘤的治疗提供新的切入点。本研究应用MiRanda、TargetScan和Pictar 3个生物信息学软件对调控ALCAM表达的miRNA进行预测,均提示ALCAM 3′UTR有miR-9结合位点,推测miR-9可能是靶向调控ALCAM基因的miRNA。荧光素酶报告基因系统是目前常用的miRNA精确靶点验证方法,其判断原理是:miRNA与报告基因mRNA下游插入的预测靶基因3′UTR序列特异性结合后,将抑制报告基因的表达,与对照组相比,报告基因荧光素酶活性将明显降低。本研究分组共转染miRNA和重组质粒后经双荧光素酶报告基因系统检测发现miR-9明显抑制psiCHECK-2-ALCAM质粒的荧光素酶活性,而对突变体psiCHECK-2-ALCAM-mut的荧光素酶表达无明显影响,说明miR-9直接与ALCAM基因3′UTR互补结合而发挥调节作用。而进一步通过SYBR Green荧光定量PCR及Western blotting检测miR-9对ALCAM表达的影响,发现miR-9显著抑制ALCAM mRNA和蛋白的表达水平。上述实验阐明ALCAM基因在胃癌细胞株中高表达,miR-9直接负性调控SGC-7901胃癌细胞中ALCAM的表达,为今后胃癌治疗的研究提供新方向,值得我们关注和深入研究。
