奶牛乳腺炎致病机制的表观遗传调控研究进展
2019-01-23张晓建安志兴王三虎白跃宇
张晓建,赵 俭,张 伟,安志兴,王三虎,白跃宇
(1.河南科技学院动物科技学院,河南新乡 453003; 2.河南省畜牧局动物卫生监督所,河南郑州 410100)
奶牛乳腺炎是一种由病原微生物感染、理化因素刺激或奶牛自身遗传等因素引起的一种常见而又复杂的乳腺综合症,不仅导致奶牛产奶量下降,也可降低乳制品质量,甚至危害人类健康。全世界约有1/3的奶牛患有各种类型的乳腺炎,每年因此造成的经济损失高达350亿美元,乳腺炎是奶牛养殖中最为常见、最难防治、花费最多、严重制约奶牛业发展的疾病之一[1]。
目前,尽管在奶牛乳腺炎临床诊断、抗生素治疗和发病机制调控等方面取得了一定进展,但是关于奶牛乳腺炎致病的分子机制仍不十分清楚。奶牛乳腺炎作为炎症反应的一种,受遗传和非遗传因素共同影响,其中,表观遗传在炎症的发生发展过程中发挥着重要的调控作用。表观遗传是基于非基因序列改变致基因表达水平变化,具体方式包括DNA甲基化、组蛋白修饰、染色质重塑和非编码RNA调控等[2]。众多研究发现,多种癌症、自体免疫疾病、慢性炎症的发生都与表观遗传的异常调控相关,奶牛乳腺炎也不例外。因此,本文拟从多种表观遗传调控方面,就奶牛乳腺炎相关表观遗传调控机制进行系统综述,以期为奶牛乳腺炎发生和发展的分子机制研究以及有效防控提供参考资料。
1 表观遗传调控与乳腺炎
1.1 DNA甲基化与乳腺炎 DNA甲基化作为最早发现的表观遗传调控方式之一,是在DNA甲基化转移酶(DNMT1、DNMT3a和DNMT3b)的作用下,在基因组CpG二核苷酸的胞嘧啶5'碳位共价键结合1个甲基基团,进而导致基因表达的改变,并可能传递给下一代[3]。这种调节方式与人类胚胎干细胞发育[4]、炎症发生[5]和肿瘤疾病[6]之间存在密切关系,特别是CpG岛甲基化的变化可致使抗病基因转录失活或者致病基因转录激活,最终导致疾病的发生、发展,而这也成为现在一些包括奶牛乳腺炎在内的疾病研究的新切入点。
研究发现,CXCR1基因g.+519 CpG位点的甲基化水平与奶牛乳腺炎的发病存在相关性,患奶牛乳腺炎的乳腺组织中CXCR1基因的甲基化水平显著低于健康奶牛,与之相应的是,金黄色葡萄球菌诱导的乳腺炎奶牛CXCR1表达水平是未感染的12倍[7]。αS1-酪蛋白基因(αS1-Casein,CSN1S1)启动子区的甲基化水平调控酪蛋白的表达不仅与奶牛泌乳状态有关,也与乳腺炎的发病状态相关。干乳期、泌乳初期和泌乳高峰期的CSN1S1启动子区的甲基化水平分别为低甲基化、去甲基化和高甲基化状态,而酪蛋白表达水平也依次由几乎不表达到逐渐上升,最后高表达;另外,用金黄色葡萄球菌感染奶牛乳腺组织24 h后,出现临床症状时,CSN1S1启动子区又出现再甲基化现象,感染乳区显著高于未感染乳区(50% vs 10%),酪蛋白几乎不表达[8]。Wang等[9]研究也发现,患临床型乳腺炎奶牛CD4基因启动子区甲基化程度显著高于健康奶牛。这些研究结果表明,DNA甲基化状态可能通过调节相关乳腺炎候选基因的表达进而参与奶牛乳腺炎的发生发展过程。鉴于此,Song等[10]进行了金黄色葡萄球菌型隐性乳房炎奶牛外周血淋巴细胞的全基因组DNA甲基化图谱分析,鉴定出58个差异表达基因存在甲基化状态变化,并进一步验证了3个新的DNA甲基化修饰候选基因,即MST1、NRG1和NAT9,且可作为潜在的金黄色葡萄球菌型隐性乳房炎抗性生物学标记。
1.2 组蛋白修饰与乳腺炎 组蛋白修饰是影响乳腺炎发生的另一类重要的表观遗传密码(表1)。组蛋白是染色体基本结构——核小体中的重要组成部分,其N-末端氨基酸残基可发生乙酰化、甲基化、磷酸化、泛素化等多种共价修饰,这些修饰都是可逆性修饰[11-13]。
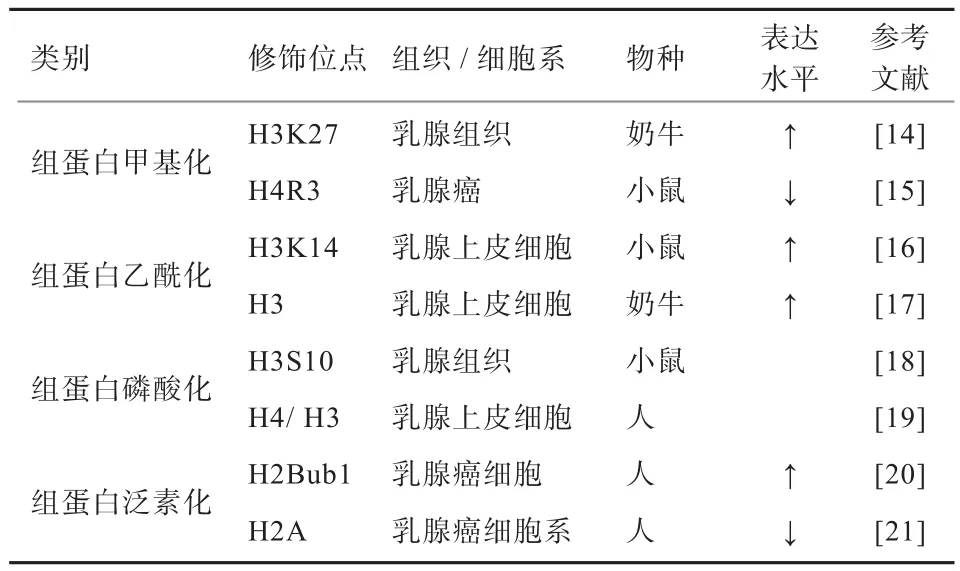
表1 乳腺组织/乳腺细胞系中的组蛋白表观遗传调控
1.2.1 组蛋白甲基化 组蛋白的甲基化属于表观遗传学的研究范畴,由不同的特异性组蛋白甲基转移酶(Histone H3-Selective Methyltransferase,HMT)催化形成。它是通过组蛋白甲基转移酶和去甲基化酶的相互作用,动态地调节组蛋白的甲基化状态及其与其他功能蛋白的相互作用,来调控基因转录的激活和抑制的生物学过程[22]。乳腺上皮细胞经支原体刺激后,由于赖氨酸特异性组蛋白去甲基化酶活性降低,而抑制了乳腺上皮细胞的先天免疫应答[23]。金黄色葡萄球菌致病的亚临床奶牛乳腺炎组蛋白H3第27号位赖氨酸(Histone H3 Lysin 27,H3K27)三甲基化全基因组调控分析发现,患病乳腺组织中沉默基因的H3K27三甲基化水平显著高于健康组,而且牛淋巴细胞中被H3K27三甲基化调控的差异表达基因与亚临床型乳腺炎存在相关性,且位于转录起始位点上游2 000 bp处。同时也说明这些差异表达基因可以作为抗乳腺炎研究和育种的标记基因[14]。
1.2.2 组蛋白乙酰化 乙酰化由组蛋白乙酰基转移酶(Histone Acetyltransferase,HAT)催化,去乙酰化由组蛋白去乙酰基酶(Histone Deacetylase,HDAC)催化,通过激活基因表达。Modak等[16]研究发现,患乳腺炎小鼠的乳腺上皮细胞和免疫细胞中组蛋白H3第14号位赖氨酸(Histone H3 Lysin 14,H3K14)均处在高乙酰化水平,而且乙酰化的组蛋白H3K14大多富集在过表达免疫基因的启动子区域,可见这是机体构建激烈炎症反应的先决条件之一。Ochoa-Zarzosa等[17]也证明了在丙酸钠的刺激下乳腺上皮细胞组蛋白H3乙酰化水平上升,进一步介导先天免疫应答基因表达,从而形成了对细菌入侵的防御机制。这也为通过添加抗生素替代品,并利用表观遗传调控治疗奶牛乳腺炎提供了一个很好的途径。
1.2.3 组蛋白磷酸化 Kutanzi等[18]发现,小鼠乳腺组织在雌激素或者离子辐射作用下,不仅显著改变了组蛋白H3和H4的甲基化和乙酰化水平,首次证实这2种处理对p42/44 MAPK和p38通路有显著的促进作用,且同时提升了组蛋白H3第10号位丝氨酸的磷酸化水平。Wang等[19]也发现,离子辐射可以引发组蛋白H3和H4的磷酸化、甲基化和乙酰化,而被修饰过的组蛋白可以促进MiR-34a的表达,进而调控人乳腺上皮细胞周期阻滞、细胞凋亡和细胞衰老等生理过程。这在一定程度上佐证了环境因素可以通过不同的表观遗传调控方式改变机体的生理效应,也为研究表观遗传调控乳腺炎发生发展进程提供了一个很好的切入点。
1.2.4 组蛋白泛素化 组蛋白的泛素化修饰与经典的蛋白质的泛素调节途径不同,不会导致蛋白质的降解,但是能够招募核小体到染色体、参与X染色体的失活、影响组蛋白的甲基化和基因的转录。组蛋白的去泛素化修饰同样与染色质的结构及基因表达密切相关。研究发现,组蛋白H2B单泛素化(Histone H2B Monoubiquitination,H2Bub1)可以影响染色体的多方面功能,包括转录调控和DNA修复,并且有实验证实H2Bub1水平的上升可以抑制非转换的人乳腺上皮细胞和乳腺癌细胞的迁移,进而抑制乳腺癌发生、发展进程[24-25]。
1.3 非编码RNA与乳腺炎 随着基因组学、系统生物学和生物信息学的快速发展,尤其是高通量测序技术的大量应用,越来越多与乳腺癌或者乳腺炎有关的非编码RNA的调控机制被逐一揭示,其中研究较多、具调控作用的非编码RNA主要包括microRNA(miRNA)、circRNA以及长链非编码RNA(lncRNA)(表2)。非编码RNA参与了染色体的转录与失活、基因的表达与关闭、细胞周期乃至个体发育等过程,其突变或表达异常与包括奶牛乳腺炎在内的许多疾病的发生密切相关,不再被认为是不能编码蛋白质的垃圾RNA。
1.3.1 miRNAs与乳腺炎 miRNA是一类长度为19~25 nt的高度保守的内源性非编码小RNA,它们是生物基因调控网络的重要组成,通过结合到与其种子序列互补配对的靶基因上降解靶mRNA或者抑制靶mRNA的翻译,从而在转录后水平调控基因的表达。研究发现,miRNA在固有性免疫应答、病原体感染与免疫及炎症的免疫调控中扮演着极其重要的角色。
Sun等[26]利用二代测序技术构建了感染金黄色葡萄球菌和健康荷斯坦奶牛的乳汁中外泌体的miRNA差异表达谱,结果显示存在14个已知牛miRNA差异表达,其中 bta-miR-142-5p和bta-miR-223可能是早期检测乳腺内细菌感染潜在的生物标记。另外,Naeem等[27]在链球菌感染12 h后检测了乳腺组织中miRNAs的表达情况,发现与健康对照动物相比,miR-15b、miR-16a、miR-31、miR-145和 miR-181a显著下调,miR-223显著上调,且被鉴定的靶基因主要参与免疫学调控、代谢以及细胞增殖或分化过程,miR-16a的表达变化则与一些白细胞介素(IL-6、IL-8和IL-10)的表达上调有关,说明其在调节乳腺炎应答中扮演重要的角色。miR-223在乳腺炎中上调,它可以通过下调胰岛素生长因子1受体(IGF1R)抑制一些细胞信号传导。Jin等[28]检测了金黄色葡萄球菌 和大肠杆菌感染牛乳腺上皮细胞系Mac-T细胞后转录组miRNA的改变,共检测到17个显著差异表达的miRNA,其中金黄色葡萄球菌感染细胞后特有的差异表达miRNA有4个(batmiR-2239、miR-499、miR-23a和 miR-99b),而大肠杆菌感染细胞后的差异表达miRNA有5个(miR-184、miR-24-3p、miR-148、miR-486、let-7-5p), 这 些 新发现的miRNAs可作为潜在的奶牛2种细菌型乳腺炎诊断和预防的生物学标记。
1.3.2 lncRNAs与乳腺炎 lncRNA是长度大于 200 个核苷酸的非编码 RNA,与miRNA相比,其序列更长、空间结构也较为复杂,参与表达调控的机制也更具有多样性和复杂性。尽管目前仅有较少lncRNA的功能有相关报道,但可以明确的是,lncRNAs能在表观遗传[40]、转录[41]及转录后[42]水平调控基因表达,参与X染色体失活、基因印记、转录因子的诱饵、mRNA前体的剪接以及降解等多种重要的调控过程,与包括乳腺炎在内的众多疾病的发生、发展和防治都有着密切联系。
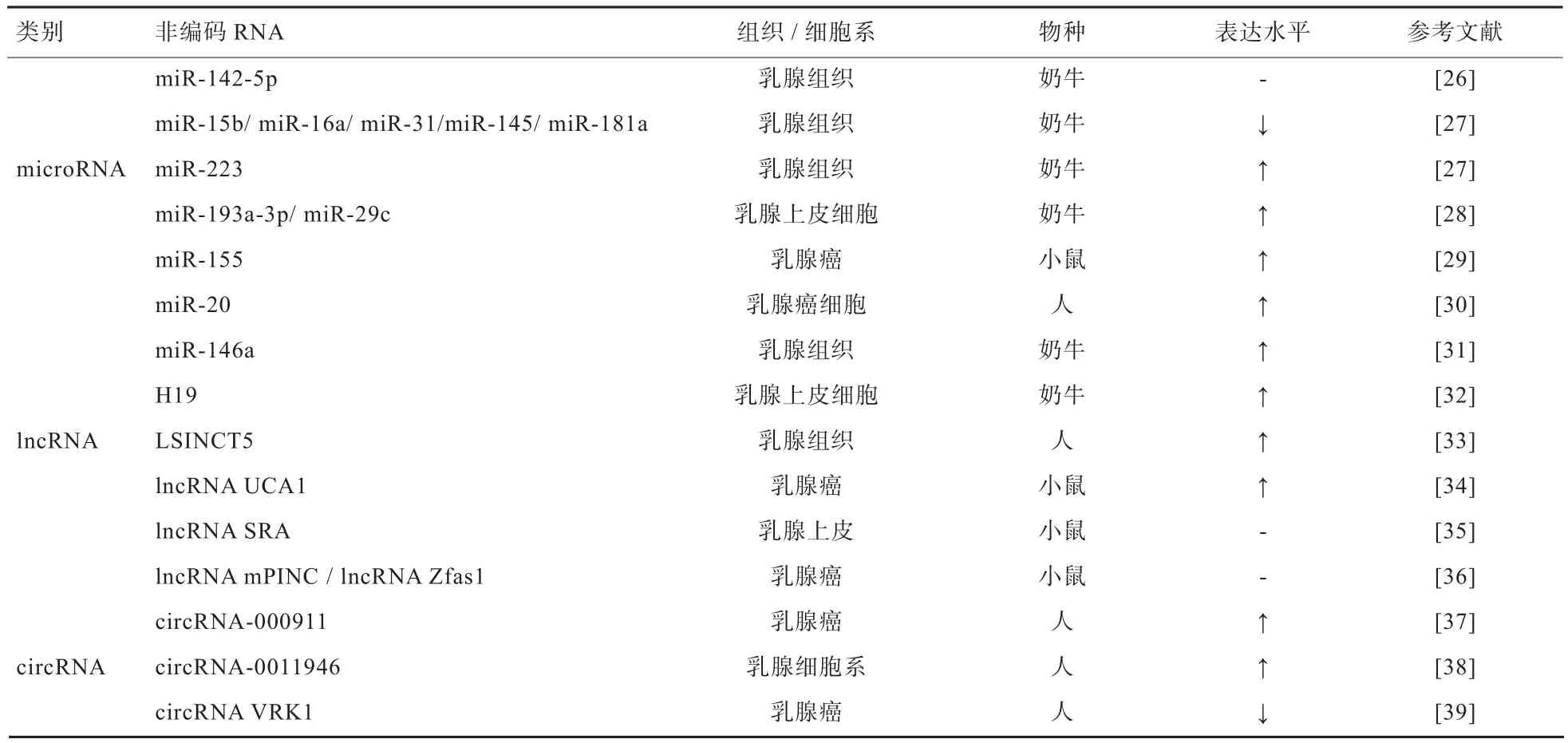
表2 乳腺组织/乳腺细胞系中的非编码RNA表观遗传调控
Shore等[43]发现,lncRNAs可以调控乳腺上皮细胞的稳态,lncRNA Neat1对于乳腺发育和泌乳是必需的[44],而且部分lncRNAs功能失调会导致乳腺癌的发生[45]。Tong等[46]通过高通量测序、生物信息学和RTPCR等技术构建了牛乳腺组织的lncRNA表达谱,推测lncRNAs可能参与多个生物学过程,特别是富集到与临床乳腺炎、牛奶质量和产量相关的lncRNAs。而Yang等[32]分别利用脂多糖(Lipopolysaccharide,LPS)和脂磷壁酸(Lipoteichoic Acid,LTA)诱导牛乳腺腺泡细胞-T(Bovine Mammary Alveolar Cell-T,MAC-T)细胞系,体外建立乳腺炎上皮细胞模型,并证明了在炎性条件下lncRNA H19参与由TGF-β1通过PI3K/AKT信号通路诱导的牛上皮-间质转化过程,并最终导致乳腺组织的纤维化。
1.3.3 circRNAs和乳腺炎 circRNAs是一类不具有5'末端帽子和3'末端poly(A)尾巴,并以共价键形成环形结构的非编码RNA分子,具有结构稳定、选择调控、高度保守等特性,起到miRNA“海绵效应”、调控基因转录、调控RNA结合蛋白和参与蛋白质反应等生物学功能,在临床上可能参与癌症、糖尿病、炎症反应和类病毒等疾病的发生、发展,circRNAs甚至还可以作为相关疾病的预后或者诊断生物标记物[47]。
目前,关于circRNAs在乳腺组织或者乳腺癌中的研究也开始有所报道。Zhang等[48]发现泌乳期大鼠乳腺组织中Rev3l、IGSF11、MAML2和LPP等4个宿主激酶基因,同时转录出高峰度的circRNAs,且与乳腺癌的发生有关;Liao等[49]发现,570个lncRNAs在乳腺上皮-间充质转换过程中差异表达,对炎性条件下乳腺上皮细胞命运起到调控作用。另外,Zhang等[50]通过RNA-seq技术和生物信息学发现,在牛乳腺中共有3 239个亲本基因被预测可产生circRNAs。泌乳期第90和250天的牛乳腺组织样本中分别有4 804和4 048个circRNA表达,且有2 231个circRNAs在2个泌乳阶段均表达,表明circRNAs表达具有阶段特异性。另外,共有80个circRNAs从4个酪蛋白编码基因(CSN1S1、CSN1S2、CSN2和CSN3)中鉴定出来,而且来自CSN1S1的circRNAs丰度很高,其中3个占在乳腺中表达的所有circRNAs的36%。这些circRNAs有多个miR-2284家族靶标位点,而miR-2284家族又可靶向CSN1S1和CSN2mRNA,这也表明circRNAs潜在参与调节酪蛋白基因的表达,而关于在牛上circRNAs能否类似人和大鼠一样参与乳腺炎的调控有待进一步研究。
2 奶牛乳腺炎表观遗传调控机制的未来研究策略
2.1 构建奶牛乳腺炎发生过程中的表观遗传调控网络组蛋白的泛素化、磷酸化、乙酰化和甲基化修饰之间存在协同和级联效应,共同形成了基因转录调控中“组蛋白密码”。这种密码的变换最终表现在染色质结构的改变,进而影响其功能,调控基因转录。Su等[51]通过结合偏相关系数和皮尔森相关系数构建了组蛋白修饰、DNA甲基化与基因表达的表观遗传互作网络(Epigenetic Interaction Network,EIN),将有助于揭示表观调控因素和基因表达之间的内在联系。Rothbart等[52]发现,蛋白UHRF1可以结合到甲基化的组蛋白H3第9号位赖氨酸上,并与组蛋白一起维持DNA甲基化过程,这在一定程度上说明了表观遗传标记组蛋白修饰与DNA甲基化之间存在关联。HDAC3和EZH2协同抑制由MYC介导的miR-29表达,可以作为一个通过靶向调控组蛋白修饰进而治疗侵袭性B细胞淋巴瘤的靶标[53];Li等[54]发现,lnc1281可以通过与lin28、let-7以及新的DNA甲基化的互作而精细调控细胞状态的转变,lncRNA H19可以通过调节S-腺苷高半胱氨酸水解酶表达而改变DNA甲基化基因组宽度[55]。酪蛋白基因上转录出的多个circRNAs通过竞争性结合miR-2284,影响miR-2284对CSN1S1和CSN2的表达,最终影响奶牛乳腺组织中酪蛋白的功能[50]。由此可以看出,DNA甲基化、组蛋白修饰和非编码RNA之间可以通过交互调控,提高表观遗传调控网络深度,也为揭秘奶牛乳腺炎表观遗传调控机制的未来研究提供了一个新的视角。
2.2 建立奶牛乳腺炎抗病育种的表观遗传标记 目前,随着基因组学技术的快速应用,决定家畜疾病表型信息的基因序列正在被逐一解码。家畜疾病表型的形成不仅取决于基因组,表观遗传标记也发挥了重要的作用。动物抗病育种技术迫切要求研究表观遗传标记对动物疾病表型形成的影响。目前,在奶牛乳腺炎抗病育种中表观遗传标记的报道相对较少,而且多是对现象的描述,并没有深入探究表观遗传标记对疾病发生的内在作用机制。另外,在奶牛分子抗病育种领域,表观遗传标记研究方兴未艾,但也面对着巨大的挑战。一是表观遗传标记在世代传递过程中的遗传规律难以探寻,这为后期的抗病育种研究带来了一定困难;二是表观遗传标记对疾病的影响具种属特异性和组织特异性,那么探寻表观遗传标记的作用模式将成为后期奶牛抗病育种中的研究热点;三是表观遗传与传统遗传有关,DNA序列本身的特异性对于DNA甲基化修饰也起着不可忽视的作用。Oertel等[56]研究发现,功能性突变OPRM1118A>G可以新增1个CpG位点,提高OPRM1在该位点以及下游的甲基化水平,不仅影响μ-opioid 受体信号通路的效率,而且通过遗传与表观遗传的互作,改变了μ-opioid受体的表达水平。因此,综合遗传分子标记与表观遗传标记两方面因素,筛选与奶牛乳腺炎致病/抗性相关的稳定表观遗传标记及靶基因,选择抗乳腺炎个体,有望选育出抗乳腺炎奶牛新品系。
2.3 基于表观遗传调控的奶牛乳腺炎治疗抗生素替代物研发 目前,表观遗传治疗主要通过DNA甲基化、组蛋白去乙酰化、组蛋白去甲基化酶以及非编码RNA等的抑制剂进行肿瘤和炎症疾病的治疗。表观遗传治疗不改变DNA和RNA序列,而仅改变DNA所编码基因的活性,因此有望替代抗生素治疗法。而这些表观遗传标记中,以DNA甲基化和组蛋白赖氨酸甲基化修饰较为稳定。Kalin等[57]发现,corin作为去甲基化酶和去乙酰化酶的抑制剂,具有双重靶标的特性,在黑色素瘤细胞培养系统和黑色素瘤动物模型中均具有抑制肿瘤细胞生长的效果,且无明显毒副作用;而且研究人员还认为,开发低毒性且有效的表观遗传药物替代抗生素是未来免疫相关疾病治疗的新方向,这也为奶牛乳腺炎非抗生素治疗指出了一条可行途径。
3 结 语
综上所述,表观遗传调控在包括乳腺炎在内的疾病发生发展中起重要作用。表观遗传标记物必将作为分子选育的重要依据之一,成为一种全新的有助于早期乳腺炎诊断的有效途径。而且,随着奶牛乳腺炎遗传-表观遗传调控网络逐渐被揭秘,低毒性且有效的替代抗生素的表观遗传药物也会应运而生,而这些目标的实现也会让人们对相关疾病机制产生新理解和新认识,并为预防和治疗提供新策略。
