变异链球菌clpP基因启动子的克隆及活性测定
2019-01-21,,,,,,,
,,,,,,,
变异链球菌(Streptococcusmutans,S.mutans)是草绿色链球菌的一种,革兰氏阳性球菌,兼性厌氧,是人类龋病的主要致病菌,可引起牙髓病、牙周病、颌骨炎,感染性心内膜炎等一系列并发症,严重影响患者的身心健康和生活质量[1-3]。变异链球菌在人类口腔中生存的酸碱度、温度、氧分压、渗透压等环境极易受到人类日常活动的影响,可在口腔中长期存活并不断繁殖,变异链球菌通过改变其蛋白质的表达状态(包括蛋白质的种类和表达的量),以消除外界变化对菌体造成的影响[3]。然而,正是这种对环境改变的应对机制使得菌体内一些小分子蛋白质迅速聚集,多为瞬时表达和受应激因素刺激而发生损伤的蛋白质分子,这些蛋白质大多不但不能行驶应有的生物学功能,如不及时清除还会对细菌造成致命的损伤[4-6]。因此,及时清除迅速聚集的小分子蛋白质和维持细菌内环境的稳态(homeostasis)成为变异链球菌生存并成为龋损部位的优势菌以及致病的关键环节。我们前期研究证实变异链球菌ClpP蛋白酶在清除应激相关蛋白质和损伤的蛋白质、维持内环境稳态中发挥重要作用[4-5]。然而变异链球菌clpP基因在对外应激耐受中以何种方式被诱导及其表达调控机制的报道尚不多见,为此本文通过构建变异链球菌clpP基因5′-侧翼序列及其突变体β-半乳糖苷酶 (β-glucuronidase,gusA)报道基因表达载体及其表达株,以研究变异链球菌clpP基因启动子生物活性及其结构,为阐明变异链球菌clpP基因表达调控的机制奠定理论和实验基础。
1 材料和方法
1.1 材料
1.1.1菌株及质粒 大肠杆菌Top 10、变异链球菌UA159为本室保存。pIB107质粒由堪萨斯大学医学中心的Indrainl Biswas教授惠赠,含有松鼠葡萄球菌ami基因启动子的gusA报道基因表达载体pFami132由本室构建保存。
1.1.2试剂 细菌基因组提取试剂盒及小量质粒提取试剂盒为天根生化科技(北京)有限公司产品,DNA marker、TaqDNA 聚合酶、限制性内切酶、T4DNA 连接酶均为TaKaRa (大连)公司产品;QIAquick PCR Purification Kit为Qiagen公司产品; p-nitrophenyl-β-D-glucoside (PNPG)为Sigma公司产品;余为国产或进口分析纯试剂。
1.2 方法
1.2.1变异链球菌UA159基因组DNA的提取 离心收集处于对数生长期的变异链球菌UA159,灭菌0.1 mol/L PBS(pH7.4)洗涤3次,按照细菌基因提取试剂盒说明书提取变异链球菌UA159的基因组DNA。
1.2.2序列片段扩增 变异链球菌clpP基因5′-侧翼序列FclpP及其突变体FclpP-ΔRS的扩增 在0.2 mL PCR反应管中建立如下反应体系:10×PCR Buffer 5 μL,dNTPs(10 mmol/L)1 μL,MgCl2(25 mmol/L)4 μL,TaqDNA聚合酶0.5 μL, 变异链球菌UA159基因组DNA 50 ng,上、下游引物各10 nmoL,加灭菌水至50 μL;反应条件为94 ℃预变性3 min,94 ℃变性45 s,56 ℃退火45 s,72 ℃延伸1 min,共30个循环,最后72 ℃延伸10 min。变异链球菌clpP基因5′-侧翼序列片段(FclpP)及其突变体片段(FclpP-ΔRS)扩增、后续PCR鉴定和测序所用的引物见表1。

表1 实验采用的引物序列及用途Tab.1 Primers used in this study and purposes
aRestriction sites used to facilitate ligation are underlined and italic.
bRS,repeat sequence.
1.2.3变异链球菌clpP基因5′-侧翼序列及其突变体gusA报道基因表达载体的构建与鉴定 变异链球菌clpP基因5′-侧翼序列FclpP及其突变体FclpP-ΔRS的PCR扩增产物经QIAquick PCR Purification Kit纯化后,限制性内切酶BamHI/XhoI酶切,与经BamHI/XhoI酶切的gusA报道基因表达载体pIB107连接,转化E.coliTop 10,氨苄西林(100 g/mL)和卡那霉素(50 g/mL)筛选,PCR及酶切鉴定阳性克隆,构建clpP基因5′-侧翼序列FclpP及其突变体FclpP-ΔRS的gusA报道基因表达载体,分别命名为pFclpP和pFclpP-ΔRS,并交由上海立菲生物工程有限公司测序。PCR及测序所用引物为Smu1405-FGus-R2,详见表1。
1.2.4变异链球菌clpP基因5′-侧翼序列及其突变体gusA报道基因表达株的构建及GusA活性测定 将含有clpP基因5′-侧翼序列FclpP及其突变体FclpP-ΔRS的gusA报道基因表达载体pFclpP和pFclpP-ΔRS、含有松鼠葡萄球菌ami基因启动子的阳性对照质粒pFami132及不含启动子的gusA报道基因表达载体pIB107经BglII线性化后,分别转化变异链球菌UA159,卡那霉素(300 g/mL)筛选,构建各待测片段gusA报道基因表达株,分别命名为SClpP、SClpP-ΔRS、SAmi(阳性对照)和SIB107(阴性对照),经PCR及测序验证后,参照文献[6]测定各待测片段gusA报道基因表达株的GusA活性,鉴定变异链球菌clpP基因5′-侧翼序列FclpP及其突变体FclpP-ΔRS启动子活性。PCR及测序所用引物分别为BamHI-clpP-F1Gus-R2和BamHI-clpP-F2Gus-R2,序列见表1。
2 结 果
2.1变异链球菌clpP基因5′-侧翼序列FclpP及其截短突变体FclpP-ΔRS的体外扩增 变异链球菌clpP基因5′-侧翼序列FclpP及其突变体FclpP-ΔRS的PCR扩增产物经1.5%琼脂糖凝胶电泳,结果显示:分别在621 bp及271 bp处有特异性明亮扩增带,相对分子量大小与预期结果一致,且未见非特异扩增带,详见图1。
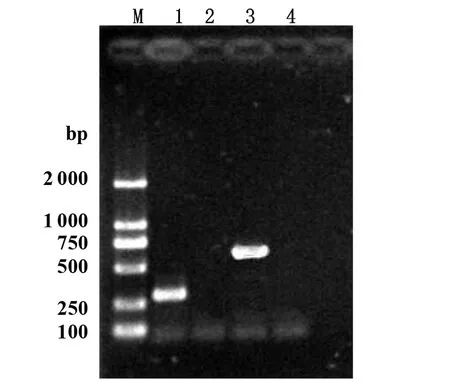
M: DNA Marker 20001: 变异链球菌clpP基因5′-侧翼序列截短突变体(FclpP-ΔRS)PCR扩增结果;2: 阴性对照;3: 变异链球菌clpP基因5′-侧翼序列(FclpP)PCR扩增结果;4: 阴性对照图1 变异链球菌clpP基因5′-侧翼序列及其截短突变体的PCR扩增结果Fig.1 Electrophoresis of 5′-flanking sequence and its shortened mutants of S.mutans clpP gene amplified by PCR
2.2变异链球菌clpP基因5′-侧翼序列及其突变体gusA报道基因表达载体的构建与鉴定 变异链球菌clpP基因5′-侧翼序列FclpP及其突变体FclpP-ΔRS经BamHI/XhoI酶切,插入到的pIB107载体,得到clpP基因5′-侧翼序列FclpP及其突变体FclpP-ΔRS的gusA报告基因表达载体pFclpP和pFclpP-ΔRS。提取质粒,行PCR及酶切鉴定,产物经1.5%琼脂糖凝胶电泳,结果显示插入片段和载体片段相对分子量大小正确。测序结果进一步证明成功构建了变异链球菌clpP基因5′-侧翼序列FclpP及其突变体FclpP-ΔRS的gusA报道基因表达载体,详见图2。
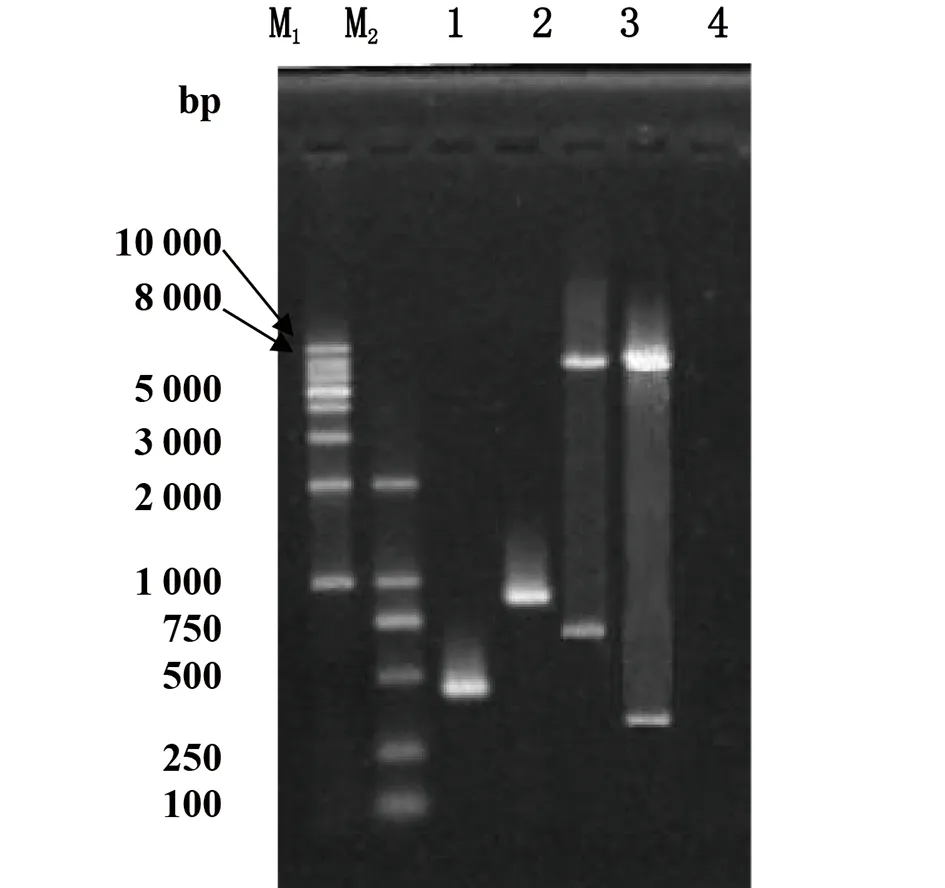
M1: DNA Marker 1kb Ladder;M2: DNA Marker 20001: pFclpP-ΔRS质粒PCR鉴定;2: pFclpP质粒PCR鉴定;3: pFclpP质粒BamHI / XhoI双酶切鉴定;4: pFclpP质粒BamHI / XhoI双酶切鉴定图2 变异链球菌clpP基因5′-侧翼序列及其截短突变体gusA报道基因表达载体的鉴定Fig.2 Identification of the gusA report plasmids of 5′-flanking sequence and its shortened mutants of S.mutans clpP gene
2.3变异链球菌clpP基因5′-侧翼序列及其突变体gusA报道基因表达株的鉴定 变异链球菌clpP基因5′-侧翼序列FclpP及其突变体FclpP-ΔRS的gusA报道基因表达载体pFclpP和pFclpP-ΔRS,连同阴性对照空载体pIB107及含有松鼠葡萄球菌ami基因启动序列的阳性对照pFami132质粒经线性化后转化变异链球菌UA159,经卡那霉素筛选,挑选阳性转化子行菌落PCR鉴定,扩增产物经1.5%琼脂糖凝胶电泳,结果显示在1 341 bp和991 bp处有特异性明亮扩增带,与预期结果相符,详见图3。测序证实变异链球菌clpP基因5′-侧翼序列FclpP或其突变体FclpP-ΔRS及gusA报道基因-kanR抗性基因盒以单拷贝插入变异链球菌转座酶基因(SMU.1405)中。
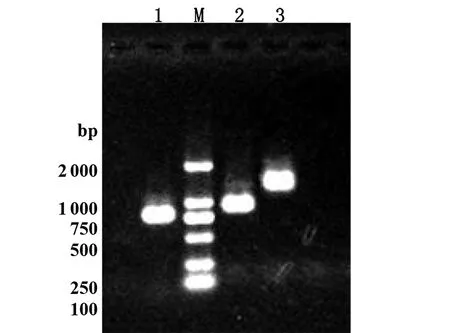
1: 转化线性化pIB107质粒的gusA报道基因表达株的PCR扩增结果;2: 转化线性化pFclpP质粒的gusA报道基因表达株的PCR扩增结果;3: 转化线性化pFclpP-ΔRS的 质粒gusA报道基因表达株PCR扩增结果 M: DNA Marker 2000图3 变异链球菌clpP基因5′-侧翼序列及其截短突变体gusA报道基因表达株的PCR鉴定Fig.3 PCR products of the gusA report strains of 5′-flanking sequence and its shortened mutants of S.mutans clpP gene
2.4变异链球菌clpP基因5′-侧翼序列及其截短突变体启动子活性 GusA活性测定结果表明变异链球菌clpP基因5′-侧翼序列gusA报道基因表达株SClpP的GusA活性是阴性对照不含启动子的gusA报道基因表达株SIB107的34.6倍之多,是阳性对照松鼠葡萄球菌ami基因启动子片段gusA报道基因表达株SAmi的8.7倍左右;clpP基因5′-侧翼序列突变体gusA报道基因表达株SClpP-ΔRS的启动子活性是阴性对照的5.2倍,是阳性对照的1.3倍,说明插入片段变异链球菌clpP基因5′-侧翼序列FclpP及其突变体FclpP-ΔRS具有较强的启动子活性。详见图4所示。
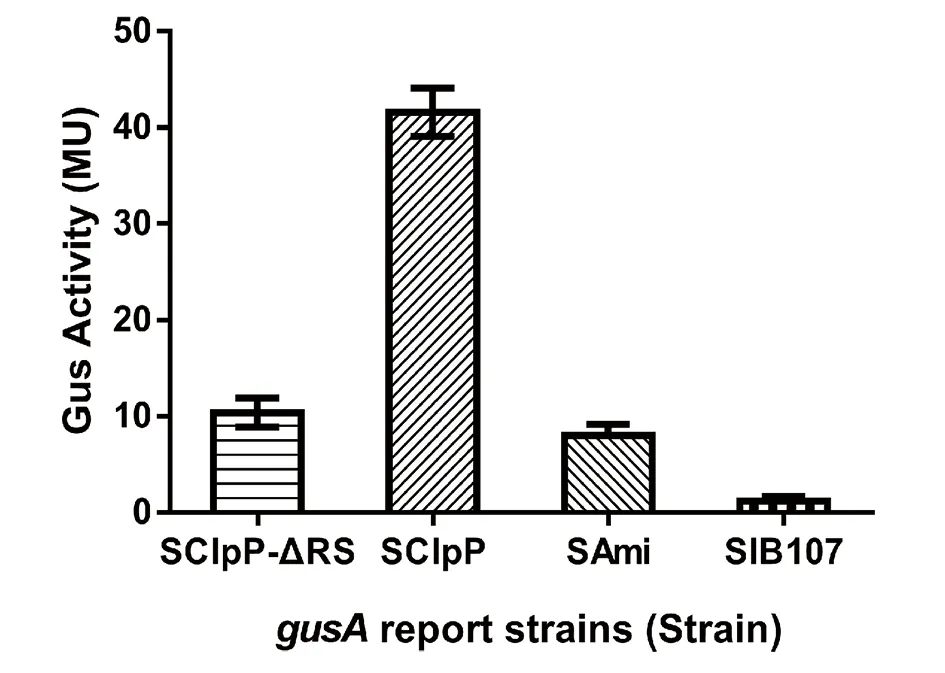
SClpP: 变异链球菌clpP基因5′-侧翼序列gusA报道基因表达株;SClpP-ΔRS: 变异链球菌clpP基因5′-侧翼序列截短突变体gusA报道基因表达株;SAmi: 阳性对照 SIB107: 阴性对照图4 变异链球菌clpP基因5′-侧翼序列及其截短突变体GusA活性测定Fig.4 GusA activity analysis of the gusA report strains of S.mutans clpP gene 5′-flanking sequence and its shortened mutants
3 讨 论
课题组前期对变异链球菌基因组结构研究表明,变异链球菌clpP基因上游为upp基因,编码尿嘧啶磷酸核糖基转移酶,其转录方向与clpP基因相同,两者之间存在一非编码区;而对clpP基因转录产物的研究发现变异链球菌UA159株clpP基因存在1.9 kb和0.67 kb两种转录产物,两者在菌体存在的时间均小于1 min;其中0.67 kb转录产物的含量占总表达产物的80%,为clpP基因转录产物,而1.9 kb转录产物占20%,为clpP基因及其上游upp基因共转录产物[6]。因此,我们推断在变异链球菌clpP基因与其上游upp基因之间的非编码区存在着clpP基因的启动子。为检测变异链球菌clpP基因与upp基因之间的非编码区是否具有启动子活性,我们将clpP基因与upp基因之间的非编码区及upp基因3′-端部分DNA片段插入到gusA报道基因表达载体pIB107的gusA报道基因的上游,构建变异链球菌clpP基因5′-侧翼序列gusA报道基因表达载体。
pIB107载体由堪萨斯大学医学中心的Indrainl Biswas教授为研究变异链球菌启动子活性而特地构建的,其BamHI/XhoI酶切位点上游无启动子序列和表达调控元件,下游即为gusA报道基因,编码β-半乳糖苷酶 (β-glucuronidase, GusA),能够水解PNPG生成淡黄色的对硝基苯胺,在420~450 nm处具有高的消光系数,可由分光光度计测定[7]。因此可通过检测GusA活性间接反映上游插入片段的启动子活性。GusA活性测定较lacZ(β-半乳糖苷酶基因)、cat(氯霉素乙酰转移酶基因)、lux(荧光素酶基因)等目前常用的测定启动子活性的方法具有背景低、灵敏度高,线性范围广、设备要求低、操作简单、快速等优点。pIB107载体的gusA报道基因的下游为kanR抗性基因盒,而变异链球菌转座酶基因(SMU.1405)5′-端及3′-端约700~900 bp的基因片段分别位于gusA报道基因的上游和kanR抗性基因盒的下游。因此线性化的载体可以借由此两同源臂与变异链球菌SMU.1405基因发生同源重组,使插入两同源臂中的插入序列以单拷贝的形式插入变异链球菌SMU.1405中,这不仅消除了载体拷贝数不同对GusA活性测定造成的影响,同时不会影响宿主菌其他基因和生物学功能,还便于重组子的筛选[8]。这种序列特异性同源重组多用于序列的定向插入或缺失,具有DNA序列不丢失、不合成等优点,是生命科学中常用的分子生物学方法和手段。
Jiaqin Zhang等[6]对变异链球菌clpP基因及其周围DNA进行序列和结构分析,分析结果显示,在clpP基因翻译起始位点上游292 bp处,有7个随机串联重复序列,其重复基序由49~50 bp的碱基组成GCGAGGCTANAGTCCAGTGGACTGT TATTTCCCGAGCTNTNAAAATNGATN。其中每个基序由一个及其保守29 bp碱基组成的核心区域,核心区域的3′及5′-侧翼序列仅有个别碱基不同。诸多研究已证实细菌的重复序列多为非编码序列,通常具有顺式作用元件的作用,对基因表达、转录调控、乃至染色体的构建以及生理代谢都起着不可或缺的作用,为初步探讨此串联重复序列的功能,我们构建了变异链球菌clpP基因5′-侧翼序列突变体gusA报道基因表达株SClpP-ΔRS,在该突变体中我们将串联重复序列进行了缺失突变。GusA活性测定表明变异链球菌clpP基因5′-侧翼序列FclpP具有较强的启动子活性,是阳性对照松鼠葡萄球菌ami基因启动子片段活性的8.7倍,说明插入片段具有较强的启动子活性,而clpP基因5′-侧翼序列突变体FclpP-ΔRS的启动子活性是阳性对照松鼠葡萄球菌ami基因启动子片段的1.3倍,因此我们推断clpP基因上游的串联重复序列具有增强clpP基因表达的功能,其作用机制尚待实验进一步证实。
综述之,本实验成功克隆了变异链球菌clpP基因启动子,GusA活性测定证实具有较强的启动子活性,同时对变异链球菌clpP基因串联重复序列进行了初步的功能验证,为后续clpP基因启动子的结构及其表达调控机制的研究提供实验依据和方法上的借鉴。
