鲟源致病性鲁氏耶尔森菌的分离、鉴定及药敏研究
2019-01-17杨昆明张文润马江霞段成任郭爱民谢志胜
杨昆明,张文润,马江霞,段成任,郭爱民,谢志胜,岳 城
( 新疆农业大学 动物医学学院,新疆 乌鲁木齐 830052 )
全世界现存26种鲟[1],我国试养的鲟多达十几种,目前形成规模养殖的种类主要有施氏鲟(Acipenserschrenckii)、西伯利亚鲟(A.baerii)、杂交鲟(Husodauricus♀ ×A.schrenckii♂)和匙吻鲟(Polyodonspathula),约占鲟养殖总产量的90%以上[2-3]。西伯利亚鲟在20世纪90年代末引入我国,并成功进行了人工繁育。因其具有生长速度快、环境适应能力强、肉厚骨软、营养丰富、味道鲜美和鱼籽品质高等优点,成为我国目前鲟鱼养殖的主导品种之一[4],也是新疆地区现阶段主要养殖的鲟鱼品种之一。随着集约化养殖的大力开展,养殖水体污染、饵料污染、渔捞的混用污染等问题接踵而至,高密度的养殖及落后的病害防治技术导致养殖鲟鱼暴发性疾病日趋严重,给养殖户造成巨大的经济损失。

2017年10月,新疆阜康某人工养殖池塘养殖的西伯利亚鲟出现摄食量下降,精神萎靡,泄殖孔红肿外突等病征,少数鱼在下颌、腹部等皮肤处有明显出血点或斑点。发病水温20 ℃,日死亡率达15%~20%,给养殖者带来了巨大的经济损失。为查明造成西伯利亚鲟死亡的原因,笔者采用临床剖检、寄生虫学、细菌学、病理学等方法进行诊断,在排除寄生虫感染和病毒感染造成死亡的情况下,怀疑是细菌感染所致。无菌剖检病鲟内脏,进行细菌分离纯化,通过革兰氏染色、生理生化试验、分子生物学试验、药物敏感性试验对分离菌进行了初步鉴定,在此基础上通过测序对细菌的16S rRNA基因序列进行分析并构建进化树,以探讨分离菌在所属菌群中的分类位置。本研究旨在丰富西伯利亚鲟细菌病病原研究资料,为鲟鱼鲁氏耶尔森菌病的有效防治提供科学依据,并为新疆地区西伯利亚鲟健康养殖和疾病防控增加新的内容。
1 材料与方法
1.1 试验用鱼
采自新疆阜康某养殖场患病西伯利亚鲟8尾,患病鱼泄殖孔红肿外突,少数鱼在下颌、腹部等皮肤处有明显出血斑或出血点。体质量约180~220 g,用于病理剖检、病料采集和病原菌分离。剖检时仅有2尾鱼存活,但已侧翻,其余6尾全部死亡。试验用西伯利亚鲟来自该场未发病同批次鱼池,体质量约150~200 g,在试验室暂养3周,确定健康无病后用于回归感染试验。
LB琼脂、M-H培养基、M-H琼脂培养基(青岛日水生物技术有限公司);细菌微量生化试验管、革兰氏染液、药敏纸片(杭州天河微生物试剂有限公司);2xEasyTaq SuperMix、胶回收试剂盒以及质粒提取试剂盒(全式金生物科技有限公司);细菌16S rRNA通用引物序列测定由生工生物工程(上海)股份有限公司提供。
1.2 剖检观察
肉眼检查病鱼体表有无甲壳类体表寄生虫,同时分别刮取鳃丝、体表黏液在载玻片上,并在体视显微镜下观察黏液中是否有寄生体表原虫。依次检查病鱼头部、体表、腹部、鳍条、肛门等处有无病变;剖开腹部检查有无腹腔液,肝脏、胆囊、脾脏、肾脏等器官质地、形态及有无出血,肠壁弹性及肠道有无内容物。
1.3 细菌分离培养
用75%酒精喷洒患病鲟鱼体表,并用酒精棉球反复擦拭,用灭菌手术剪剖开鱼腹部,采集病鱼肝脏、脾脏、肠、肾。用接菌环蘸取腹腔液在LB琼脂培养基上划线;内脏用无菌PBS液反复冲洗5遍,灭菌手术剪剪开后用横断面在LB琼脂培养基上单向涂抹,再持接菌环在涂抹处划线,20 ℃倒置培养16~24 h。挑取形态一致的单个优势菌落进行分离传代纯化培养。
1.4 细菌鉴定
接菌环灭菌挑取琼脂平板上单个菌落,经稀释、涂片、固定、染色后,显微镜油镜下观察菌体形态和颜色,镜下观察菌体单一菌落后,在琼脂平板上挑取单个菌落接种于M-H液体培养基,置于20 ℃恒温摇床培养24 h,用培养的菌液进行葡萄糖、硫化氢等生理生化试验,试验结果参照文献[11]进行分析。
将经M-H培养基培养的菌液与30%甘油(6∶4)注入到EP管中混匀并用封口膜封口,至-80 ℃冰箱中保存。以菌液为底物,进行菌液PCR扩增。选用细菌通用引物扩增16S rRNA,正向引物27F:5′-AGAGTTTGATCCTGC-3′,反向引物1492R:5′-GGTTACCTTGTTACGACTT-3′,引物由生工生物工程(上海)股份有限公司合成。
PCR反应体系(25 μL)为:2xEasyTaq SuperMix 12.5 μL,上游引物1 μL,下游引物 1 μL,底物2 μL,ddH2O 8.5 μL。PCR反应条件为:94 ℃预变性4 min;94 ℃变性40 s,54 ℃退火60 s,72 ℃延伸2 min,共35个循环;72 ℃再延伸10 min。
扩增产物经1%琼脂糖凝胶电泳后,连接转化并提取质粒,质粒送往生工生物工程(上海)股份有限公司进行测序。将测序结果在美国国立生物技术信息中心网站进行BLAST比对,用Mega 6.0软件对序列进行多重比较并构建系统发育树。
1.5 致病菌药敏试验
吸取100 μL M-H液体培养基培养的菌液均匀涂布于M-H琼脂培养基表面,用烧灼后的无菌镊子夹取药敏纸片以适当间隔粘贴于琼脂培养基表面,并轻压药敏纸片,使之与培养基充分接触。正置0.5 h,然后倒置于20 ℃恒温培养箱培养16~24 h,观察并测量抑菌圈直径,根据抑菌圈的大小来判断该菌对相应药物的敏感程度[12]。
1.6 回归感染试验
试验设计3个菌液密度组,每个密度组设2个梯密度,高密度组为1×109、1×108cfu/mL,中密度组为1×107、1×106cfu/mL,低密度组为1×105、1×104cfu/mL。测定目标菌液在600 nm下的吸光值(OD600),用无菌生理盐水稀释成相应密度的细菌悬浊液。胸鳍基部注射每尾0.1 mL,对照组注射等量的无菌生理盐水,每组注射8尾,保持水温20 ℃,不间断供氧,连续观察7 d,每日定时投喂,观察并记录试验鱼的症状及每日死亡数目,发现死鱼及时捞出并剖检,检查其体表及内脏器官的病变情况并做记录,同时进行细菌分离。根据寇氏法计算半数致死密度(LD50)。
2 结果与分析
2.1 体表检查及病理剖检结果
患病鲟鱼泄殖孔红肿外突,少数鱼在下颌、腹部等皮肤处有明显出血点或斑点。剖开腹部有少量清亮腹水;体壁及肌肉未出血;肝脏轻微肿大,在肝小叶尖端可见大的出血斑(图1);脾脏色深轻微肿大,肾脏正常;肠道内有食物,肠系膜及脂肪有小的出血点;性腺有出血点。
2.2 致病菌形态特征
自患病鱼肝脏、性腺、脾脏分离得到一株优势菌XB2,该菌为革兰氏阴性菌,短杆菌或球杆菌,菌体两端钝圆,成对或单独存在(图2)。在LB琼脂培养基上,菌株XB2可形成边缘整齐,透明或灰白色,微隆起,表面光滑,直径1.0~1.5 mm(20 ℃,24 h)的菌落,在血琼脂平板上未形成溶血圈。
2.3 生理生化结果
生理生化反应显示菌株XB2产酸不产气,V-P反应呈阳性,能利用蔗糖、果糖、葡萄糖、明胶、枸橼酸;在含1%(m/V)氯化钠中能生长,高于3%(m/V)氯化钠中不生长;在4 ℃以下、37 ℃以上不生长,20~30 ℃均能正常生长;不利用乳糖、水杨苷、纤维二糖、硫化氢、酒石酸、阿拉伯糖。菌株XB2生理生化特性接近鲁氏耶尔森菌标准株(表1)。
2.4 PCR鉴定及系统发育树构建
对菌株XB2的16S rRNA基因序列进行PCR扩增,通过1%琼脂糖凝胶电泳可见长度约为1500 bp的片段。测序反馈序列上传美国国立生物技术信息中心进行基因序列比对,结果显示,菌株XB2与鲁氏耶尔森菌相似性最高。将16S rRNA序列在EzBioCloud数据库上同时进行比对,结果与美国国立生物技术信息中心数据库比对结果相同,菌株XB2与鲁氏耶尔森菌的相似率达99.43%。将序列上传美国国立生物技术信息中心,获得序列号为MG581405。选择15个耶尔森菌属标准参考株,运用Mega 6.0建立系统发育树,以豚鼠气单胞菌(Aeromonascaviae)为外类群,系统发育树结果显示,菌株XB2与湖北株鲁氏耶尔森菌KJ812974聚为一支(图3)。结合生理生化鉴定及基因序列对比分析,确定菌株XB2为鲁氏耶尔森菌。
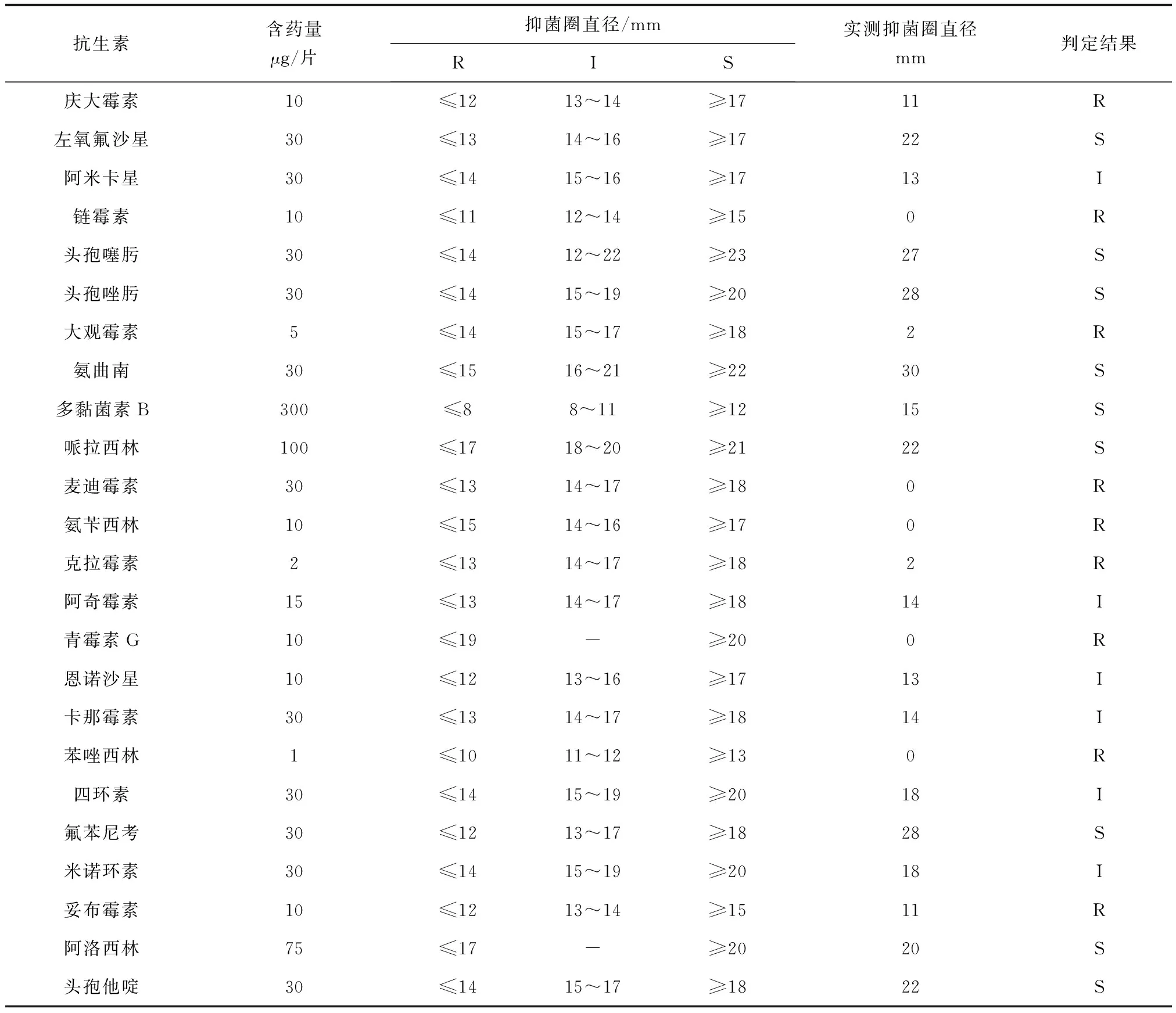
2.5 药敏试验结果
用25种水产常用药进行药敏试验,药敏试验判定结果参照美国临床实验室标准化委员会VET01-A4标准[13]。药敏结果显示,鲁氏耶尔森菌XB2对氟苯尼考、左氧氟沙星、哌拉西林、阿洛西林等9种药物敏感;对麦迪霉素、大观霉素、链霉素、氨苄西林等15种药物呈现不敏感或者耐药(表2)。
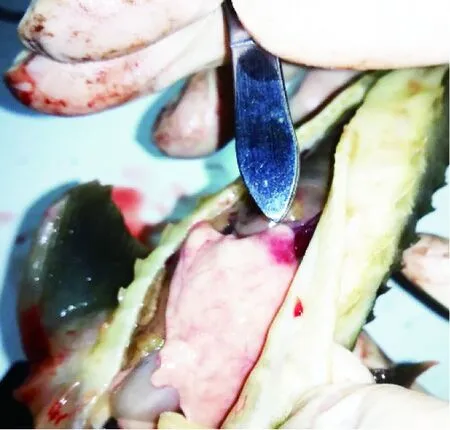
图1 病理剖检
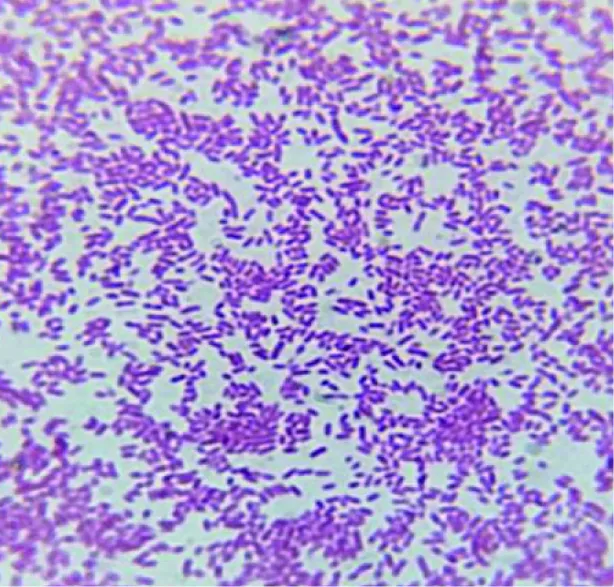
图2 分离菌株XB2革兰氏染色(油镜×1000)
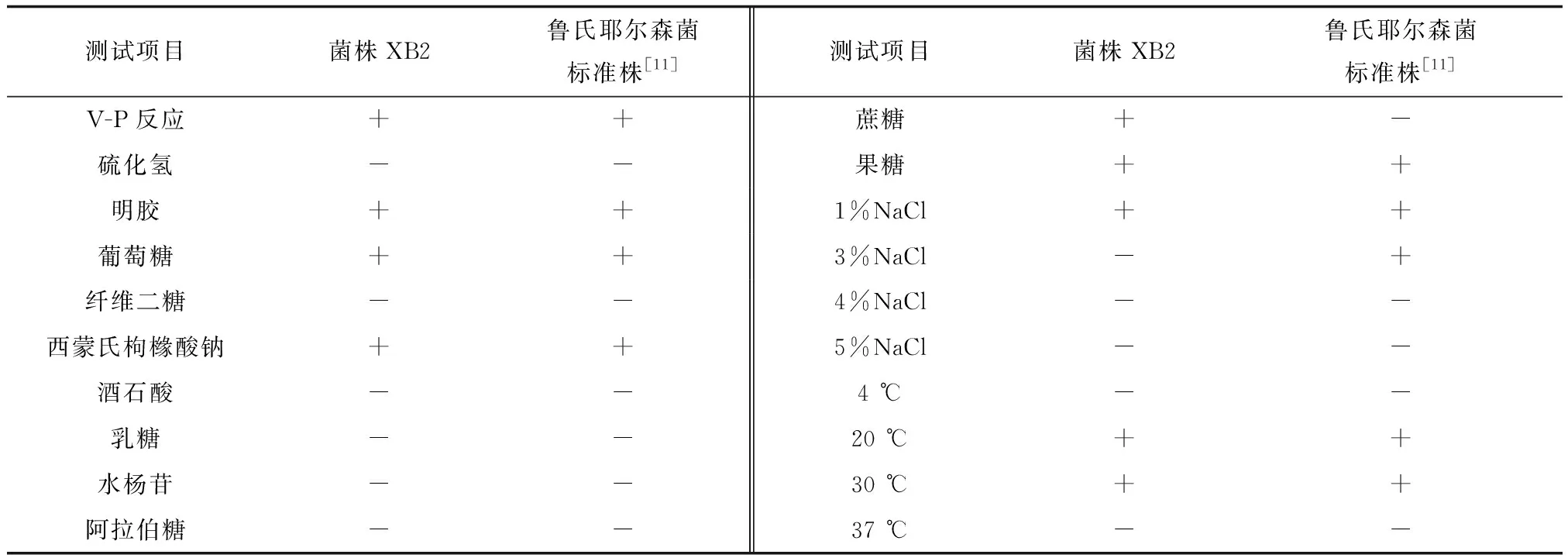
测试项目菌株XB2鲁氏耶尔森菌标准株[11]测试项目菌株XB2鲁氏耶尔森菌标准株[11]V-P反应++蔗糖+-硫化氢--果糖++明胶++1%NaCl++葡萄糖++3%NaCl-+纤维二糖--4%NaCl--西蒙氏枸橼酸钠++5%NaCl--酒石酸--4 ℃--乳糖--20 ℃++水杨苷--30 ℃++阿拉伯糖--37 ℃--
注:“+”表示阳性反应,“-”表示阴性反应.
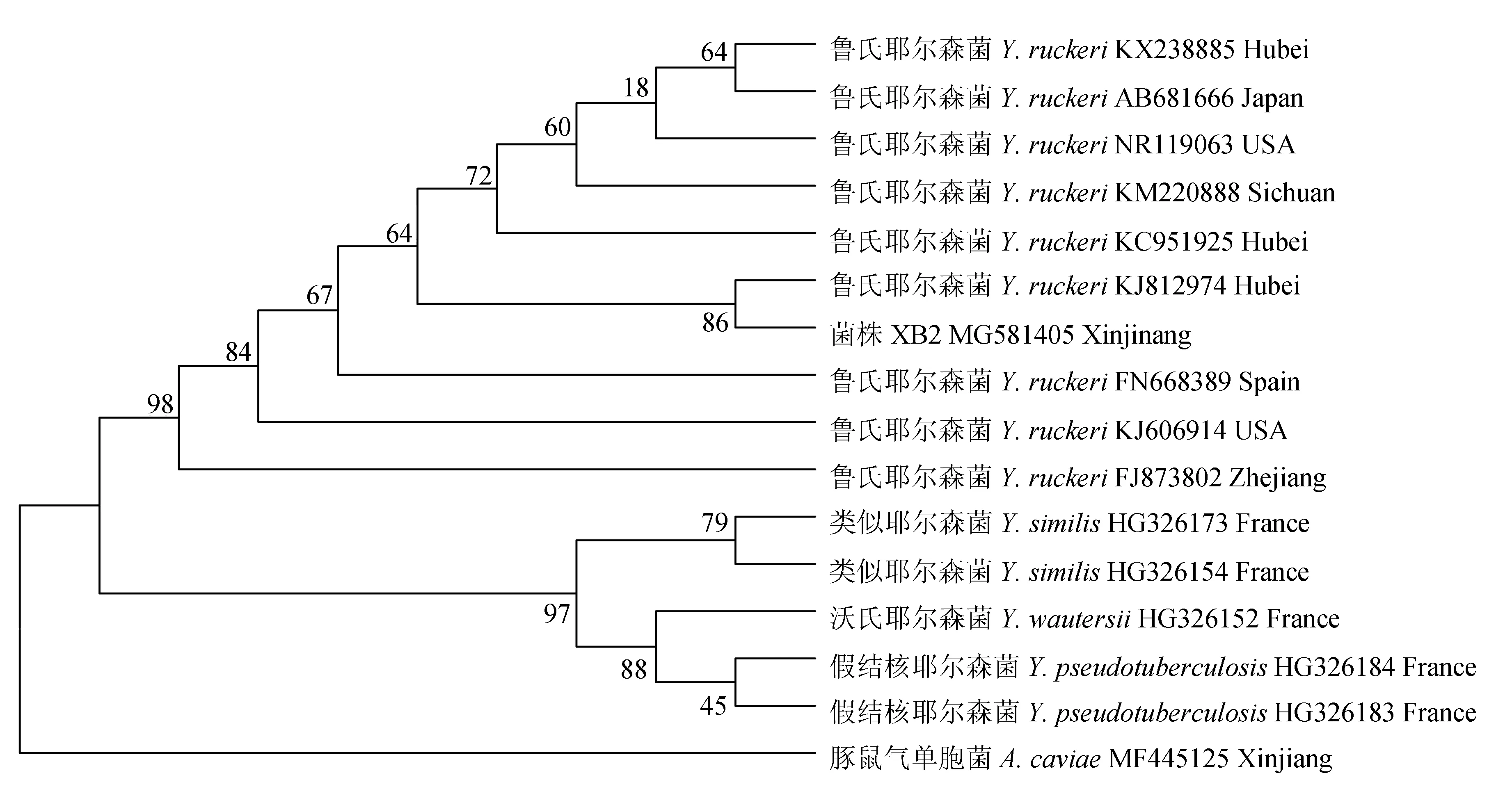
图3 分离菌株XB2 16S rRNA基因与同源性菌株相应基因构建的系统发育树
抗生素含药量μg/片抑菌圈直径/mmRIS实测抑菌圈直径mm判定结果庆大霉素10≤1213~14≥1711R左氧氟沙星30≤1314~16≥1722S阿米卡星30≤1415~16≥1713I链霉素10≤1112~14≥150R头孢噻肟30≤1412~22≥2327S头孢唑肟30≤1415~19≥2028S大观霉素5≤1415~17≥182R氨曲南30≤1516~21≥2230S多黏菌素B300≤88~11≥1215S哌拉西林100≤1718~20≥2122S麦迪霉素30≤1314~17≥180R氨苄西林10≤1514~16≥170R克拉霉素2≤1314~17≥182R阿奇霉素15≤1314~17≥1814I青霉素G10≤19-≥200R恩诺沙星10≤1213~16≥1713I卡那霉素30≤1314~17≥1814I苯唑西林1≤1011~12≥130R四环素30≤1415~19≥2018I氟苯尼考30≤1213~17≥1828S米诺环素30≤1415~19≥2018I妥布霉素10≤1213~14≥1511R阿洛西林75≤17-≥2020S头孢他啶30≤1415~17≥1822S
注:R表示低度敏感或不敏感;I表示中度敏感;S表示高度敏感.
2.6 回感试验结果
健康西伯利亚鲟腹部注射鲁氏耶尔森菌XB2后12 h,高密度组和中密度组表现为不摄食、游动缓慢、对外界的刺激不敏感等现象,24 h后高密度组出现死亡,36 h后中密度组出现死亡。对照组全部正常。将死鱼及时捞出进行体表检查,可见生殖孔红肿外突,剖检可见,肝脏呈灰白色,上面布满红晕,脾脏轻微肿大且颜色深,肠系膜、脂肪以及性腺有小出血点,肌肉未见出血。整体病变与自然发病鲟鱼相似,自感染死亡西伯利亚鲟的肝脏、脾脏等组织分离到与鲁氏耶尔森菌XB2的形态、生理生化特性及16S rRNA基因序列分析一致的细菌,表明鲁氏耶尔森菌XB2是造成此次西伯利亚鲟患病的病原菌。

表3 人工回感试验
3 讨 论
3.1 西伯利亚鲟细菌病研究进展
目前,国内关于鲟鱼细菌性疾病的报道日渐增多,致病菌种类也随之增加。自患病鲟鱼肝脏和心脏分离出两株停乳链球菌(Streptococcusdysgalactiae)[14],自脾脏、肾脏分离出海豚链球菌(S.iniae)[15],自鲟鱼肝脏[16-17]、性腺[18]分离出嗜水气单胞菌(A.hydrophila),自鲟鱼体内分离出鲁氏耶尔森菌[19]。由此可知,细菌性疾病已使鲟鱼的健康养殖受到巨大的威胁,成为其养殖业健康可持续发展的瓶颈之一。
3.2 分离菌鉴定结果及目前细菌鉴定方法的利弊
自发病的西伯利亚鲟的肝脏、脾脏分离得到一株革兰氏染色阴性短杆菌XB2,由人工感染剖检可见,发病鱼肝脏有点状出血斑,脾脏表面粗糙,肿大,与自然发病症状一致,从肝脏、脾脏分离出与菌株XB2形态、理化性质相一致的菌株,表明该菌株对鲟鱼有明显的致病性。经对菌株XB2的16S rRNA基因进行测序,测序结果进行BLAST对比后构建系统进化树显示,菌株XB2与鲁氏耶尔森菌湖北株KJ812974聚为一支。
目前细菌的鉴定方法主要包括表型鉴定和分子遗传学鉴定两大类。表型鉴定包括细菌形态和生理生化及其蛋白鉴定;分子遗传学鉴定是在核酸水平上的鉴定[20]。细菌形态鉴定法是经典且常用的分类学方法,操作流程已经程序化,但是鉴定耗时长,而且容易受操作者的操作手法,生化反应本身的不完整性,结果判断误差等造成鉴定结果不准确。在本研究中,生理生化反应显示,菌株XB2产酸不产气,V-P反应呈阳性,能利用蔗糖、果糖、葡萄糖、明胶、枸橼酸;而鲁氏耶尔森菌标准株不能利用蔗糖和葡萄糖[11]。分子遗传学鉴定法通过PCR技术将细菌的16S rRNA、ropB、gyrB等基因大量扩增出来,并进行BLAST比对,可灵敏、快速且准确地对细菌的种属进行鉴定,但是不足之处在于对目标菌样的纯度要求高。综上所述,如若将表型鉴定和分子遗传学鉴定同时用在鉴定细菌上,结果愈加真实可靠。本研究通过对菌株XB2的16S rRNA基因序列扩增,并进行同源性分析,构建系统发育树,结果发现,菌株XB2与鲁氏耶尔森菌KJ812974同源性达99.43%,结合革兰氏染色、生理生化试验结果,确定菌株XB2为鲁氏耶尔森菌。
3.3 鲁氏耶尔森菌XB2药敏结果分析

3.4 鲁氏耶尔森菌中草药的防治
除了通过化学药品和疫苗防控鲟源鲁氏耶尔森菌外,陶健等[24]对鲁氏耶尔森菌进行了中草药试验,采用试管二倍稀释法测定了16种中草药单方及5种复方制剂对鲁氏耶尔森菌的最小抑菌质量浓度。结果表明,黄芩和诃子对鲁氏耶尔森菌的抑菌作用最强,最小抑菌质量浓度为0.028 g/mL;5种复方制剂中,大黄、黄柏和黄芩3种中草药以5∶3∶2的比例配伍对鲁氏耶尔森菌具有最佳抑菌效果,最小抑菌质量浓度为0.057 g/mL,抑菌效果弱于黄芩,但远强于大黄单独使用,为该细菌性疾病的防治提供复方配伍参考。41种中草药对鲟源鲁氏耶尔森菌的药物敏感性试验结果表明,乌梅、石榴皮、地榆、杞子对鲁氏耶尔森菌有明显抑菌作用[25]。综上所述,使用中草药防控鲟源鲁氏耶尔森菌不但操作方便,而且绿色健康,不会造成病原菌产生耐药性。
