发根农杆菌介导甜瓜转基因过表达体系的建立
2019-01-13王平勇徐永阳赵光伟贺玉花李明孔维虎张健刘水苗刘梦丽徐志红
王平勇 徐永阳 赵光伟 贺玉花 李明 孔维虎 张健 刘水苗 刘梦丽 徐志红

摘 要:遗传转化是实现基因功能验证和基因快速转育的重要手段,但目前甜瓜的遗传转化依旧存在众多技术难题。笔者利用野生型发根农杆菌K599侵染甜瓜‘E31,成功诱导甜瓜产生了不定根。借助该技术,将含有GUS基因和EGFP基因的过表达载体pCAMBIA3301和pCAMBIA1300-ProSuper导入发根农杆菌K599,利用转化后的农杆菌侵染甜瓜‘E31,成功诱导出了不定根。PCR检测结果表明,新生不定根的阳性率达到100%。通过GUS染色和激光共聚焦显微镜检测,在不定根中检测到GUS基因和EGFP基因的大量表达,成功实现了外源基因在甜瓜新生不定根内过表达。该方法周期短、操作方便、转化率高,可实现基因功能的快速验证,为甜瓜根系抗病抗逆方面的研究提供技术支持。
关键词:甜瓜;发根农杆菌;K599;过表达
Establishment of Agrobacterium rhizogenes-mediated gene overexpression system in melon
WANG Pingyong, XU Yongyang, ZHAO Guangwei, HE Yuhua, LI Ming, KONG Weihu, ZHANG Jian, LIU Shuimiao, LIU Mengli, XU Zhihong
(Zhengzhou Fruit Research Institute, Chinese Academy of Agricultural Sciences, Zhengzhou 450009, Henan, China)
Abstract: Genetic transformation is an important means to verify gene function and rapid gene transfer, but there are still many technical difficulties for melon . In this study, Agrobacterium rhizogenes K599 was used to infect melon ‘E31 and successfully induced the formation of adventitious roots. With this technique, the overexpression vectors pCAMBIA3301 and pCAMBIA1300-ProSuper containing GUS gene and EGFP gene, respectively, were introduced into A. rhizogenes K599. The modified A. tumefaciens K599 was used to infect melon ‘E31 and successfully induced the formation of adventitious roots. The results of PCR showed that the positive rate of new adventitious roots was 100%. The expression of GUS and EGFP genes in adventitious roots were successfully detected by GUS staining and confocal laser microscopy. This method has the advantages of short cycle, easy operation, high transformation rate, and can verify gene function in melon rapidly. It will provide technical support for the research on the mechanism of disease or stress resistance in melon root.
Key words: Melon; Agrobacterium rhizogenes; K599; Overexpression
甜瓜(Cucumis melo L.)在我國是一种重要的水果型蔬菜作物。我国自20世纪80年代以来,一直是世界上甜瓜种植面积和产量最大的国家[1]。甜瓜种质资源多样,具有丰富的遗传多样性,据考证至少有3 000份。我国于20世纪50年代开始开展甜瓜种质资源的收集保存工作。目前,国家种质资源西甜瓜中期库(设于中国农业科学院郑州果树研究所)保存的甜瓜种质资源已达1 200余份[2]。随着社会经济的飞速发展,消费者对瓜类产品的品质要求也日益提高,品种更新换代加快,给育种家带来很大压力。通过常规方法选育品种周期长、效率低,已无法满足当前产业飞速发展的要求。目前,甜瓜基因组信息已经公布,有关甜瓜的遗传研究已进入后基因组时代[3]。虽然科学家借助基因组信息预测了大量与重要农艺性状相关的基因,但功能基因的验证和转育还面临着众多技术壁垒。遗传转化是实现基因功能验证和基因快速转育的重要手段,但目前甜瓜的遗传转化还存在品种依赖性强、再生体系建立困难、转化率低、周期长等问题[4]。发根农杆菌(Agrobacterium rhizogenes)属于根瘤菌科(Rhizobitaceae)农杆菌属(A. grobacterium)的革兰氏阴性菌,它的宿主范围广阔,侵染植物后能诱导植物产生大量高度分支的不定根。这些不定根生长速度快,分化程度高、生理生化和遗传性稳定、易于进行操作控制[5]。目前,科学家利用发根农杆菌在多种植物中成功诱导出了不定根,包括茄科、菊科、十字花科、旋花科、伞形科、豆科、石竹科、蓼科等草本植物,以及杏、葡萄等木本植物[6-8]。发根农杆菌 K599是因20世纪70年代在英国等欧洲国家爆发的黄瓜毛根病而被发现的[9]。目前,利用K599在黄瓜、大豆等作物中已成功诱导产生了转基因不定根。用转基因不定根的方法研究基因功能不需要产生完整的转基因植株,操作简单快捷,近些年应用的越来越广泛[10-12]。笔者建立了一种K599快速诱导甜瓜产生不定根的方法,通过发根农杆菌介导,可实现外源基因在不定根中过表达,周期短,操作方便,转化率高,可实现基因功能的快速验证,为甜瓜根系抗病抗逆方面的研究提供了技术支持。
1 材料与方法
1.1 材料
材料为薄皮类型甜瓜‘E31,由中国农业科学院郑州果树研究所甜瓜育种课题提供。发根农杆菌为A. rhizogenes K599,由中国农业科学院郑州果树研究所果树生长调控课题组李明博士馈赠。pCAMBIA3301和pCAMBIA1300-ProSuper载体质粒由中国农业大学杨文才教授课题组提供,分别携带GUS(β-glucuronidase)基因和EGFP(Enhanced Green Fluorescent Protein)基因。激光共聚焦显微镜型号为德国LEICA公司的TCS SP5。试验于2018年9月至2019年7月在中国农业科学院郑州果树研究所进行。
1.2 方法
1.2.1 发根农杆菌K599感受态的制备 (1)吸取20 μL发根农杆菌K599菌液,均匀涂布于含硫酸链霉素(Str)終质量浓度为50 mg·L-1的LB固体培养基表面,28 ℃倒置培养48 h;(2)挑选单个农杆菌菌落,接种到5 mL含硫酸链霉素(Str)终质量浓度为50 mg·L-1 的LB液体培养基中,28 ℃ 220 r·min-1 震荡过夜培养;(3)吸取1 mL菌悬液接种于50 mL含有相同抗生素的LB液体培养基中,28 ℃ 220 r·min-1 震荡培养至OD600值为0.6~0.8;(4)将菌液冰浴30 min,之后转移至50 mL灭菌离心管中,4 ℃ 5 000 r·min-1离心10 min,弃上清,收集菌体沉淀;(5)用100 mL 10%的灭菌甘油(冰上预冷)重悬菌体,4 ℃ 5 000 r·min-1离心15 min,弃上清;(6)重复步骤(5)3次;(7)再次用1 mL 10%的甘油悬浮菌体,分装为每管50 μL,放入液氮中速冻,-80 ℃保存备用。
1.2.2 农杆菌的转化 (1)电击操作前,将电击杯浸泡在75%的乙醇中数分钟,之后取出在超净工作台晾干;(2)将农杆菌感受态放置冰上,加入2 μL质粒溶液,轻轻吸打混匀;(3)将混合液转移至电击杯中间,在2.2 kV电压下电击1 s;(4)将电击杯迅速置于冰上,加入700 μL不含抗生素的LB液体培养基,吸打混匀后转移至灭菌的2 mL离心管中,28 ℃ 220 r·min-1 震荡3 h;(5)吸取100 μL培养后的菌液均匀涂布在LB固体培养基中(含Kan 50 mg·L-1,Str 50 mg·L-1),28 ℃倒置培养48 h;(6)待菌落长出后,挑选单个菌落置于LB液体培养基中(含Kan 50 mg·L-1,Str 50 mg·L-1),28 ℃ 220 r·min-1 震荡过夜培养;(7)选择PCR检测为阳性的菌液,按1∶50的比例接种LB液体培养基中(含Kan 50 mg·L-1,Str 50 mg·L-1),28 ℃ 220 r·min-1 震荡过夜培养。吸取800 μL菌液至灭菌的2 mL离心管中,按1∶1的比例加入40%甘油,混匀后在液氮中速冻,-80 ℃保存备用。
1.2.3 甜瓜不定根的转化 (1)以薄皮类型甜瓜材料‘E31为试材,50 ℃温汤浸种3 h,30 ℃催芽20 h,种子露白后播种于装有营养土(V草炭∶V蛭石=2∶1)的口径为7 cm的营养钵中,置于光照培养箱,光周期设置为12 h光照/12 h黑暗,昼夜温度设为28/25 ℃。待幼苗子叶展平时接种农杆菌;(2)用接种环挑取转入目的载体的农杆菌菌液,在LB固体培养基(含Kan 50 mg·L-1,Str 50 mg·L-1)表面划线接种,置于培养箱中28 ℃倒置培养48 h。当划线处长出菌落且足够用于接种时,准备接种;(3)用注射器挑取农杆菌菌落从与下胚轴垂直的两个方向刺穿幼苗的子叶节,侵染完用一次性塑料杯倒扣盖在瓜苗上,置于培养箱中黑暗培养8~12 h,温度设置为22 ℃,土壤湿度控制在80%以上;(4)黑暗培养后,将一次性塑料杯取下,剪掉杯底,将杯子正放套在幼苗上,向杯中填放蛭石,直至蛭石能掩盖住幼苗接种部位,用塑料喷壶向蛭石喷水,直至蛭石湿透。处理后的幼苗放入光照培养箱,光周期设置为12 h光照/12 h黑暗,昼夜温度设为28/25 ℃。每天补加蛭石,以保持接种部位的持续湿润;(5)接种后20 d左右,可从接种部位长出不定根,将主根及下胚轴剪去(此时不定根可用于阳性检测),将植株埋入营养土中(V草炭∶V蛭石=2∶1),注意保持土壤湿润。
1.2.4 甜瓜不定根的检测 (1)PCR检测:从每条不定根上分别剪取少量根段提取DNA,根据载体序列设计引物,进行常规PCR反应,有目的条带的即为阳性根。pCAMBIA3301载体检测引物为F:GACGTAAGGGATGACGCACAATC;R:TCATCATCATAGACACACGA。PCR反应体系为:DNA模版1 μL,上、下游引物各0.5 μL,2×PCR Master Mix 5 μL,dd H2O 3 μL。PCR反应程序为95 ℃,3 min;95 ℃,30 s,50 ℃,30 s,72 ℃,50 s,35个循环;72 ℃,10 min。pCAMBIA1300-ProSuper载体检测引物为F:TCTTGATCCGCAGCCATTAACGACT;R:CACCTTGATGCCGTTCTTCTGCTTG。PCR反应体系同上,PCR反应程序为 95 ℃,3 min;95 ℃,30 s,50 ℃,50 s,72 ℃,1 min,35个循环;72 ℃,10 min。PCR 扩增结束后进行1%的凝胶电泳验证;(2) GUS染色步骤:将甜瓜不定根浸泡在GUS染色液中,于37 ℃保温过夜孵育; 过夜孵育后转入70%乙醇中脱色2~3次,至阴性对照材料呈白色;肉眼或显微镜下观察,白色背景上的蓝色小点即为GUS基因的表达位点;(3)激光共聚焦显微镜检测:取一小段不定根置于载玻片上,向根段滴少量蒸馏水,盖上盖玻片,确保盖玻片能完全覆盖根段并吸附在载玻片上,根段周围不要有气泡,借助激光共聚焦显微镜检测EGFP基因在不定根内的表达情况。
2 結果与分析
2.1 发根农杆菌K599诱导甜瓜产生不定根
取未导入外源载体的野生型K599菌液,在LB固体培养基(Str 50 mg·L-1)表面划线接种,置于培养箱中28 ℃倒置培养48 h后用于接种。接种后20 d左右,甜瓜‘E31子叶节处产生大量不定根(图1)。说明利用上述方法,可成功诱导甜瓜产生不定根。
2.2 以pCAMBIA3301为载体通过发根农杆菌K599介导GUS基因的过表达
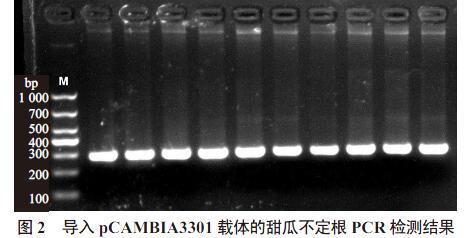
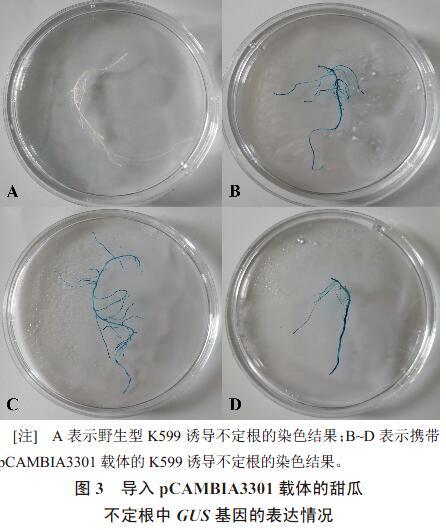
向野生型K599中导入含有外源GUS基因的载体pCAMBIA3301。待甜瓜‘E31的子叶节处长出不定根后,利用载体引物检测不定根是否为阳性,目的条带为293 bp。结果显示,不定根的阳性率可达100%(图2),新生不定根可被GUS染色液完全染成蓝色(图3-A~D)。
2.3 以pCAMBIA1300-ProSuper为载体通过发根农杆菌K599介导EGFP基因的过表达
向野生型K599中导入含有外源EGFP基因的载体pCAMBIA1300-ProSuper。待甜瓜‘E31的子叶节处长出不定根后,利用载体引物检测不定根是否为阳性,目的条带大小为800 bp。结果显示,不定根的阳性率可达100%(图4)。通过激光共聚焦显微镜观察,可在新生不定根细胞中观察到大量绿色荧光(图5-A~D)。
3 讨论与结论
本研究中幼苗的侵染时期选择2片子叶刚刚展平,第1片真叶还未露头的时期,此时植株的茎尖生长点还处于子叶节处,此处细胞分裂旺盛,选择在子叶节处接种有利于农杆菌的顺利侵染[13]。由于湿度和光照对农杆菌的侵染以及转化细胞的组织分化有影响,因此需要在接菌后进行保湿和暗处理。本试验中,接种后用一次性塑料杯倒扣盖在瓜苗上,可增加接种部位周围的空气湿度。但甜瓜是喜光植物,光照不足会导致幼苗徒长,下胚轴严重伸长,不利于培养壮苗。此外,光照不足的情况下温度太高也容易导致甜瓜幼苗的徒长。在前期研究中,我们发现甜瓜幼苗在20 ℃以下会出现叶片向下卷曲的冷害症状,因此笔者将暗处理温度设为22 ℃,可避免低温寡照对幼苗的过多影响,保证农杆菌的顺利侵染以及转化细胞的分化。暗处理8~12 h后,用蛭石将接种部位掩埋,可保证该部位处于黑暗条件。蛭石质地疏松透气,可避免接种部位腐烂,也便于后续对不定根进行采样。在覆盖蛭石的过程中需要注意的是,接菌后3~4 d,植株的第1片真叶还没长出子叶节,应避免此处被蛭石掩埋,以保证植株的生长。待真叶长出1 cm左右时,即可用蛭石将子叶及以下部分全部掩埋,保证接种部位完全黑暗,加速愈伤组织的形成和分化。
遗传转化是研究基因功能的重要手段。目前在葫芦科作物中,黄瓜的遗传转化已较为成熟,而甜瓜的转化依然存在较多问题,导致转化效率很低[14-16]。笔者建立了一种发根农杆菌诱导甜瓜产生不定根的方法。基于该方法,通过向发根农杆菌K599中导入基因过表达载体pCAMBIA3301和pCAMBIA1300-ProSuper,成功实现了外源GUS基因和EGFP基因在新生不定根中的过表达,该方法周期短、操作方便、转化率高,可实现基因功能的快速验证,为甜瓜根系抗病抗逆方面的研究提供了技术支持。但是笔者仅验证了外源基因在甜瓜新生不定根中的过表达体系,后续研究中将筛选合适的干扰表达载体以及基因编辑载体,探索基因干扰表达技术和基因编辑技术与发根农杆菌诱导甜瓜产生不定根技术的结合运用。
发根农杆菌诱导植物产生的不定根具有数量多、生长迅速的特点,在药用植物中利用毛状根的培养可生产植物代谢产物,如利用青蒿毛状根培养生产青蒿素、人参毛状根生产人参皂苷、甘草毛状根培养生产甘草酸、红豆杉毛状根生产紫杉醇、大豆毛状根生产大豆异黄酮等[17-21]。葫芦科作物中含有大量有益代谢产物,如葫芦素、番茄红素、瓜氨酸等,未来可利用发根农杆菌诱导不定根的方法进行大量生产。
参考文献
[1] 周慧文.甜瓜果实性状表型分析及其CAPS标记的研究[D].哈尔滨:东北农业大学,2016.
[2] 胡建斌,马双武,简在海,等.中国甜瓜种质资源形态性状遗传多样性分析[J].植物遗传资源学报,2013,14(4):612-619.
[3] GARCIAMAS J,BENJAK A,SANSEVERINO W,et al.The genome of melon(Cucumis melo L.)[J].Proceedings of the National Academy of Sciences of the United States of America,2012,109(29):11872-11877.
[4] NUNEZ-PALENIUS H G,CANTLIFFE D J,HUBER D J,et al.Transformation of a muskmelon "Galia" hybrid parental line(Cucumis melo L.var.reticulatus Ser.)with an antisense ACC oxidase gene[J].Plant Cell Reports,2006,25(3):198-205.
[5] 熊笙屹,厍润祥,张璐,等.转基因植物发根农杆菌研究的进展及应用[J].农业与技术,2017,37(16):72-74.
[6] 戴均贵,朱蔚华.发根培养技术在植物次生代谢物生产中的应用[J].植物生理学通讯,1999(1):69-76.
[7] JITTAYASOTHORN Y,YANG Y,CHEN S,et al.Influences of Agrobacterium rhizogenes strains,plant genotypes,and tissue types on the induction of transgenic hairy roots in Vitis species[J].Vitis,2011,50(3):107-114.
[8] BOSSELUT N,VAN G C,CLAVERIE M,et al.Agrobacterium rhizogenes-mediated transformation of Prunus as an alternative for gene functional analysis in hairy-roots and composite plants[J].Plant Cell Reports,2011,30(7):1313-1326.
[9] WELLER S A,STEAD D E,YOUNG J P W.Acquisition of an Agrobacterium Ri plasmid and pathogenicity by other α-Proteobacteria in cucumber and tomato crops affected by root mat[J].Applied and Environmental Microbiology,2004,70(5):2779-2785.
[10] VEENA V,TAYLOR C G.Agrobacterium rhizogenes:recent developments and promising applications[J].In Vitro Cellular &Developmental Biology-Plant,2007,43(5):383-403.
[11] 曹庆丰.发根农杆菌K599侵染黄瓜形成转基因毛状根的初步研究及orf14基因的克隆[D].杭州:杭州师范大学,2012.
[12] 李明.通过大豆毛状根体系快速验证GmNAC08、GmNAC06和GmNAC15的基因功能[D].新疆石河子:石河子大学,2017.
[13] 郝金凤,荆培培,张丽,等.应用农杆菌介导的生长点转化方法建立甜瓜遗传转化技术[J].华北农学报,2014,29(2):116-120.
[14] 刘汉强.黄瓜高效遗传转化体系的建立和嫩果白皮基因w的图位克隆与功能分析[D].陕西杨凌:西北农林科技大学,2018.
[15] 段莉莉,朱拼玉,李季,等.基因工程技術在甜瓜属作物分子育种中的应用与发展[J].中国瓜菜,2018,31(8):1-8.
[16] 韩伟,刘娥娥,王亚琴,等.瓜类蔬菜转基因研究进展[J].中国蔬菜,2010(4):8-13.
[17] 刘春朝,王玉春,欧阳藩,等.青蒿毛状根生长、青蒿素合成以及营养物消耗的动力学(英文)[J].西北植物学报,1999(4):571-577.
[18] 孙彬贤,杨光孝,汪沁琳,等.人参毛状根合成人参皂苷培养条件的优化[J].中成药,2003(9):58-60.
[19] 姚庆收,陈向明,丁斐,等.甘草毛状根遗传转化体系的建立及甘草酸和总黄酮含量的测定[J].中药材,2018,41(9):2035-2038.
[20] 黄遵锡,慕跃林,周玉敏,等. 发根农杆菌对短叶红豆杉的转化及毛状根中紫杉醇的产生[J]. 云南植物研究,1997(3):78-82.
[21] LOZOVAYA V V,LYGIN A V,ZERMOVA O V,et al.Isoflavonoid accumulation in soybean hairy roots upon treatment with Fusarium solani[J]. Plant Physiology Biochemistry.2004,42(7/8):671-679.
