Okaramine类生物碱
2019-01-11张遵霞王月莹张亚妮张志刚王开梅
张遵霞 王月莹 张亚妮 张志刚 王开梅


摘要:Okaramine类生物碱是一类具有新颖杀虫机制的天然吲哚化合物,其产生菌主要包括青霉属(Penicillium spp.)、曲霉属(Aspergillus spp.)的某些真菌。目前已经发现20多个Okaramine类生物碱的衍生物,大部分Okaramine类生物碱衍生物具有杀虫活性,但其中以Okaramine B的杀虫活性最强。构效关系研究表明,Okaramine类生物碱的杀虫活性与氮杂环丁烷结构、氮杂环辛烷结构及C环上的甲氧基与杀虫活性高度相关。Okaramine类生物碱作用于昆虫神经元的谷氨酸门控氯离子通道。通过基因组挖掘、基因缺失突变、基因失活及异源表达,发现Okaramine类生物碱在真菌中的合成以色氨酸为起始单元,并在一系列成簇排列的生物合成基因的产物,包括非核糖体肽类合成酶、核黄素依赖单加氧酶、异戊烯转移酶、P450单加氧酶、α-酮戊二酸依赖双加氧酶及甲基转移酶等的作用下,合成了结构丰富多样的类似物。
关键词:Okaramine;产生菌;杀虫活性;构效关系;作用机制;生物合成
中图分类号:Q599 文献标识码:A
文章编号:0439-8114(2019)23-0086-05
DOI:10.14088/j.cnki.issn0439-8114.2019.23.020 开放科学(资源服务)标识码(OSID):
Okaramines:A group of natural insecticidal indole alkaloids with new mode of action
ZHANG Zun-xia,WANG Yue-yin,ZHANG Ya-ni,ZHANG Zhi-gang,WANG Kai-mei
(Hubei Biopesticide Engineering Research Centre,Wuhan 430064,China)
Abstract: Okaramines, produced by some species of Penicillium spp. and Aspergillus spp., are a group of natural indole alkaloids with new mode of action of insecticidal activity. Up to now, more than 20 Okaramine analogues have been discovered, and most of them showed insecticidal activity with Bombyx mori as target insect. Of the Okaramine analogues, Okaramine B showed the highest insecticidal activity. The studies on structure-activity relationship showed that the azetidine and azocine rings and the methoxy group were highly related to the insecticidal activity. Okaramines can activate the glutamate gated chloride channel in insect neurons. The okaramines were biosynthesized in fungi with tryptoan as the starting unit. Okaramines were diversely biosynthesized through the catalysis by nonribosomal peptide synthase, flavin-dependent monooxygenase, prenyltransferase, P450 monooxygenase, α-ketoglutarate-dependent dioxygenase, and methyltransferase, etc. encoded by clustered biosynthetic genes as clarified through genome mining, gene deletion and inactivation, and heterogenous expression.
Key words: Okaramine; producing microorganism; insecticidal activity; structure-activity relationship; mode of action; biosynthesis
微生物是重要生物活性化合物的源泉,其次生代謝产物在新农药的开发中占有重要的地位。以微生物次生代谢产物直接开发或作为先导开发的农药有阿维菌素、多杀菌素、甲氨基阿维菌素、密尔比菌素和溴虫腈等[1]。Okaramine类生物碱是某些青霉属(Penicillium spp.)、曲霉属(Aspergillus spp.)真菌所产生的具有二酮哌嗪结构的含吲哚生物碱,具有较好的杀虫活性[2,3]。研究者对该类化合物进行了大量研究,发现了一系列的衍生物,并发现了其作用机制与生物合成路径。本研究将从Okaramine类生物碱的发现、杀虫活性、作用机制、构效关系及其生物合成机制等方面对该化合物进行系统总结,以期为基于天然产物的新型高效杀虫剂的开发提供一些借鉴。
1 Okaramine类生物碱的发现与生物活性
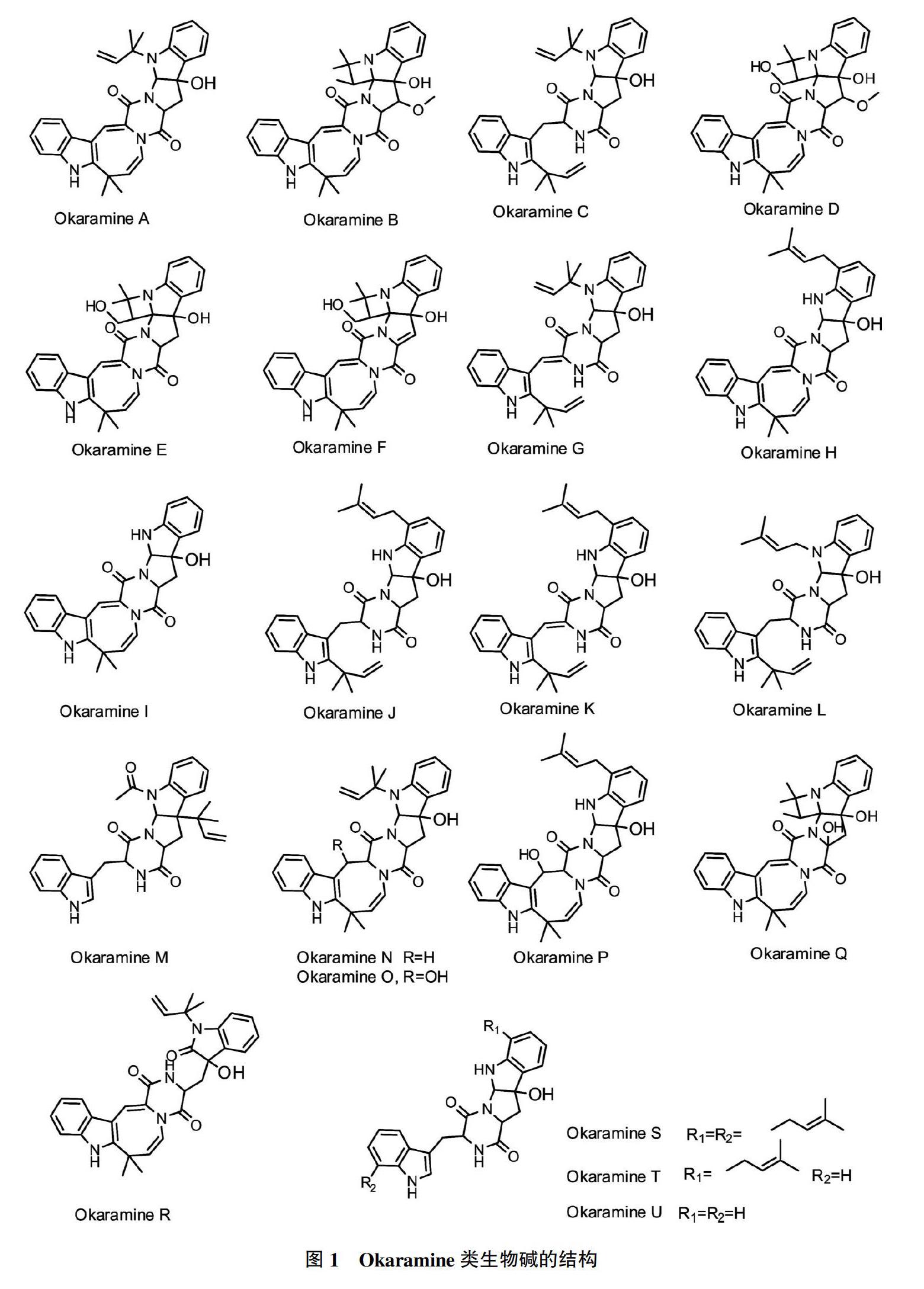
在筛选微生物所产生的杀虫活性化合物的过程中,Murao等[2]从简青霉(Penicillium simplicissimum)AK-40菌株中发现了Okaramine A,采用饲料法,30 μg/g的该化合物对三龄家蚕(Bombyx mori)的24 h致死率达到90%。随后,研究者从简青霉及曲霉属的真菌菌株中分离到了一系列Okaramine类生物碱[3-12]。表1对Okaramine类生物碱产生菌及其所产生的Okaramine类生物碱进行了总结,表2 对Okaramine类生物碱的生物活性进行了总结。图1显示了所发现的Okaramine类生物碱的结构。在所有的Okaramine类生物碱中,Okaramine A~R都有一定的杀虫活性,以Okaramine B的杀虫活性最强,其对三龄家蚕幼虫的毒性最强,0.3 μg/g处理24 h致死率达到100%,而LD50约为0.2 μg/g饲料。林亚伟等[10]从红树林真菌Aspergillus sp. OUCMDZ-1914菌株的次生代谢产物分离到的Okaramine H具有较强的糖苷酶抑制活性,IC50为3.4 μmol/L。Aspergillus taichungensis ZHN-7-07所产生的Okaramine S具有细胞毒性,其对HL-60和K-562的IC50分别为0.78和22.4 μmol/L[12]。
2 Okaramine类生物碱的作用机制与构效关系
2.1 Okaramine类生物碱的杀虫机制
Okaramine类生物碱最早由Murao等[2]于1988年从简青霉AK-40菌株中发现,但其杀虫机制直到26年后才被发现。Furutani等[13]利用杀虫活性最强的Okaramine B研究了该类化合物对家蚕幼虫神经元的影响,结果表明,Okaramine B可以使培养的家蚕幼虫神经元细胞产生内向电流,并且还发现烟碱受体抑制剂四甲环庚胺基本上不影响Okaramine B诱导产生的内向电流, 而配体门控氯离子通道抑制剂氟虫腈对Okaramine B产生的内向电流有显著影响。这初步明确了Okaramine B可能作用于配体门控氯离子通道。他们还进一步研究了Okaramine B对蟾蜍卵母细胞中表达的家蚕g-氨基丁酸门控氯离子通道及谷氨酸配体门控氯离子通道的影响,发现Okaramine B对g-氨基丁酸门控氯离子通道没有作用,而是作用于谷氨酸门控氯离子通道,但是不能够确定其是否作用于昆虫体内其他的离子通道,如组氨酸门控氯离子通道或质子敏感氯离子通道等。Okaramine B基本上不影响人的g-氨基丁酸门控氯离子通道和谷氨酸门控氯离子通道,表明其在昆虫和人之间具有很好的选择性。
2.2 基于杀虫活性的Okaramine类生物碱的构效关系
在Okaramine类生物碱的衍生物中,所有氮杂环丁烷环开环或没有氮杂环丁烷环的衍生物的杀虫活性都下降了40~500倍(图2及表1),说明氮杂环丁烷环结构完整性对Okaramine类生物碱杀虫活性非常重要。Okaramine B和D结构上惟一区别在于氮杂环丁烷上3-甲基。3-甲基羟基化后,其杀虫活性降低100倍。Okaramine B和Q的惟一区别在于C环上的甲氧基,脱去甲氧基的Okaramine Q的杀虫活性差不多降低40倍。这表明氮杂环丁烷3-甲基及C环上的甲氧基对活性的影响很大。Shiono等[14]将Okaramine B加氢还原获得了4个氮杂环丁烷环开环或氮杂环辛二烯被还原的衍生物,研究了Okaramine类生物碱中的氮杂丁烷环及氮杂环辛二烯环结构对活性的影响,结果发现,两个氮杂环丁烷开环的衍生物对家蚕三龄幼虫没有杀虫活性,而4,5-二氢-Okaramine B及1,2,4,5-四氢Okaramine B有一定的杀虫活性,但杀虫活性较Okaramine B降低许多。这证明了Okaramine B中氮杂环丁烷的环结构的完整对其杀虫活性至关重要,而氮杂环辛二烯环上的不饱和键与杀虫活性相关。这一点也从Okaramine C和G的活性差異得到证明,二者的差异在于1,2的烯键,这个烯键被还原使得杀虫活性降低了5倍。综上所述,Okaramine类生物碱结构中对杀虫活性影响为氮杂环丁烷的完整性>氮杂环丁烷上3位的甲基>C环的甲氧基>氮杂环辛二烯环或其完整性。这为高活性Okaramine类生物碱的结构改造供了指导。
2.3 基于谷氨酸门控氯离子通道的Okaramine类生物碱的构效关系
Furutani等[13]测定了具有不同结构的Okaramine A、B、I、Q及4,5-二氢Okaramine B对谷氨酸门控氯离子通道的活性,同时还比较了杀虫活性与对谷氨酸门控氯离子通道的激活之间的关联。结果发现,Okaramine B的激活活性较Okaramine A和I更高,这在很大程度上是由于Okaramine B具有完整的氮杂环丁烷环结构。此外,C环上的甲氧基也对其抑制活性具有重要作用。通过比较Okaramine B和二氢-Okaramine B的结构差异与其对谷氨酸门控氯离子通道的作用,可以推断氮杂环辛二烯环可能与谷氨酸门控氯离子通道之间存在相互作用。而Okaramine类生物碱对谷氨酸门控氯离子通道的作用与其对家蚕的杀虫活性高度相关。
3 Okaramine类生物碱的生物合成
从Okaramine类生物碱的结构可以看出它们是由两个色氨酸通过缩合形成的二酮哌嗪类化合物。在一系列酶的作用下形成了具有多样结构的Okaramine类生物碱。。Lai等[4]通过对Okaramine类生物碱产生菌Penicillium simplicissimum AK-40菌株的基因组进行分析,发现Okaramine类生物碱的生物合成涉及到一个双模块的非核糖体肽类合成酶(OkaA)、1个或2个异戊烯转移酶(OkaC)、1个核黄素依赖的单加氧酶(OkaB)、2个P450单加氧酶(OkaD和OkaG)、1个α-酮戊二酸依赖双加氧酶(OkaE)和1个甲基转移酶(OkaF)。通过采用CRISP-Cas9技术,构建了多个基因缺失的突变株,进一步采用质谱分析,基本弄清了Okaramine类生物碱中Okaramine A~E及Okaramine N的生物合成路径及其生物合成基因簇中基因的排列(图2、图3),最先合成Okaramine C,再在P450单加氧酶的作用下合成Okaramine N,而Okaramine N进一步脱氢氧化生成Okaramine A,而Okaramine A在α-酮戊二酸依赖双加氧酶的作用合成了12-去羟基Okaramine E。12-去羟基Okaramine E在α-酮戊二酸依赖双加氧酶的同时作用下生成Okaramine E,进一步在P450单加氧酶及甲基转移酶的作用下生成Okaramine D。12-去羟基Okaramine E还可在α-酮戊二酸依赖双加氧酶的作用下生成3-脱甲基Okaramine B,再在甲基转移酶的作用下生成Okaramine B。该菌株中Okaramine J、H及其他Okaramine类生物碱的合成路径及所涉及的基因还没有确定。Lai等[4]还从其他研究者发表的Aspergillus
aculeatus的基因组序列中发现了Okaramine类生物碱合成相关的基因簇,其中有oka A~E(图3),而该菌株可合成Okaramine A、B、H和I。可以推测,在Aspergillus aculeatus菌株中也可能存在其他Okaramine生物合成基因,使Okaramine A可以通过脱异戊烯基合成Okaramine I,再进一步通过异戊烯转移酶的作用合成Okaramine H。Kato等[15]对Penicillium simplicissimum ATCC 90288菌株合成部分Okaramine衍生物的途径研究发现,该菌株也是先合成Okaramine C,再合成Okaramine A,再进一步合成12-去羟基Okaramine E,最后合成Okaramine B,推测该菌株可通过Okaramine A来合成Okaramine H,但涉及到的基因及酶还不清楚。
4 展望
Okaramine类生物碱具有很好的杀虫活性,作用机制研究表明其作用于昆虫神经传导相关的谷氨酸门控氯离子通道,其对人的γ-氨基丁酸门控氯离子通道及甘氨酸门控氯离子通道基本上没有抑制作用。这为该类化合物作为先导化合物进行安全高效的杀虫剂的开发提供了可能。目前有关于Okaramine类生物碱的某些衍生物,如Okaramine C[16]、J[17]、M[18]和N[19]的化学合成的报道,但未见报道发现比Okaramine B杀虫活性更好的衍生物。另外,尽管发现Okaramine类生物碱作用于谷氨酸门控氯离子通道,但没有有关Okaramine类生物碱作用于谷氨酸门控氯离子通道的分子机制的报道,有必要开展相关的研究,为高活性Okaramine类生物碱衍生物的合成提供指导,从而推动基于Okaramine类生物碱的安全高效杀虫剂的开发。
参考文献:
[1] 张一宾.微生物源杀虫剂的市场及发展趋向[J].世界农药,2009,31(增刊II):2-5.
[2] MURAO S,HAYASHI H,TAKIUCHI K,et al. Okaramine A,a novel indole alkaloid with insecticidal activity,from Penicillium simplicissimum AK-40[J].Agric Biol Chem,1988,52(3):885-886.
[3] HAYASHI H,TAKIUCHI K,MURAO S,et al. Okaramine B,an insecticidal indole alkaloid, produced by Penicillium simplicissimum AK-40[J].Agric Biol Chem,1988,52(8):2131-2133.
[4] LAI C Y,LO I W,HEWAGE R T,et al. Biosynthesis of complex indole alkaloids:Elucidation of the concise pathway of Okaramines[J].Angew Chem Int Ed,2017,56(32):9478-9482.
[5] HAYASHI H,ASABU Y,MURAO S,et al. New Okaramine congeners,Okaramines D,E and F from Penicillium simplicissimum ATCC 90288[J].Biosci Biotechnol Biochem,1995,59(2):246-250.
[6] HAYASHI H,SAKAGUCHI A.Okaramine G,a new okaramine congener from Penicillium simplicissimum ATCC 90288[J].Biosci Biotechnol Biochem,1998,62(4):804-806.
[7] SHIONO Y,AKIYAMA K,HAYASHI H. New okaramine congeners, okaramines J,K,L,M, and related compounds from Penicillium simplicissimum ATCC 90288[J].Biosci Biotechnol Biochem,1999,63(11):1910-1920.
[8] SHIONO Y,AKIYAMA K,HAYASHI H. Okaramines N,O,P,Q and R,new okaramine congeners from Penicillium simplicissimum ATCC 90288[J].Biosci Biotechnol Biochem,2000,64(1):103-110.
[9] HAYASHI H,FUJIWARA T,MURAO S,et al. Okaramine C,a new insecticidal indole alkaloid from Penicillium simplicissimum[J].Agric Biol Chem,1991,55(12):3143-3145.
[10] 林亞伟,王立平,王 乂,等.红树林耐酸真菌Aspergillus sp. OUCMDZ-1914次生代谢产物研究[J].有机化学,2015,35(9):1955-1960.
[11] HAYASHI H,FURUTSUKA K,SHIONO Y. Okaramine H and I,new okaramine congeners,from Aspergillus aculeatus[J].J Nat Prod,1999,62:315-317.
[12] CAI S,SUN S,PEN J,et al. Okaramines S-U,three new indole diketopiperazine alkaloids from Aspergillus taichungensis ZHN-7-07[J].Tetrahedon,2014,71(22):3715-3719.
[13] FURUTANI S,NAKATANI Y,MIURA Y,et al. GluCl a target of indole alkaloid okaramines:A 25 year enigma solved[J].Sci Rep,2014,4:6190.
[14] SHIONO Y,AKIYAMA K,HAYASHI H. Effect of the azetidine and azocine rings of okaramine B on insecticidal activity[J].Biosci Biotechnol Biochem,2000,64(7):1519-1521.
[15] KATO N,FURUTANI S,OTAKA J,et al. Biosynthesis and structure-activity relationship studies of okaramines that target insect glutamate-gated chloride channels[J].ACS Chem Biol,2018,13(3):561-566.
[16] HEWITT P R,CLEATOR E,LEY S V. A concise total synthesis of (+)-okaramine C[J].Org Biomol Chem,2004,2:2415-2417.
[17] ROE J M,WEBSTER R A,GANESAN A. Total synthesis of (+)-okaramine J featuring an exceptionally facile N-reverse-prenyl to C-prenyl aza-Claisen rearrangement[J].Org Lett,2003,5(16):2825-2827.
[18] IIZUKA T,TAKIGUCHI S,KUMAKURA Y,et al. First total synthesis and stereochemical revision of okaramine M[J].Tetrahedron Lett,2010,51:6003-6005.
[19] BARAN P S,GUERRERO C A,COREY E J. Short,enantioselective total synthesis of okaramine N[J].J Am Chem Soc,2003,125:5628-5629.
