醇类燃料自燃主导反应及其对滞燃期的影响
2019-01-11钟祥麟张爽
钟祥麟 张爽
(1.中国汽车技术研究中心有限公司;2.吉林大学)
醇类燃料燃烧存在一系列的化学反应,且这些化学反应比较单一,即总存在着一些特定的反应主导着基元反应的进行,将具有标志功能、首先发生的反应称之为主导反应。从更高的时间分辨率、更细的空间分辨率来看,对于每一个燃烧反应区而言,其起燃过程不应该是所有反应物与所有可能的基元反应同时发生,而仅是分子碰撞能高于反应活化能的2个反应物先导反应,产生了更高的分子碰撞能或降低了另一个反应的活化能,从而引起整个燃烧反应区燃烧完成。文章根据醇类燃料(甲醇、乙醇、正丁醇)的反应路径图找出了醇类燃料的主导反应,并讨论主导反应的2种反应物间的分子碰撞能与滞燃期之间的关系。
1 醇类燃料主导反应分析
1.1 利用CHEMKIN建立反应路径
CHEMKIN是燃烧领域用来解决带有化学反应流动问题的模拟计算工具[1]。文章利用CHEMKIN软件中的封闭均相反应器模型,对3种醇类燃料的自燃主导反应进行分析,建立了醇类燃料自燃燃烧的反应路径图。
为了确保燃料能够可靠自燃,选取特定的边界条件:热力学温度(T)为 800 K,压力(P)为 3.86 MPa,当量比(φ)为1,对CHEMKIN软件的封闭均相反应器模型具体参数设置,如表1所示[2]。反应路径的获取方法主要是对醇类燃料燃烧时的重要中间产物进行产率分析,画出燃烧时重要物质的产率分析图,再对每个反应的产率曲线进行积分,即可计算出该反应在这段时间内生成(或消耗)燃料的摩尔分数,用所得积分数除以该种物质生成(或消耗)所有涉及反应的产率曲线积分数之和,所得百分数即为这个反应对该种物质生成(或消耗)反应的影响大小。图1示出根据仿真结果绘制出的3种醇类燃料自燃的反应路径图,其中M代表催化剂。
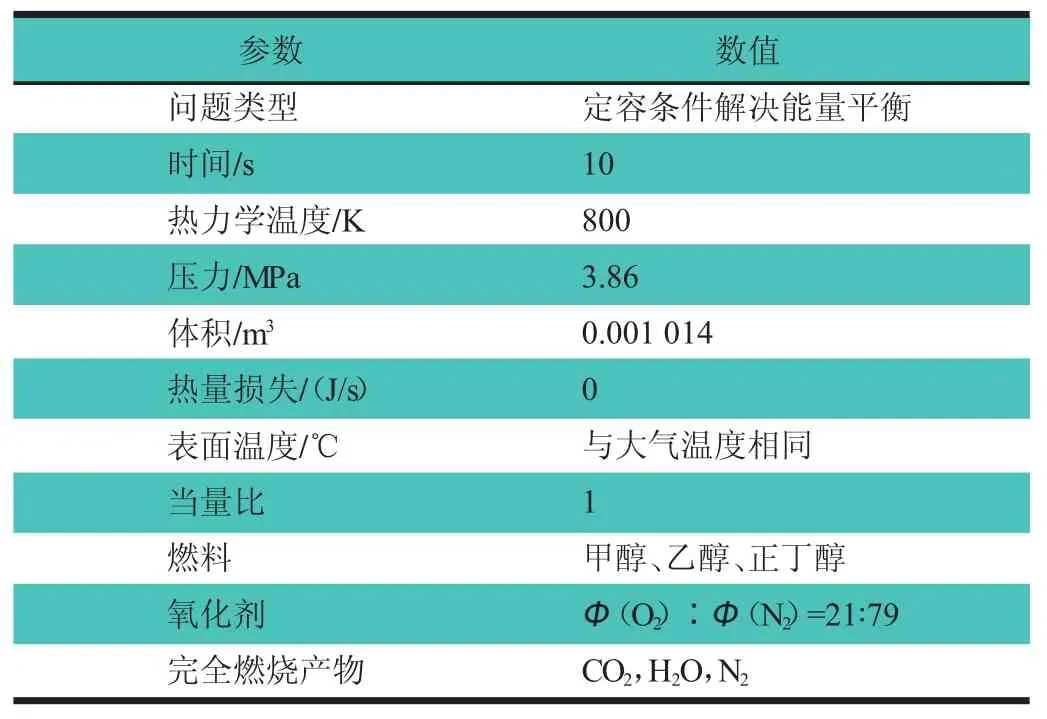
表1 CHEMKIN模拟醇类燃料氧化的参数设置
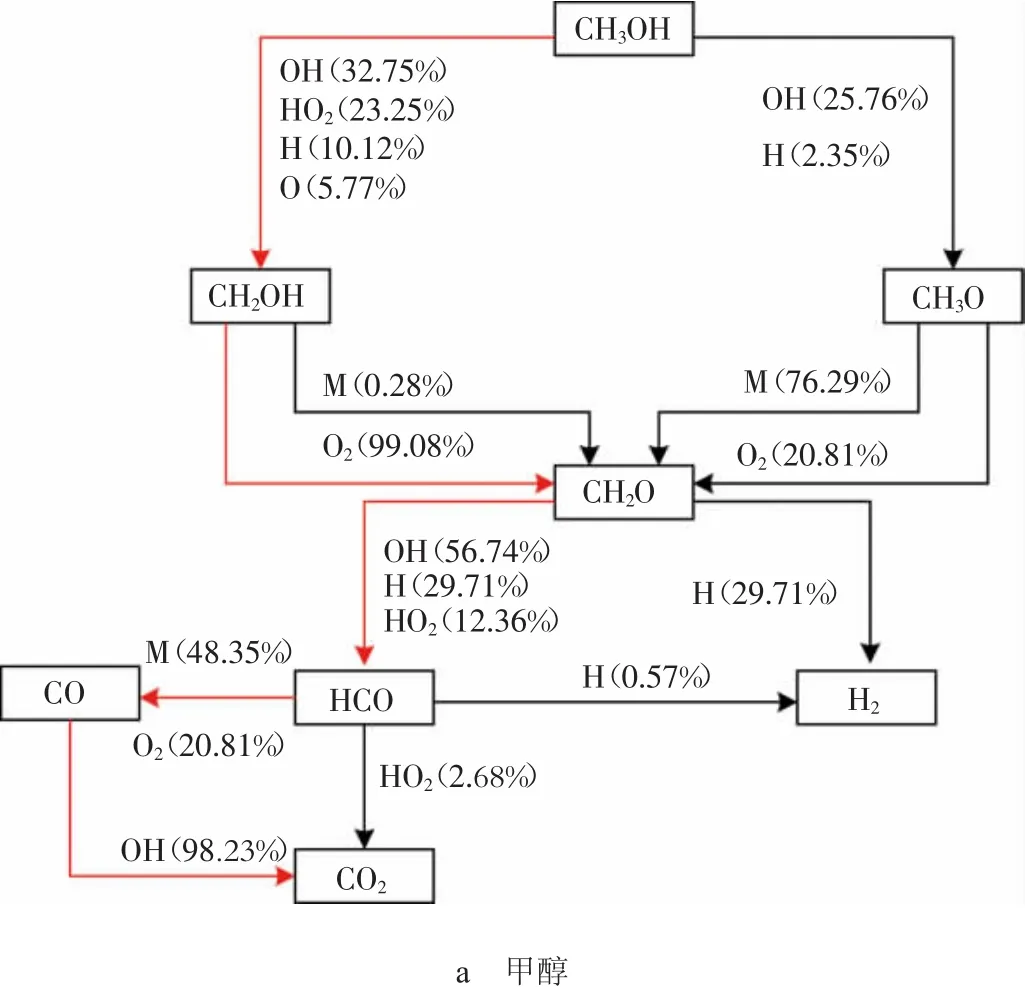
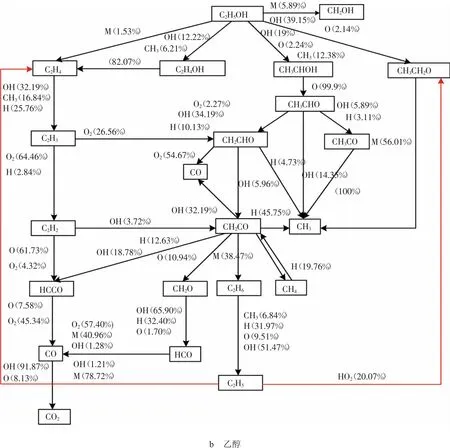
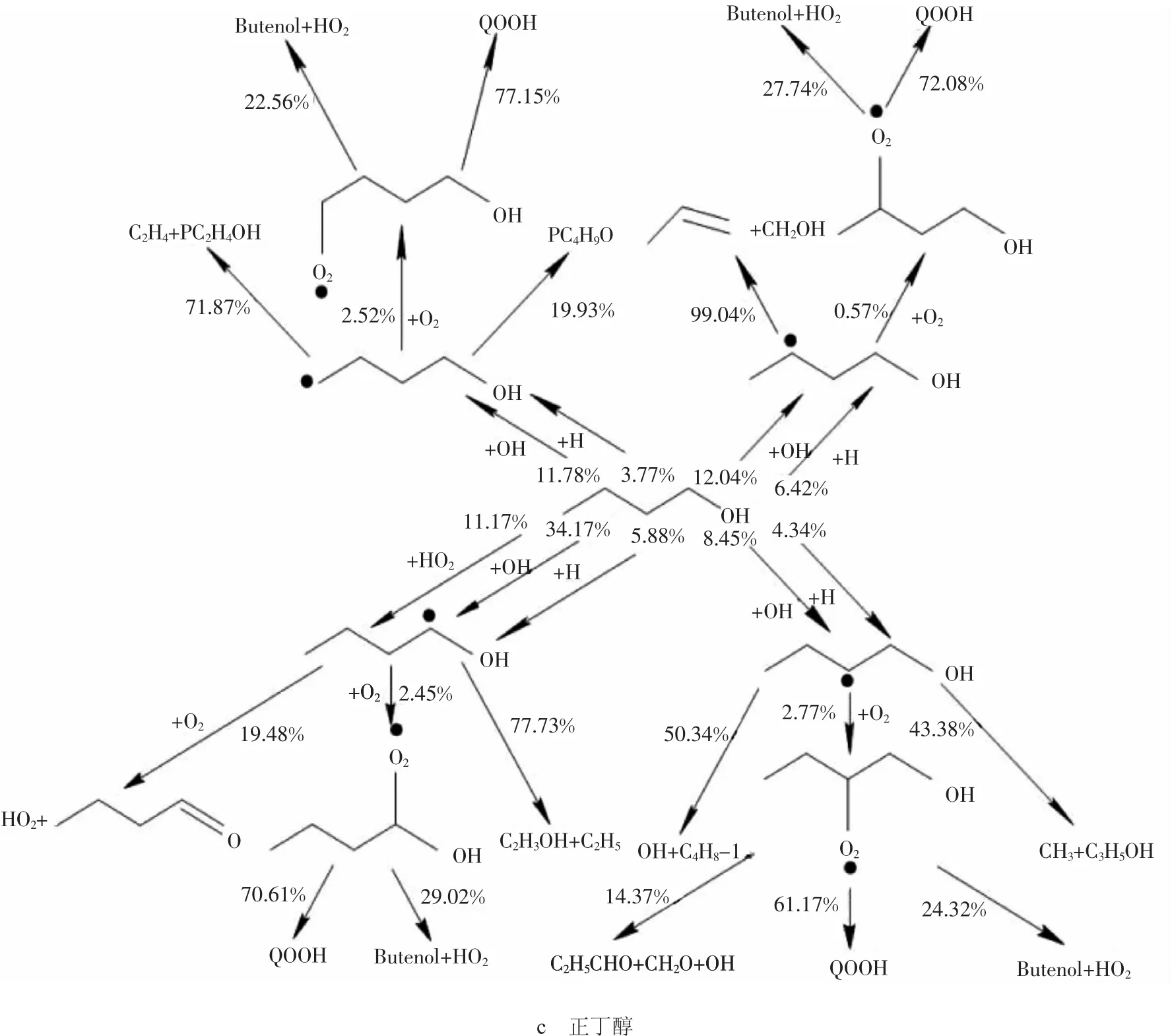
图1 3种醇类燃料自燃反应路径分析图
1.2 醇类燃料燃烧的主导反应
链式反应是一种非常重要的化学反应,它包含链引发、链传递、链终止3个基本过程[3-5]。其中链引发反应需要断裂分子中化学键的键能,所以它也是整体反应中最难进行的一步,在整个化学反应的过程中具有主导作用,因此将醇类燃料燃烧链引发阶段的主要反应既定为醇类燃料的主导反应。文章以甲醇为例,研究甲醇燃烧的链式反应过程并找出甲醇燃烧的主导反应。
1)链引发。从图1a可以看出,甲醇燃烧的链引发阶段主要进行的是脱氢反应,氢原子主要包括甲基位上的氢原子和羟基氢原子,由于甲基位上的氢原子键能较低,所以在OH,O,H等活性基作用下,主要进行的是C-H键的断裂,生成CH2OH;随着反应系统能量的进一步积聚,O-H键开始断裂并伴随着少量CH3O的生成,其链引发的主要反应为:
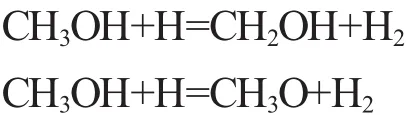
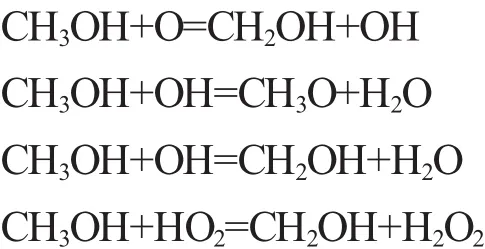
2)链传递。甲醇的链传递过程主要是指CH2OH的O-H键断裂和CH3O的C-H键断裂生成CH2O和H、HO2等自由基,其链传递的主要反应如下:
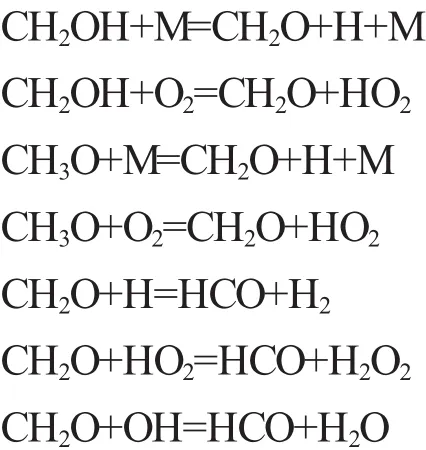
3)链终止。甲醇的链终止主要反应如下:
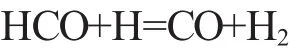
在氧气的作用下CO和H2再进一步氧化为CO2和H2O。
从上述分析可得:甲醇燃烧在链引发阶段发生的脱氢反应即为甲醇自燃的主导反应,OH进攻H原子从而引起了C-H键的断裂是该反应的标志,且主导反应的2个反应物间的分子碰撞能在数值上与C-H键的键能相等。
根据图1b可得,乙醇燃烧的链引发反应主要分为裂解反应和脱氢反应2种。裂解反应主要是乙醇分子中C-C键的断裂,此反应可以快速形成着火自由基,但是由于C-C键的键能较大,断裂时所需的能量较高,在此边界条件下,此反应所占的比重较小。大部分乙醇发生脱氢反应,在 H,OH,HO2,O,CH3等活性基作用下发生C-H键的断裂和O-H键的断裂,因此C-H键的断裂仍是乙醇燃烧主导反应的标志,其主要反应如下:
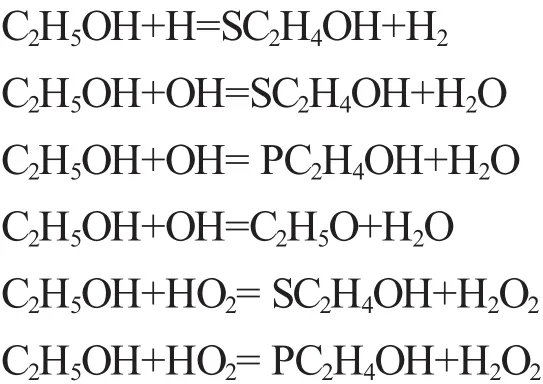
正丁醇的反应虽然相对较为复杂,但是仍然可以将其反应过程归纳为链引发、链传递和链终止3个阶段。其中正丁醇的链引发反应主要是OH进攻H原子产生的脱氢反应,正丁醇(CH3CH2CH2CH2OH)有5个位置的H原子,分别为α位氢原子、β位氢原子、γ位氢原子、δ位氢原子和羟基位氢原子,也可称为1、2、3、4及羟基位氢原子,根据脱氢位置不同,其反应生成物分别为 C4H8OH-1,C4H8OH-2,C4H8OH-3,C4H8OH-4。不同的羟基丁基R与O2结合生成过氧羟烷基ROO(如C4H8OH-1O2),部分ROO进一步异构化生成过氧化氢羟烷基QOOH(如C4H7OH-1OOH-1)等。
可见同甲醇一样,乙醇和正丁醇燃烧的主导反应均为其各自链引发反应阶段所发生的主要反应,即脱氢反应,故可将C-H键的断裂作为醇类燃料主导反应的标志。
2 分子碰撞能对滞燃期的影响
2.1 醇类燃料中C-H键数目计算
在前面的讨论中已知3种醇类燃料自燃的主导反应都是以C-H键的断裂为标志的脱氢反应,且C-H键的键能在数值上应与主导反应的2个反应物之间的分子碰撞能大小相等,由此可见燃烧反应物中所含C-H键的数量对醇类燃料自燃特性至关重要。
醇类燃料的自燃特性受很多因素的影响,文章以滞燃期来表征。滞燃期是燃料燃烧时所存在的一个重要阶段,反映了燃料在燃烧过程中原子团链分解和氧化的速率,直接影响后续的燃烧反应,是研究燃料燃烧过程中最重要的参数,其定义为从混合气制备到明显产生火焰的这段时间。相关研究表明,化学反应速率是影响燃料滞燃期的主要因素[6-9]。而在影响化学反应速率的因素中,温度、压力和当量比都是其中不可忽视的因素。由此,将反应物中C-H键的数量作为初始反应中不变的指标因素,进而对醇类燃料自燃的燃烧边界进行关联性分析。这里主要以甲醇为例:
当量比(φ)的计算公式为:
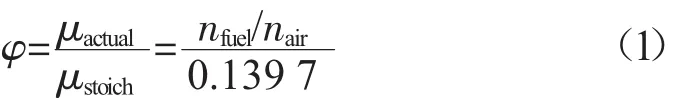
式中:μstoich——理论燃空比,为定值,对于甲醇、乙醇、丁醇,μstoich分别约为 0.139 7,0.069 8,0.034 9;
μactual——实际燃空比;
nfuel,nair——混合气中燃油的、空气的物质的量,mol。
再根据理想气体状态方程:

式中:P——初始压力,MPa;
V——燃烧室容积,V=0.001 014 m3;
n——物质的量,mol;
T——热力学温度,K。
进而求出 nair和 nfuel,分别如式(3)和式(4)所示。
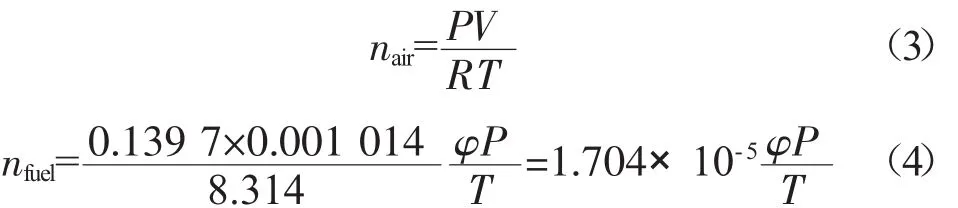
式中:R——理想气体常数,J/(mol·K)。
由甲醇结构式可以得出,1 mol甲醇中含有3 mol的C-H键,所以燃料中总的C-H键的数目(N)为:
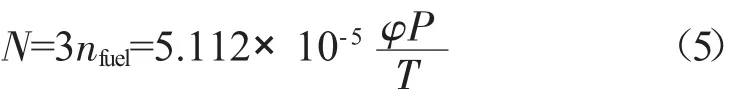
2.2 仿真过程与结果分析
首先保证燃料中C-H键的数目不变,即φP/T为定值,在某特定温度下,根据初始压力调整当量比的大小,初始压力分别选取 3.86,1.93,1.29,0.97,0.77 MPa,保证燃料中总的C-H键的数目为9.87×10-5mol,当热力学温度分别为800,1 000,1 200 K时,其相应的φP值分别为224.01,280.05,336.06,从而求出每种压力下的当量比,利用CHEMKIN软件对每种边界条件下的燃料滞燃期进行测定,结果如图2所示。
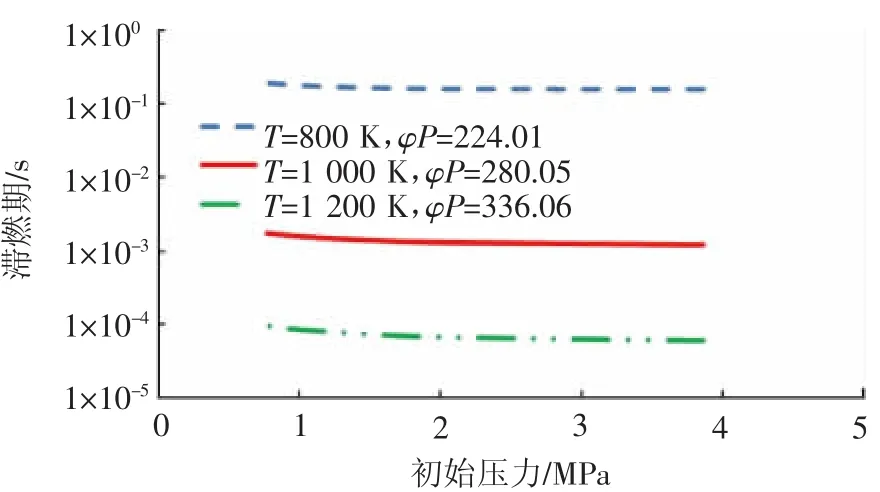
图2 甲醇自燃燃烧边界关联性分析
从图2中可以看出,同一温度下,保证当量比和压力的乘积(φP)不变,即燃料中总的C-H键的数目不变时,燃料的滞燃期基本维持在同一数量级上。为了更加直观地表征每种温度下燃料滞燃期的波动幅度,分别计算出热力学温度为800,1 000,1 200 K时燃料滞燃期的方差分别为 1.358 39×10-4,3.961 66×10-8,1.772 38×10-10,可以看出其数值均非常小,接近于0,也就是说其滞燃期的波动非常小,由此可以认为同一温度下,保证当量比和压力的乘积不变,燃料的滞燃期是基本不变的。这是因为当燃料中C-H键数目一定时,醇类燃料燃烧的主导反应的反应物间分子碰撞能为定值。
不同温度下燃料的滞燃期却基本不在一个数量级上,其中同一压力下热力学温度为800 K时的燃料的滞燃期大约是热力学温度为1 000 K的100倍、为1 200 K的1 000倍,究其原因:一方面由于温度升高,反应燃料分子能量增加,此时虽然保证燃料中C-H键的数目相同,但是由于反应活性分子的数量增加,反应速率增加;另一方面温度升高使燃料反应路径发生了变化,小分子反应逐渐增多,所以燃料的滞燃期仍然会缩短。
由于单位摩尔质量的甲醇、乙醇和正丁醇所含的C-H键的数目不尽相同,为了进一步说明,选取热力学温度为800 K,保证燃料中的C-H键的数目相同,均为9.87×10-5mol,同样的方法计算此时乙醇和丁醇的φP值,当初始压力分别为 3.86,1.93,1.29,0.97,0.77 MPa,计算相应的当量比,并对每种边界条件下燃料的滞燃期进行测定,结果如图3所示。从图3中可以看出,当热力学温度相同时,虽然保证3种燃料中的C-H键的数目相同,但是3种燃料的滞燃期仍然有所差异,其中同一初始压力下的甲醇的滞燃期约为乙醇的2倍、正丁醇的20倍。分析其原因为,乙醇和正丁醇分子中还含有C-C键,而C-C键的断裂也会对反应速率产生影响,致使三者的滞燃期仍有所差异。但是对于同一种燃料,保证φP为一定值,即保证了燃料中C-H键的数目一定,其燃料的滞燃期仍是基本保持在同一水平线上。通过计算这3种燃料在不同初始压力下滞燃期的方差,其数值分别为 1.358 39×10-4,8.734 39×10-5,6.839 8×10-6,3种燃料的方差值均很小,证明同一种燃料在同一温度下只要保证燃料中C-H键的数目不变,即分子碰撞能为定值时,燃料的滞燃期是基本维持不变的。

图3 3种醇类燃料自燃燃烧边界关联性分析
3 结论
文章利用CHEMKIN软件分别对甲醇、乙醇和正丁醇在初始边界条件(热力学温度为800 K,压力为3.86 MPa,当量比为1)下进行模拟,根据仿真结果得到了醇类燃料自燃的反应路径图,通过对反应路径图的分析找出了影响醇类燃烧的主导反应,并进一步研究了主导反应反应物之间的分子碰撞能对燃料自燃特性的影响,得出:
1)醇类燃料燃烧可总结为链式反应的形式,其中链引发反应在醇类燃烧中起着主导作用,将链引发阶段发生的主要反应称为主导反应。根据反应路径图可知,甲醇、乙醇、正丁醇的主导反应的标志均为C-H键断裂而引发的脱氢反应。
2)C-H键断裂所需的能量在数值上与主导反应反应物之间的分子碰撞能大小一致,进一步研究分子碰撞能对醇类燃料自燃特性的影响,结果表明:当控制燃料中的C-H键数目一定,即燃料中主导反应反应物间的分子碰撞能大小相同时,同一温度下不同燃料的滞燃期因分子结构的不同滞燃期存在明显差异,而同一种燃料的滞燃期波动较小,基本维持不变。
