基于高效液相色谱-三重四极杆质谱技术测定荔枝和香蕉中的草铵膦及3种代谢物
2019-01-05王思威曾广丰刘艳萍王潇楠孙海滨
王思威, 曾广丰, 刘艳萍, 王潇楠, 孙海滨*
(1. 广东省农业科学院植物保护研究所, 广东省植物保护新技术重点实验室, 广东 广州 510640;2. 广东省出入境检疫检验局检验检疫技术中心, 广东 广州 510623)
草铵膦(glufosinate-ammonium, GA)是德国赫斯特公司开发的广谱、触杀型灭生性有机磷类除草剂,其除草作用机理为特异性地抑制植物的谷氨酰胺合成酶活性,导致植物体内氮代谢紊乱,过量累积铵,从而使叶绿体解体、光合作用受到抑制导致死亡[1,2]。由于杂草对草铵膦不易产生抗药性,这促使草铵膦的销售量激增。草铵膦的主要代谢产物为3-(甲基膦基)丙酸(3-methylphosphinico-propionic acid, MPP)、2-(甲基膦基)乙酸(2-methylphosphinico-acetic acid, MPA)和N-乙酰草铵磷(N-acetyl-glufosinate, NAG)(结构式见图1)。已有研究表明草铵膦在急性剂量水平下可对人体产生有害影响[3],低剂量水平下对人体的慢性影响暂不清楚[4];草铵膦对人体的生殖系统会产生毒性,其代谢产物也为有毒物质,对人类健康存在一定的风险性[5,6]; JMPR(Joint FAO/WHO Meeting on Pesticide Residues)报告中显示,山羊、蛋鸡饲喂含草铵膦的饲料后,在羊奶、鸡蛋、组织和排泄物中的主要残留成分为草铵膦游离酸(glufosinate), glufosinate再代谢为MPP和少量的NAG、MPA[7]。因此,开展草铵膦及代谢产物在不同基质中的分析方法研究十分必要。
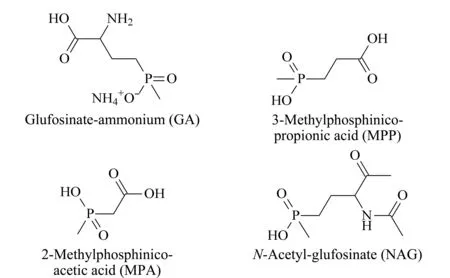
图 1 草铵膦及其代谢物的化学结构式Fig. 1 Chemical structures of glufosinate-ammonium and its metabolites
目前,关于草铵膦的研究仍主要集中于母体[8-16],其代谢产物MPP和NAG的分析方法较少[6],暂未发现MPA的相关报道。
由于草铵膦及其代谢物具有低挥发性、高水溶性、缺乏紫外生色团以及结构上存在阴离子等特性,故气相色谱和液相色谱很难直接检测[16]。Royer等[17]通过预先采用三氟乙酸酐等作为衍生剂将草铵膦衍生,然后采用GC-MS检测;See等[18]采用在线毛细管电泳结合电容耦合非接触电导检测草铵膦;Chang等[19]首先用9-芴基氯甲酸甲酯对草铵膦进行柱前衍生,毛细管电泳分离,紫外检测器检测草铵膦衍生物;Kusters和Gerhartz[20]采用液相色谱-荧光检测器用9-芴基氯甲酸甲酯对草铵膦进行柱前衍生后测定草铵膦残留。国内有关草铵膦母体的分析方法主要为固相萃取小柱净化-衍生-HPLC(UPLC)-MS/MS检测,过滤柱净化-离子色谱(IC)检测,固相萃取小柱净化-毛细管电泳(CE)紫外检测法等,代谢物MPP和NAG主要采用碱液提取后HPLC-MS/MS直接进样分析,其中MPP采用毛细管电泳-紫外检测结合固相萃取小柱进行分析[8-16]。
欧盟规定草铵膦的残留定义为glufosinate及其盐、MPP和NAG之和;日本对glufosinate的残留定义为glufosinate、MPP和NAG之和;CAC(Codex Alimentarius Commission)规定草铵膦残留定义为草铵膦、MPP和NAG之和;中国GB 2763-2016上规定草铵膦的残留定义仅为草铵膦。欧盟、日本和CAC规定草铵膦在荔枝、香蕉、芒果等水果中的最大残留限量值(MRLs)为0.1~0.2 mg/kg[21-23],我国仅规定了草铵膦在香蕉、柑橘和番木瓜3种水果中的MRLs值(0.2~0.5 mg/kg),且均为临时限量[24]。因此,通过建立草铵膦及其3种代谢物在水果中的分析方法,可为草铵膦在上述水果中的残留试验提供方法参考,为残留限量的制定提供保障,同时为市场上草铵膦及代谢物的残留水平监测提供方法依托。
1 实验部分
1.1 仪器与试剂
AB SCIEX 4000Q三重四极杆质谱仪,配电喷雾离子源(ESI)(美国AB SCIEX公司); Agilent LC-1200高效液相色谱仪(美国安捷伦公司); Milli-Q超纯水机(美国Millipore公司); GTR22-1离心机(北京时代北利离心机有限公司); OA-SYS氮吹仪(美国); XW-80A涡旋仪(上海精科有限公司)。
乙腈和甲醇(色谱纯,美国Fisher公司);甲酸和氨水(色谱纯,美国Fluka公司);草铵膦标准品(99.2%,德国Ehrenstorfer公司); MPP、MPA、NAG标准品(纯度97.9%、99.4%、96.2%,德国Ehrenstorfer公司)。
1.2 实验方法
1.2.1样品处理
分别称取荔枝和香蕉样品5.0 g,置入50 mL离心管中,加入10 mL水进行提取,匀浆1 min,超声30 min后,10 000 r/min离心10 min。取2 mL上清液,旋转蒸发仪45 ℃浓缩至约50 μL,氮吹至近干,用含0.1%(v/v)氨水的甲醇定容至1 mL,过0.22 μm滤膜,待测。
1.2.2色谱-质谱条件
色谱条件 色谱柱为Agilent Extend-C18(150 mm×3.0 mm, 3.5 μm);流动相为0.1%(v/v)氨水-甲醇(9∶1, v/v),运行5 min;流速0.5 mL/min;柱温35 ℃;进样量10 μL。
质谱条件 ESI-,多反应监测模式,离子源温度450 ℃,气帘气压力206.85 kPa(30 psi),毛细管电压4 500 V,雾化气压力344.75 kPa(50 psi)。其他相关参数见表1。
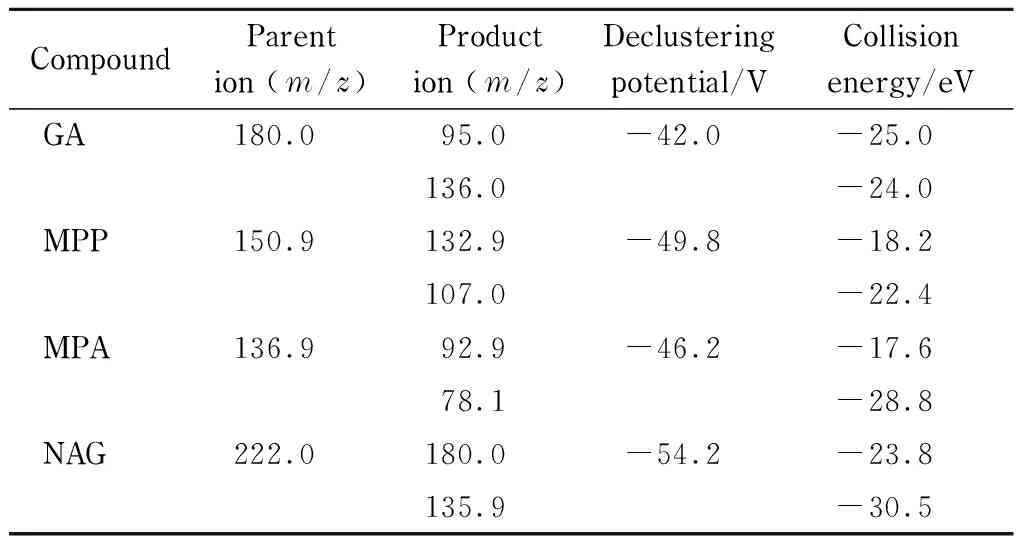
表 1 草铵膦及3种代谢物的质谱参数Table 1 MS parameters of GA and its three metabolites
2 结果与讨论
2.1 提取溶剂的选择
由于草铵膦及其代谢物均为水溶性,因此考察了1%(v/v,下同)甲酸甲醇-水(2∶1, v/v)、1%甲酸水溶液和水3种提取剂时对草铵膦及其3种代谢物的提取效率。结果显示,1%甲酸甲醇-水(2∶1, v/v)和1%甲酸水溶液作为提取溶剂时草铵膦及其代谢物的提取率均在40%以下,而水作为提取溶剂的提取率均在80%以上。因此,本研究选择水作为提取溶剂(见图2)。
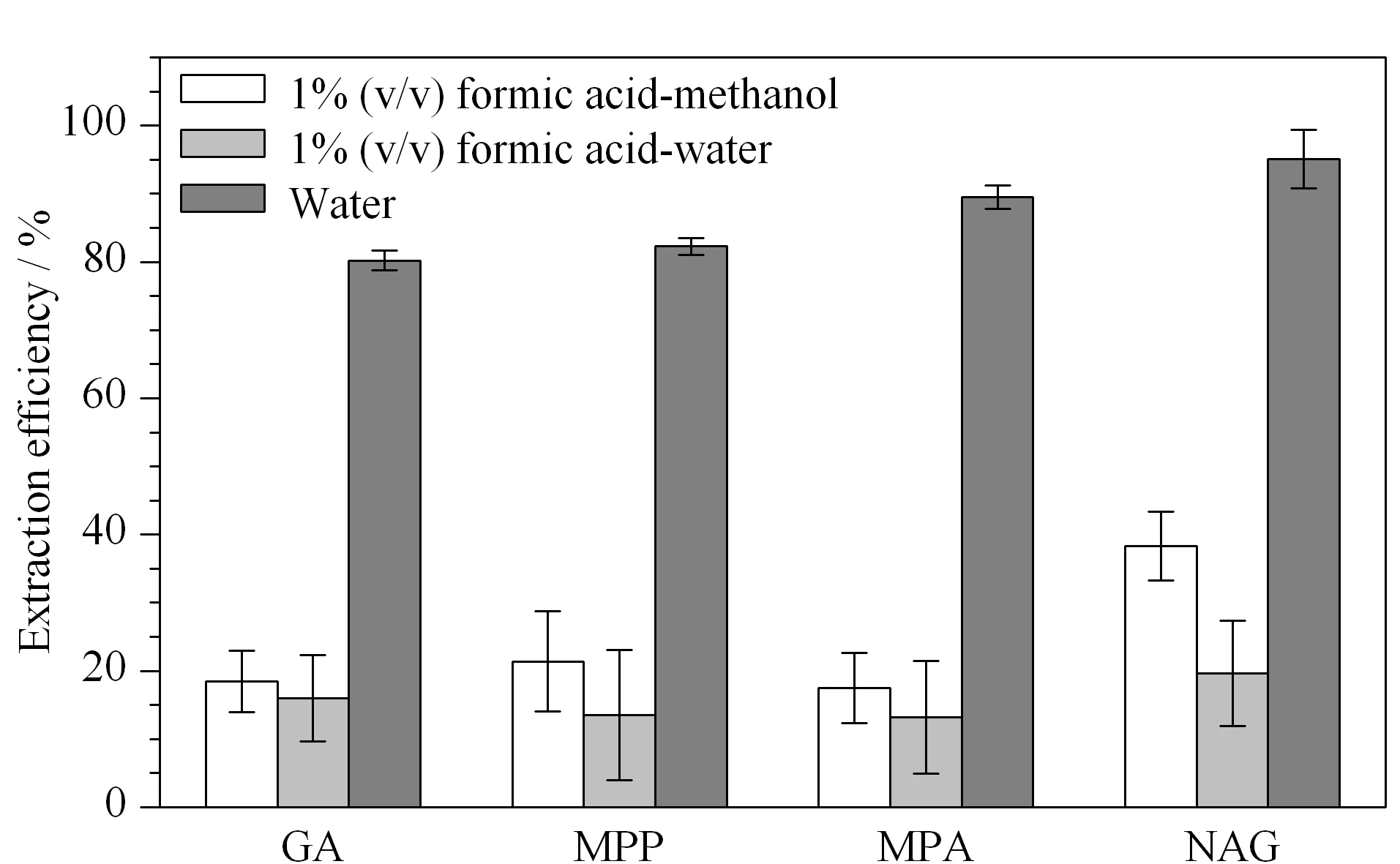
图 2 3种提取溶剂对草铵膦及其代谢物的提取效果(n=3)Fig. 2 Extraction efficiencies of three solvents for GA and its metabolites (n=3)
2.2 仪器条件优化
2.2.1色谱柱的选择
考察了Poroshell-120 EC-C18(150 mm×3.0 mm, 2.7 μm)、Poroshell-120 EC-C18(100 mm×2.1 mm, 2.7 μm)、XBridge C18(100 mm×2.1 mm, 3.5 μm)、Atlantis T3(100 mm×3.0 mm, 3.0 μm)、Extend C18(150 mm×3.0 mm, 3.5 μm)等5种色谱柱在不同流动相体系(乙腈-甲酸水和乙腈-氨水)下对4种目标物的分离能力。如图3所示:5种色谱柱在乙腈-0.1%甲酸水等度洗脱流动相体系(1∶9, v/v)的峰形对称性差,色谱峰拖尾严重,可能由于目标物酸性太强,在酸性流动相体系中与色谱柱作用力太强所致。因此改用氨水体系作为流动相。在碱性流动相体系下,上述5款色谱柱中,只有Extend C18(150 mm×3.0 mm, 3.5 μm)的固定相能耐受碱性流动相,且草铵膦及3种代谢物的峰形对称性和响应均良好,可用于本研究检测分析。

图 3 5种不同色谱柱对草铵膦及代谢物的色谱分离图Fig. 3 Chromatograms of GA and its metabolites on five different chromatographic columns Mobile phase: 0.1% formic acid aqueous solution-acetonitrile (9∶1, v/v).
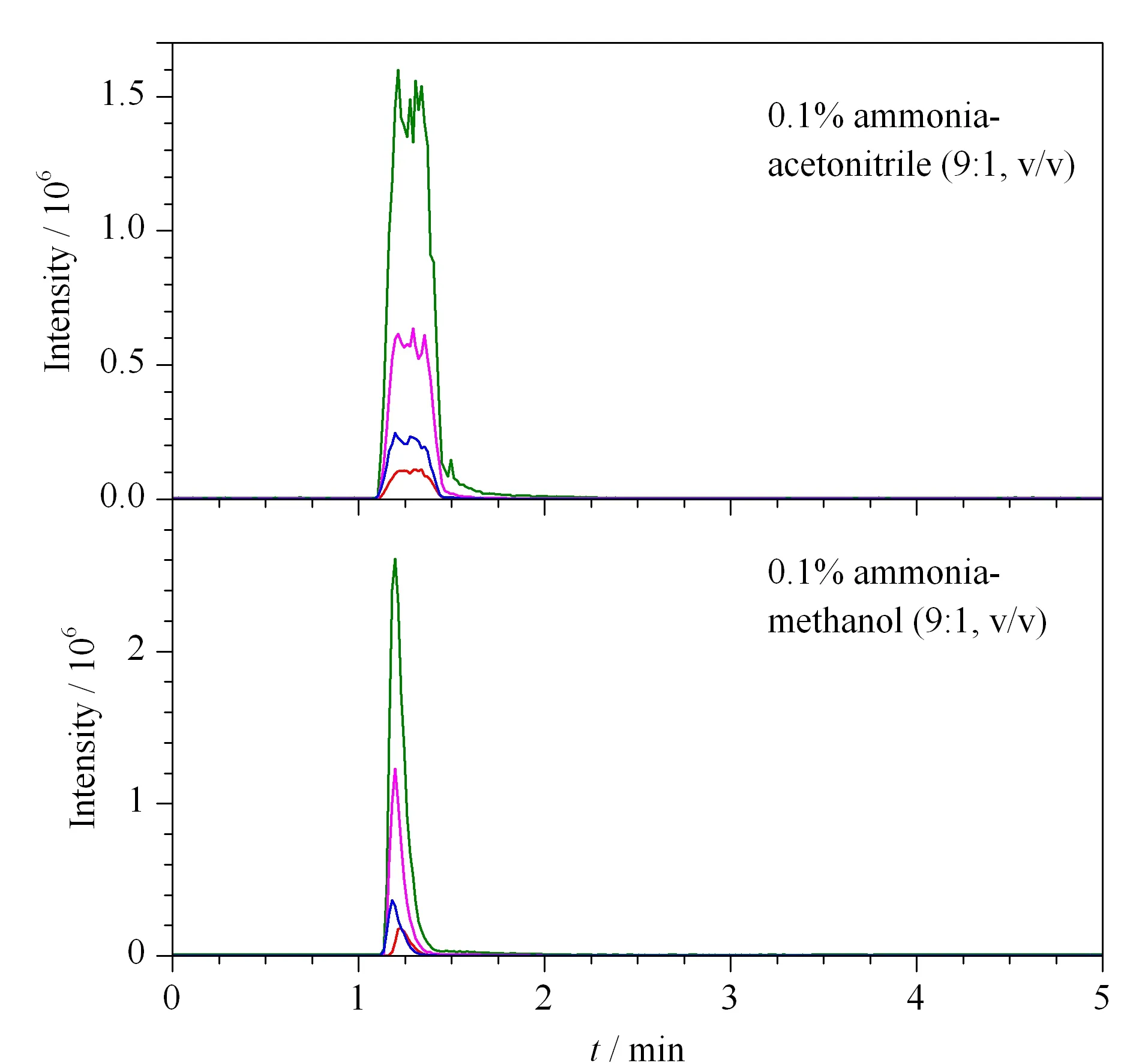
图 4 采用不同流动相时草铵膦及代谢物的色谱图Fig. 4 Chromatograms of GA and its metabolites with different mobile phases
2.2.2流动相的选择
考察了乙腈和甲醇两种有机相分别与氨水组合形成的流动相体系对草铵膦及3种代谢物的洗脱效果。结果如图4所示:有机相选用乙腈时,4种目标物的峰形出现峰展宽、不对称等现象,影响定量分析结果。使用甲醇-氨水作为流动相时,氨水的加入可使目标物峰形对称和峰宽更窄,并促成[M-H]-离子峰的形成,以[M-H]-作为母离子能够获取高强度的离子碎片,增强草铵膦及3种代谢物的响应值,提高检测分析的灵敏度。草铵膦是一种含有氨基的碱性农药,其他3种代谢物含有-COOH或-POOH基团,均具有较强的水溶性,需要流动相中水的含量较高,参考文献[6,11]选择流动相为0.1%氨水-甲醇(9∶1, v/v),能够保证草铵膦和3种代谢物的高响应值。因此,本研究选择0.1%氨水-甲醇(9∶1, v/v)作为流动相。
2.2.3质谱条件的优化
采用正负离子扫描模式对4种目标物进行了分析,发现目标物在ESI负离子模式下响应强度更高,分子离子峰均为[M-H]-形式。因此,在负离子扫描模式下确定了草铵膦及MPP、MPA和NAG的母离子分别为m/z180.0、150.9、136.9、222.0。为提高目标化合物的离子化效率,进而提高灵敏度,对源内参数(去簇电压(DP)、碰撞能量(CE)等)进行了优化。采用针泵进样的方式,优化去簇电压,在二级质谱中选择母离子响应强度最高、干扰最少的2个子离子作为定性和定量离子;在MRM模式下,对子离子的CE进行了优化,优化结果见表1。
2.3 基质效应的考察
考察了草铵膦及3种代谢物在纯溶剂及荔枝、香蕉基质中的响应情况。用0.1%氨水-甲醇(9∶1, v/v)溶液配制草铵膦及代谢物的系列标准混合溶液,同时,按照1.2.1的前处理方法,制备空白荔枝和香蕉基质溶液,用来配制与上述溶剂同浓度水平的系列基质匹配标准溶液。以基质匹配标准曲线的斜率与溶剂曲线斜率的比值评价基质效应,比值大于1,表现为基质增强效应,比值小于1则为基质抑制效应。实验结果表明,荔枝和香蕉样品均表现为强烈的基质抑制作用(见表2)。因此,本研究采用基质匹配标准溶液来校正基质抑制效应,从而确保研究结果的准确性和可靠性。
2.4 方法的线性范围及检出限
在1~1 000 μg/L范围内,以基质匹配标准溶液的进样浓度为横坐标,所对应的响应值为纵坐标作图,经最小二乘法得草铵膦、MPA、MPP及NAG基质匹配标准溶液线性方程(见表2),结果表明,线性关系良好。
以3倍和10倍信噪比(S/N)确定方法的检出限(LOD)和定量限(LOQ),具体结果见表2。

表 2 草铵膦及其代谢物的溶剂、基质匹配标准溶液的线性方程、相关系数、斜率比值、检出限及定量限Table 2 Linear equations, correlation coefficients and slope ratios, limits of detection (LODs), limits of quantification (LOQs) of GA and its metabolites in the solvent and matrices
y: peak area;x: mass concentration, μg/L.
2.5 回收率试验
对市场上抽测的5个荔枝和香蕉样品进行检测,均未检出草铵膦及其代谢物。在50、100、1 000 μg/kg 3个添加水平下,草铵膦及3种代谢物在荔枝和香蕉中的平均添加回收率为82.9%~98.6%,相对标准偏差(RSD)为2.6%~6.3%(见表3和图5)。方法的回收率和RSD范围符合残留分析检测要求[25]。
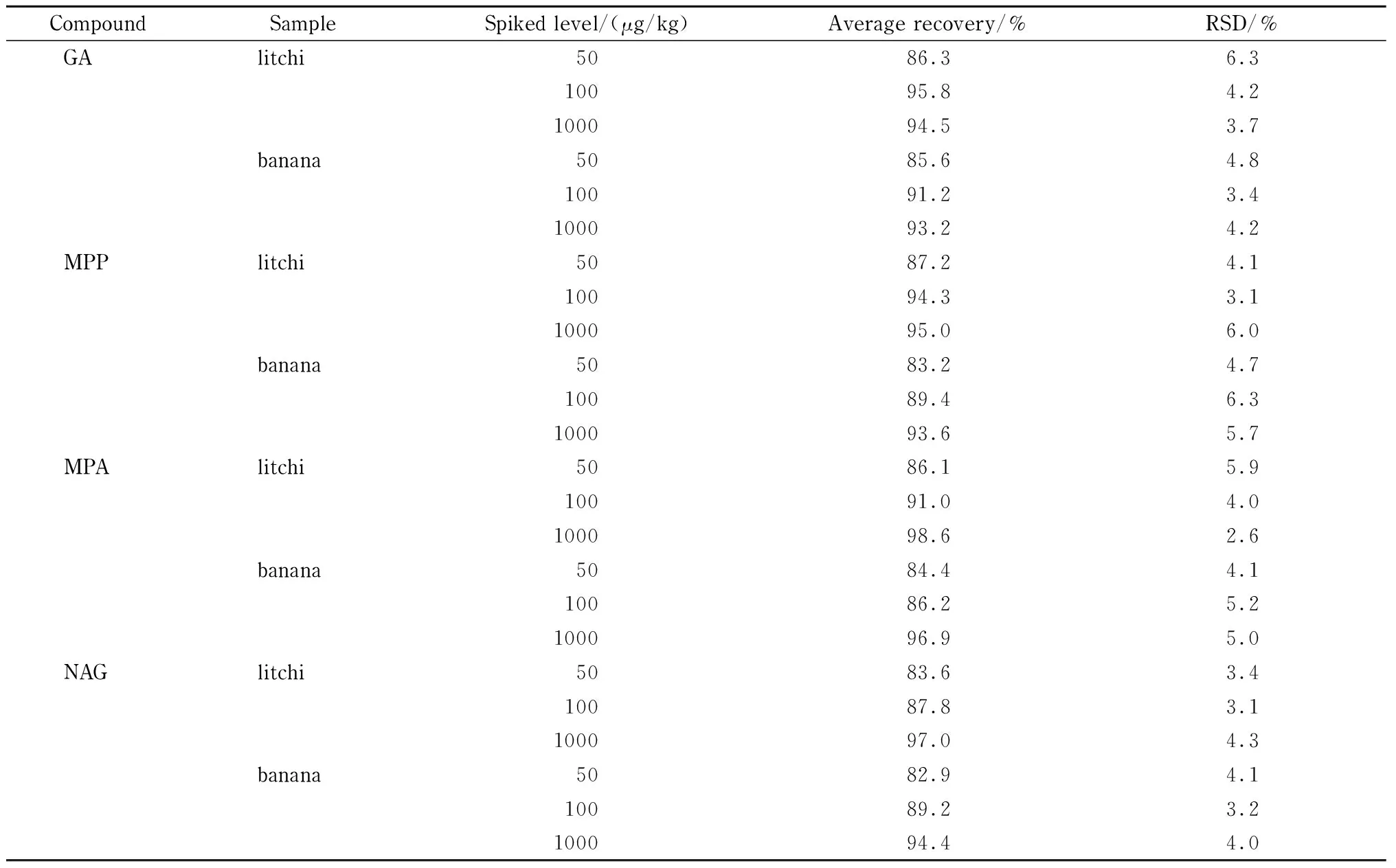
表 3 草铵膦及代谢物在荔枝、香蕉样品中的添加回收率和RSD(n=5)Table 3 Recoveries and RSDs of GA and its metabolites spiked in litchi and banana (n=5)
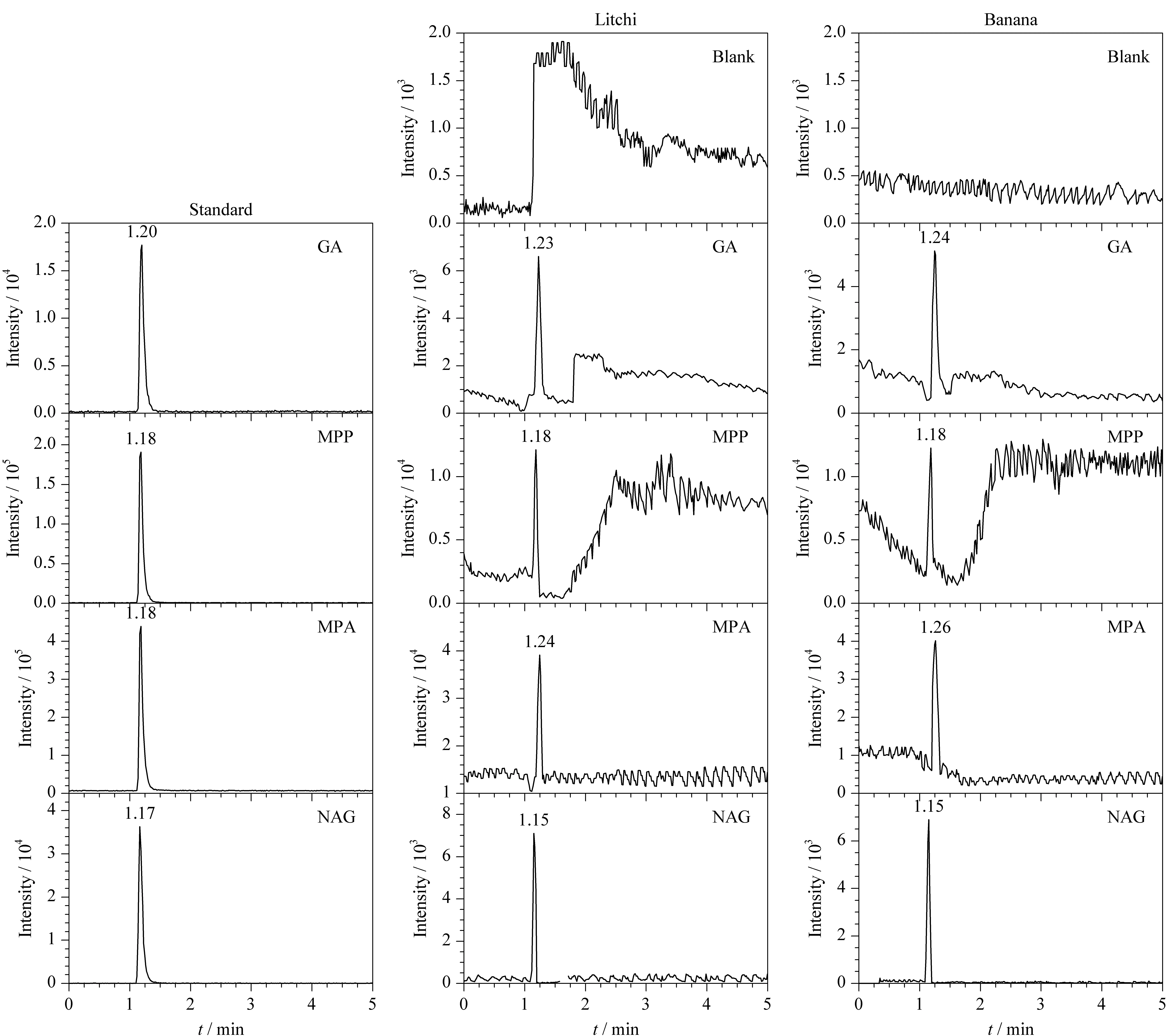
图 5 草铵膦和3种代谢物的标准溶液、荔枝和香蕉空白样品及加标(100 μg/kg)样品的色谱图Fig. 5 Chromatograms of a mixture of GA and its metabolite standards, blank and spiked samples of litchi and banana (100 μg/kg)
3 结论
本文建立了应用HPLC-MS/MS方法检测荔枝和香蕉中草铵膦及3种代谢物残留水平的分析方法,前处理方法操作简便、快速,仪器灵敏度高,适于批量样品的快速分析,可应用于市场抽检样品中草铵膦及其代谢物的快速监测。
猜你喜欢
杂志排行
色谱的其它文章
- 高效液相色谱-串联质谱法测定蔬菜水果中双甲脒及其代谢产物
- 高效液相色谱-四极杆/静电场轨道阱高分辨质谱对水产品中未知污染物的非定向快速筛查与测定
- 高效液相色谱-四极杆飞行时间质谱检测中国杨树型蜂胶、巴西绿蜂胶和杨树胶中的酚类化合物及真伪鉴别
- γ-Al2O3-氧化石墨烯吸附材料用于尿液中核苷的检测
- Impurity profile of macitentan in Tablet dosage form using a stability-indicating high performance liquid chromatography method and forced degradation study
- 超高效液相色谱-串联质谱法检验腐败血中吗啡和6-单乙酰吗啡
