miRNA调控植物抗逆机制的研究现状
2019-01-03李昕晏崔杰李俊良王琮玉罗成飞
李昕晏 崔杰 李俊良 王琮玉 罗成飞
摘要:逆境胁迫会对植物的生长发育产生负面影响,在漫长的进化中,植物拥有了一套复杂的调控网络以应对不良环境,在这一套调控网络中miRNA起到了重要作用。本文对近几年关于miRNA及其靶基因调控作用的研究进行了总结,并对miRNA的形成过程和作用机制进行了概括,介绍了与抗逆相关的miRNA及其靶基因,包括以靶基因为抗逆相关转录因子的miRNA(miR160/miR167、miR159、miR156和miR164)以及以靶基因为抗逆相关结构基因的miRNA(miR398和miR395),可为利用基因工程手段增强植物的抗逆性提供更有效的改良途径。
关键词:miRNA;逆境胁迫;转录因子;结构基因;靶基因
中图分类号: S332.1;S184文献标志码: A
文章编号:1002-1302(2019)21-0063-04
收稿日期:2018-09-28
基金项目:国家自然科学基金(编号:31571731)。
作者简介:李昕晏(1995—),女,湖南长沙人,硕士研究生,主要从事植物抗逆分子生物学研究。E-mail:496349958@qq.com。
通信作者:崔杰,博士,副教授,主要从事植物抗逆分子生物学研究。E-mail:cuijie2006@163.com。
1miRNA概述
microRNA(miRNA)是小的非编码内源性RNA(18~24个核苷酸),首先在线虫(Caenorhabditis elegans)中被发现,可在突变的秀丽隐杆线虫中暂时表达,所以miRNA最初被称为短时间RNA(stRNA)[1]。植物miRNA是一类内源性非编码小RNA,对植物生长发育至关重要。植物miRNA主要经过以下几个过程产生:首先编码miRNA的基因依赖RNA聚合酶Pol Ⅱ复合体形成长约1 000 bp的初级转录物,初级转录物呈现不完全配对的茎环结构,随后初级转录物转变为成熟的miRNA,该过程需要经过2个步骤,第1步在细胞核中进行,蛋白酶DCL1识别茎环结构并对其进行切割,形成前体miRNA,前体miRNA通过HASTY转运蛋白转运到细胞质中;第2步在细胞质中进行,ATP依赖性RNase Ⅲ蛋白Dicer识别前体miRNA的2 nt 3′突出端,并从其末端去除约21 nt序列形成成熟的miRNA-miRNA*双链体[2]。接着成熟的miRNA双链体展开形成22 nt的单链成熟miRNA,其与Argonaute蛋白-1(AGO-1)以及其他调节蛋白如GW182和聚A结合蛋白(PABP)一起形成RNA诱导沉默复合物(RISC)。最后,成熟的miRNA沉默复合体(RISC)通过与靶mRNA转录物3′端非翻译区(3′UTR)中的区域进行碱基互补配对导致靶mRNA翻译抑制或降解。靶mRNA被抑制还是被降解取决于其与同源miRNA序列的互补程度。在动物中miRNA与靶mRNA的相互作用是部分互补,会导致蛋白质翻译被抑制,而在植物中是完全互补,会导致靶基因完全降解[3-4]。
2miRNA在植物抗逆过程中的作用方式
2.1通过靶向应激相关转录因子抗逆
研究表明,一些miRNA的靶基因可翻译为与应激相关的转录因子[5-7]。转录因子是一种蛋白质,它能够与下游靶基因启动子区域中的顺式作用元件发生特异性结合,激活或抑制基因的表达。转录因子一般有4个保守的功能区,分别为DNA结合域、转录激活或抑制结构域(转录调控域)、寡聚化位点和核定位信号。但并不是所有的转录因子都具有以上所有的功能区,有些转录因子没有寡聚化位点。DNA結合域能够识别并结合特定的顺式作用元件,其氨基酸序列的特异性决定了转录因子能够结合的顺式作用元件的特异性。转录调控域是转录因子家族的分类依据,同一类转录因子家族拥有相似的转录调控区域,根据对靶基因作用的差异可将其分为转录激活域和转录抑制域。寡聚化位点的存在是转录因子发生相互作用形成同源或异源二聚体的条件。核定位信号是富含精氨酸和赖氨酸残基的核定区域,转录因子通过该区域的调控进入细胞核[8]。植物中的转录因子数量众多,且广泛地参与植物生长发育过程,其中一部分转录因子与抗逆有关,能够在植物受到胁迫时被胁迫信号激发,与特定基因的启动子结合,调控其表达从而引起植物发生生理生化变化,进而提高植物抵抗外界环境压力的能力。
2.1.1miR160/miR167与转录因子ARF互作研究
生长素可调节许多基因的表达,生长素响应因子(ARF)是调节其下游靶基因表达的基因。大多数ARF蛋白由3个特征结构域组成,即B3 DNA结合结构域(DBD),位于N末端区域;C-末端二聚化结构域(CTD),位于C-末端区域,是一个蛋白质-蛋白质相互作用结构域,其氨基酸序列与Aux/IAA蛋白质C-末端的结构域Ⅲ和Ⅳ相关,允许ARF或ARF和Aux/IAA蛋白的二聚化;赋予活化剂或阻遏物活性的可变中间区域(MR)。miR160和miR164被发现靶向ARF转录因子[9-10]。
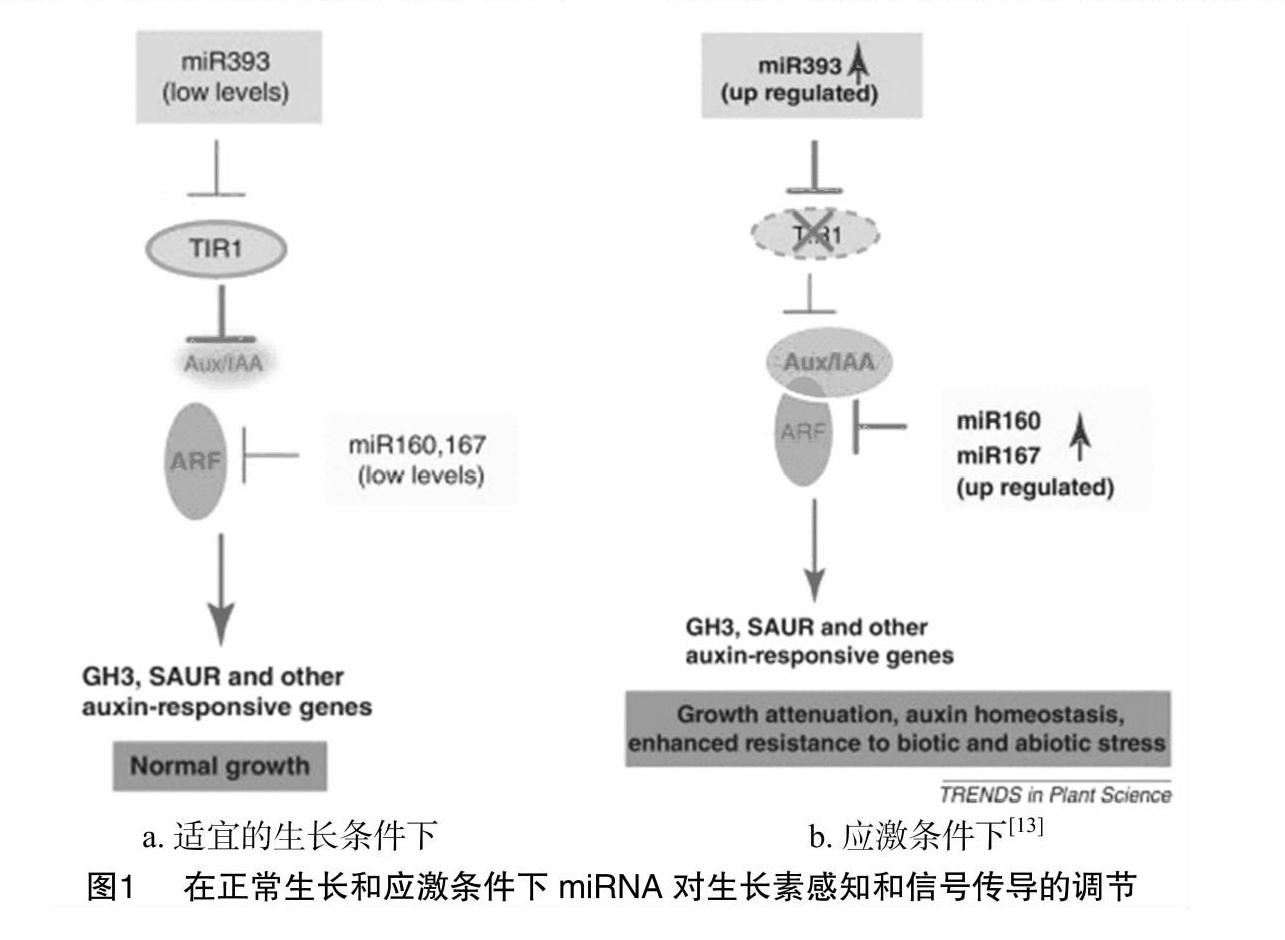
在几种植物物种中观察到干旱和盐胁迫条件下,miR393、miR160和miR167的表达上调,已有研究证明,盐度触发miR393表达,导致TIR1和AFB2受体的结合被抑制,进而影响生长素信号转导途径[11]。而miR160和miR164通过负调节生长素响应因子ARF10、ARF16、ARF17等在植物发育中起关键作用[12]。miR393/(miR160,miR167)与ARF转录因子之间存在一个应对胁迫的调控途径,如图1所示。生长素受体TIR1通过释放AUX/IAA与生长素响应因子形成异二聚体的方式调控植物生长和发育所必需的生长素响应基因的表达。当生长素水平低时,ARF与AUX/IAA因子异二聚化。在结合生长素时,TIR1和AFB等受体被激活并使AUX/IAA成员泛素化,使原本因与AUX/IAA结合而被抑制的ARF得到释放。这几种保守的miRNA在生长素感知和信号传导中起重要作用,miR393下调TIR1和AFB转录物的含量,miR160和miR167通过指导mRNA的切割来下调5种不同的ARF转录物的含量。在适宜的生长条件下,低水平的miR393以及miR160和miR167即可微调转录生长素响应基因所需的ARF水平。在应激期间,miR393的上调表达将TIR1保持在较低的水平,有助于抑制生长素信号传导,从而增加AUX/IAA-ARF异二聚化。此外,miR160和miR167的表达量在应激期间也被上调,它们的上调引起ARF的下调,从而下调ARF介导的基因表达。总的来说,ARF介导的基因表达受到miR393、miR160和miR167的抑制,导致植物生长和胁迫下的发育减弱,促进植物对胁迫的耐受性。
2.1.2miR159与转录因子MYB互作研究
MYB转录因子广泛分布于真核生物中,是植物界最大的转录因子家族之一。MYB蛋白具有高度保守的MYB结构域,其由在N末端的1~4个不完整的串联重复组成。每个MYB重复序列编码3个α-螺旋,其中第2个和第3个螺旋形成螺旋-转角-螺旋结构,识别并结合特定识别位点C/TAACG/TG处的DNA主沟。前人研究证明,MYB转录因子被miR159、miR828和miR858等miRNA靶向,其主要调节植物在各种胁迫条件下的信号转导和发育[14]。Gupta等研究表明,在不同胁迫条件下miR159的表达量有不同的表现,例如在20%聚乙二醇6000渗透胁迫下miR159表达量被显著上调,在盐胁迫和冷胁迫下miR159表达量呈现下调趋势[15],miR159可以通过控制ABI3的表达来调控MYB33转录因子的含量,从而参与ABA信号通路响应干旱[16]。
2.1.3miR156与转录因子SPL互作研究
SPL(SQUAMOSA promoter-binding protein-like)是植物特有的一类转录因子,广泛存在于植物中。最初从金鱼草(Antirrhinum majus)中筛选到2个SPL基因,分别命名为SBP1和SBP2,其因能够识别并结合到SQUAMOSA的启动子上而得名。SPL转录因子是植物发育时间的主要调节因子,由miR156在转录后调节。最近在拟南芥中的一项研究中发现,miR156介导的SPL2和SPL11表达量的下调增强了植物对环境胁迫的反应,包括植物的耐热性[17]。研究发现,通过miR156过表达和SPL13 RNA含量降低能够使紫花苜蓿显示出对热应激耐受性的增加,在热应激下表现为水势升高,非酶抗氧化剂含量、花青素含量和叶绿素丰度增加[18]。miRNA156同时被发现对植物耐盐机制也有作用,在盐处理条件下,miR156过表达基因型中苜蓿中记录到总氮含量的增加和离子稳态的改变;在严重的盐度胁迫下,miR156下调SPL转录因子家族基因的表达量,间接调控其他重要转录因子以及下游盐胁迫应答基因的表达[19]。另有研究表明,miR156通过沉默SPL13减少水分损失和增加气孔导度、增加叶绿素含量和增强光合同化作用,从而达到抗旱的作用[20]。
2.1.4miR164与转录因子NAC互作研究
作为植物中最大的转录因子家族之一,NAC包含复杂的植物特异性超家族,并且存在于多种物种中。NAC的首字母缩写词源自3种最早发现NAC结构域的蛋白质,分别为矮牵牛NAM、拟南芥ATAF1/2和CUC2。NAC被证明在植物应激反应期间在复杂的信号传导网络中发挥重要作用,尤其是在非生物胁迫下,NAC在植物中的表达会发生明显变化[21]。NAC转录因子被miRNA广泛靶向。几项关于拟南芥和水稻的研究已经显示,miR164通过切割NAC mRNA调节植物发育过程,并且能够响应非生物胁迫[22-24]。在水稻中测试了6个miR164靶向NAC基因(OMTN1~OMTN6),结果发现,其中4个参与耐旱性的调控[22]。在胡杨中也发现,miR164指导PeNAC070、PeNAC012和PeNAC028 mRNAs的切割,在干旱和盐胁迫条件下,miR164及其靶基因NAC070在根、叶和茎中的表达情况不同,总体而言增加了植物的抗旱性和耐盐性[25]。孙宗艳在对甜菜抗逆性的研究中发现,甜菜根中的miR164在盐处理12 h时表达量下降剧烈,叶中的miR164表达量在处理12 h 时下降,在处理24 h时呈现上升趋势,随后又下降,在根和叶中的miR164表达量都分别与根和叶中的NAC21/22呈负相关关系[26]。
2.2通过靶向应激相关结构基因抗逆
2.2.1miR398与CSD基因互作研究
逆境会引起植物体内自由基的积累,超氧化物歧化酶(SOD)是一种重要的活性氧(ROS)清除酶,它催化超氧化物自由基向H2O2和O2转化,该反应构成了对氧化应激的第1层细胞防御,植物已经进化出3种具有不同金属配体的SOD,即铁SOD(Fe-SOD)、锰SOD(Mn-SOD)和铜/锌SOD(Cu/Zn-SOD,也称为CSD),其中Cu/Zn-SOD是植物中的主要铜酶。拟南芥基因组编码3种CSD同工酶:细胞质中的CSD1、叶绿体中的CSD2和过氧化物酶体中的CSD3。在拟南芥中,miR398具有4个靶基因,分别为CSD1、CSD2、CCS和COX5b-1。當植物暴露于高光、重金属(Cu2+和Fe3+)或甲基紫精(MV)条件下时,miR398的表达量下调,引起CSD2表达量的上调[27],进而在氧化应激下提高植物性能。在高温胁迫下,miR398表达量呈现上调趋势,在miR398的4个靶标中除了COX5b-1之外,其余3个靶标的表达量都呈现下降趋势,通过定点诱变CSD1、CSD2、CCS而产生的3种miR398特性转基因拟南芥与野生型相比,在37 ℃中对热应激更加敏感,可积累更高水平的超氧化物自由基[28]。
2.2.2miR395与APS基因互作研究
硫元素参与许多生物功能,并且是多种次级代谢物的必需元素,包括硫脂、硫酸葡萄糖胺、谷胱甘肽和辅酶。缺硫环境会严重影响植物的生长,因此,硫营养对植物生长和发育至关重要。植物可从土壤中获得无机硫酸盐形式的硫,从大气中获得二氧化硫和硫化氢气体形式的硫。硫酸盐在同化过程首先由ATP硫酸化酶催化无机硫酸盐和ATP形成腺苷5′-磷酸硫酸盐和无机焦磷酸盐。随后,腺苷5′磷酸硫酸盐被2种不同的硫酸盐同化途径利用。前人对拟南芥中的4种ATP硫酸化酶编码基因(APS基因)进行定量分析,结果发现,miR395靶向APS基因,在硫酸盐限制期间,3种APS基因在转录后水平受miR395调节,miR395过表达植物中的硫酸盐浓度增加[29-30]。更有研究证明,硫酸盐浓度与miR395的丰度呈正相关关系,即miR395水平升高导致硫酸盐浓度增加,而miR395丰度的下调导致硫酸盐浓度降低。相应地,miR395靶向的APS基因的过表达导致硫酸盐浓度的下降[31]。有研究在镉胁迫下鉴定了过表达miR395的转基因油菜,结果表明,过表达miR395的植物表现出比野生型更低程度的镉诱导氧化应激,相比之下,转化体中的叶绿素、谷胱甘肽和非蛋白质硫醇含量高于野生型[32]。
3展望
非生物脅迫对植物生长发育影响很大[33],植物进化出了一套复杂的调控机制来应对不良环境。非生物胁迫诱导miRNA的异常表达,miRNA位于调节植物对非生物胁迫反应的基因网络中心,使得miRNA成为改良农作物遗传性状的重要新靶标,包括植物对环境胁迫的反应。前人研究已经确定,miRNA的调控是通过与靶基因完全或不完全结合的方式来完全降解靶基因或抑制靶基因的翻译过程,进而起到对靶基因不同程度的抑制作用。前人鉴定了多种植物中的miRNA,并且研究了各个miRNA的靶基因以及在不同胁迫下miRNA和其靶基因的表达量变化,分析其在植物抗逆中的作用。但总的来说,对于miRNA的研究大多数还是以不同物种中miRNA的鉴定为主,对于其在整体逆境调控网络中作用的研究较少,根据现有的研究可以总结出,植物中的miRNA既有靶向应激相关转录因子的,也有靶向应激相关结构基因的,最终使植物在生理生化上作出应对胁迫的改变。今后应当加强对调控网络的研究,更深入地探讨miRNA在抗逆调控网络的功能,进而更好地指导农作物的改良,增加作物产量,优化作物质量。
参考文献:
[1]Lee R C,Feinbaum R L,Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J]. Cell,1993,75(5):843-854.
[2]Kurihara Y,Watanabe Y. Arabidopsis micro-RNA biogenesis through Dicer-like 1 protein functions[J]. Proceedings of the National Academy of Sciences,2004,101(34):12753-12758.
[3]Hck J,Meister G. The Argonaute protein family[J]. Genome Biology,2008,9(2):210.
[4]Kumar R. Role of microRNAs in biotic and abiotic stress responses in crop plants[J]. Applied Biochemistry & Biotechnology,2014,174(1):93-115.
[5]Wang J W,Czech B,Weigel D. miR156-regulated SPL transcription factors define an endogenous flowering pathway in Arabidopsis thaliana[J]. Cell,2009,138(4):738-749.
[6]Palatnik J F,Wollmann H,Schommer C,et al. Sequence and expression differences underlie functional specialization of Arabidopsis microRNAs miR159 and miR319[J]. Developmental Cell,2007,13(1):115-125.
[7]Rodriguez R E,Mecchia M A,Debemardi J M,et al. Control of cell proliferation in Arabidopsis thaliana by microRNA miR396[J]. Development,2010,137(1):103-112.
[8]Imagawa M,Sakaue R,Tanabe A,et al. Two nuclear localization signals are required for nuclear translocation of nuclear factor 1-A[J]. FEBS Letters,2000,484(2):118-124.
[9]Huang J,Li Z Y,Zhao D Z. Deregulation of the OsmiR160 target gene OsARF18 causes growth and developmental defects with an alteration of auxin signaling in rice[J]. Scientific Reports,2016,6:29938.
[10]Glazińska P,Wojciechowski W,Wilmowicz E,et al. The involvement of InMIR167 in the regulation of expression of its target gene InARF8,and their participation in the vegetative and generative development of Ipomoea nil plants[J]. Journal of Plant Physiology,2014,171(3/4):225-234.
[11]Iglesias M J,Terrile M C,Windels D,et al. MiR393 regulation of auxin signaling and redox-related components during acclimation to salinity in Arabidopsis[J]. PLoS One,2014,9(9):e107678.
[12]Lin Y L,Lai Z X,Tian Q L,et al. Endogenous target mimics down-regulate miR160 mediation of ARF10,-16,and-17 cleavage during somatic embryogenesis in Dimocarpus longan Lour[J]. Frontiers in Plant Science,2015,6:956.
[13]Sunkar R,Li Y F,Jagadeeswaran G. Functions of microRNAs in plant stress responses[J]. Trends in Plant Science,2012,17(4):196-203.
[14]Sun G L. MicroRNAs and their diverse functions in plants[J]. Plant Molecular Biology,2012,80(1):17-36.
[15]Gupta O P,Meena N L,Sharma I,et al. Differential regulation of microRNAs in response to osmotic,salt and cold stresses in wheat[J]. Molecular Biology Reports,2014,41(7):4623-4629.
[16]Lopez-Molina L,Mongrand S,McLachlin D T,et al. ABI5 acts downstream of ABI3 to execute an ABA-dependent growth arrest during germination[J]. Plant Journal,2002,32(3):317-328.
[17]Matthews C,Arshad M,Hannoufa A. Alfalfa response to heat stress is modulated by microRNA156[J]. Physiologia Plantarum,2018,165(4):830-842.
[18]Arshad M,Gruber M Y,Wall K,et al. An insight into microRNA156 role in salinity stress responses of alfalfa[J]. Frontiers in Plant Science,2017,8:356.
[19]Arshad M,Feyissa B A,Amyot L,et al. MicroRNA156 improves drought stress tolerance in alfalfa (Medicago sativa) by silencing SPL13[J]. Plant Science,2017,258:122-136.
[20]Le D T,Nishiyama R,Watanabe Y,et al. Genome-wide survey and expression analysis of the plant-specific NAC transcription factor family in soybean during development and dehydration stress[J]. DNA Research,2011,18(4):263-276.
[21]Huang H,Wang Y,Wang S L,et al. Transcriptome-wide survey and expression analysis of stress-responsive NAC genes in Chrysanthemum lavandulifolium[J]. Plant Science,2012,193-194:18-27.
[22]Fang Y,Xie K,Xiong L. Conserved miR164-targeted NAC genes negatively regulate drought resistance in rice[J]. Journal of Experimental Botany,2014,65(8):2119-2135.
[23]Guo H S,Xie Q,Fei J F,et al. MicroRNA164 directs NAC1 mRNA cleavage of the transcription factor NAC1 to downregulate auxin signals for Arabidopsis lateral root development[J]. Plant Cell,2005,17:1376-1386.
[24]Nakashima K,Takasaki H,Mizoi J,et al. NAC transcription factors in plant abiotic stress responses[J]. Biochimica et Biophysica Acta(Gene Regulatory Mechanisms),2012,1819(2):97-103.
[25]Lu X,Dun H,Lian C L,et al. The role of peu-miR164 and its target PeNAC genes in response to abiotic stress in Populus euphratica[J]. Plant Physiology and Biochemistry,2017,115:418-438.
[26]孙宗艳. 盐/干旱胁迫下甜菜幼苗中miR160/164及其靶基因的表达与分析[D]. 哈尔滨:哈尔滨工业大学,2017.
[27]Sunkar R,Kapoor A,Zhu J K. Posttranscriptional induction of two Cu/Zn superoxide dismutase genes in Arabidopsis is mediated by downregulation of miR398 and important for oxidative stress tolerance[J]. Plant Cell,2006,18(8):2051-2065.
[28]Guan Q M,Lu X Y,Zeng H T,et al. Heat stress induction of miR398 triggers a regulatory loop that is critical for thermotolerance in Arabidopsis[J]. Plant Journal,2013,74(5):840-851.
[29]Kawashima C G,Yoshimoto N,Maruyama-Nakashita A,et al. Sulphur starvation induces the expression of microRNA-395 and one of its target genes but in different cell types[J]. Plant Journal,2009,57(2):313-321.
[30]Liang G,Yang F X,Yu D Q. MicroRNA395 mediates regulation of sulfate accumulation and allocation in Arabidopsis thaliana[J]. Plant Journal,2010,62(6):1046-1057.
[31]Ai Q,Liang G,Zhang H M,et al. Control of sulfate concentration by miR395-targeted APS genes in Arabidopsis thaliana[J]. Plant Diversity,2016,38(2):92-100.
[32]Zhang L W,Song J B,Shu X X,et al. miR395 is involved in detoxification of cadmium in Brassica napus[J]. Journal of Hazardous Materials,2013,250-251:204-211.
[33]李曉刚,李慧,杨青松,等. 杜梨bHLH转录因子家族两成员的序列特征及对非生物胁迫的转录响应[J]. 江苏农业科学,2017,45(22):40-45.
