植物病毒混合侵染研究进展
2019-01-03贺振甘海峰陈雯
贺振 甘海峰 陈雯
摘要:混合侵染是病毒为害作物时存在的一种普遍现象,给农业生产带来严重威胁,并常造成重大的经济损失。目前,已报道了多种病毒混合侵染的相关研究。本文综述了近年来对植物病毒混合侵染现象以及内在机制的研究现状,从基因沉默抑制子、小RNA、进化博弈等方面探讨了影响植物病毒混合侵染的因素,以期为病毒病害的有效防控提供依据。
关键词:植物病毒;混合侵染;基因沉默抑制子;进化博弈
中图分类号: S432.4+1文献标志码: A
文章编号:1002-1302(2019)21-0060-03
收稿日期:2018-07-26
基金项目:国家自然科学基金(编号:31601604);中央本级重大增减支项目(编号:2060302);云南省甘蔗遗传改良重点实验室开放课题(编号:2018DG018-1);农业农村部热带作物生物学与遗传资源利用重点实验室开放课题(编号:1630052019001)。
作者简介:贺振(1987—),男,山东临沂人,博士,副教授,研究方向为植物病毒学。E-mail:hezhen@yzu.edu.cn。
在农业生态系统中,2种或者2种以上病毒混合侵染作物发生普遍[1],给农业生产带来严重威胁,并常造成重大的经济损失[2-4]。病毒混合侵染能够引起病害症状加剧[5-7],改变病毒的寄主范围[8]、介体传播效率[9-10]、细胞定位[11]以及浓度[4,10,12-13]等性状特征。因此,对于植物病毒混合侵染的研究显得尤为重要,探索解析植物病毒混合侵染,对于揭示病毒病害流行規律和制定防控策略具有十分重要的意义。本文从植物病毒混合侵染的现象与类型、作用机制以及进化博弈论在病毒混合侵染中的应用3个方面进行综述。
1植物病毒的混合侵染
1.1植物病毒混合侵染现象
马铃薯Y病毒(potato virus Y,PVY)和马铃薯X病毒(potato virus X,PVX)混合侵染烟草(Nicotiana tabacum),是病毒混合侵染的经典案例[14]。PVX是马铃薯X病毒属(Potexvirus)的典型成员,单独侵染烟草时,产生温和的花叶症状,而与PVY等马铃薯Y病毒属(Potyvirus)成员混合侵染时,症状明显加剧,PVX的累积量比单独侵染时提高了10倍[15]。近年来,报道了大量的病毒混合侵染引起作物严重损失的研究,尤其是马铃薯Y病毒科(Potyviridae)病毒与其他种类病毒混合侵染类型,如芜菁花叶病毒(turnip mosaic virus,TuMV)与花椰菜花叶病毒(cauliflower mosaic virus,CaMV)混合侵染拟南芥(Arabidopsis thaliana)时,TuMV粒体含量的积累增加,而CaMV的浓度降低,与单独侵染相比,混合侵染时症状变化不明显[12];TuMV与莴苣侵染性黄花病毒(Lettuce infectious yellows virus,LIYV)混合侵染本生烟(Nicotiana benthamiana)时,症状明显加剧,LIYV在寄主中的浓度显著增加,而TuMV浓度的变化不大[16];小麦线条花叶病毒(wheat streak mosaic virus,WSMV)与麦类花叶病毒(triticum mosaic virus,TriMV)混合侵染小麦时,在感病品种(Arapahoe和Tomahawk)中,症状表现加剧,2种病毒的浓度均增加,而在低温抗病品种(Mace)中,症状表现不明显,病毒浓度变化也不显著[4]。引起甘蔗花叶病的甘蔗花叶病毒(sugarcane mosaic virus,SCMV)、高粱花叶病毒(sorghum mosaic virus,SrMV)和甘蔗线条花叶病毒(sugarcane streak mosaic virus,SCSMV)存在广泛的混合侵染现象[17-18],如在印度蔗区,SCSMV与SCMV混合侵染现象普遍[19-20];而在我国云南蔗区和国家甘蔗种质资源圃内,SrMV与SCSMV混合侵染现象普遍,也存在3种病毒同时混合侵染的现象[21-24]。
1.2植物病毒混合侵染类型
通常混合侵染包括2种途径:协同侵染(co-infection)和重叠侵染(super-infection)[25-26]。协同侵染是指2个或者更多病毒同时或者在短时间内侵染同一寄主;重叠侵染是指不同的病毒或者病毒株系在不同的时间侵染同一寄主[3]。在混合侵染中,2种病毒或者同种病毒的2个不同株系间的互作方式多种多样,一般可分为2种类型:拮抗作用和协生作用[3]。拮抗作用是指同种病毒的不同株系先后侵染某寄主时,先侵染病毒株系能够抑制或者降低后侵染的病毒株系[27-28]。混合侵染同种寄主时,病毒间的拮抗作用可以表现为互斥(mutual exclusion)或者交叉保护(cross-protection)[3-5]。协生作用是指2种病毒混合侵染时,利于2种病毒或者至少其中1种病毒在寄主体内复制增殖、浓度积累,通常能够引起寄主植物表现出比2种病毒症状的简单叠加效应更严重的症状表现[3-4,8-9,11,14,16]。在自然界中,协生作用在介体传播(vector-brone)的病毒间尤为常见,一般表现为一种病毒的存在利于另外一种病毒的介体传播[3,10,29-30]。病毒间的协生作用与寄主种类[9,31-32]、寄主品种[4]密切相关,相同2种病毒混合侵染不同寄主时,2种病毒间的互作关系可能截然不同。
2混合侵染的互作机制研究进展
2.1经RNA沉默抑制子互作
在病毒与寄主植物长期的进化过程中,寄主植物为应对病毒侵染,在细胞、组织和植株整体水平上形成了多种不同的防御机制。其中,基因沉默(gene silencing)是植物最重要的抗病毒防卫机制之一[33]。与之对应的,病毒通过编码多种毒力因子,以抑制基因沉默[34-35],从而侵染寄主,建立侵染循环完成其生活史。病毒编码的这种不同类型的、具有沉默抑制效应的毒力因子,被称作RNA沉默抑制子(RNA silencing suppressors,RSSs)[36]。目前研究人员认为,病毒间协同侵染效应的机制,主要通过病毒编码的RSSs来完成[6,14,29,37]。
基因沉默的途径包含几个过程,目前的研究证明不同种类病毒混合侵染时编码的RSSs可以分别特异性结合基因沉默的不同过程。在马铃薯Y病毒属病毒与其他病毒混合侵染发生时,由马铃薯Y病毒属病毒编码的辅助成分蛋白酶(helper component-proteinase,HC-Pro)具有抑制转录后基因沉默的功能(posttranscriptional gene silencing,PTGS)[29,38]。除了抑制PTGS,TuMV编码的HC-Pro还能够干扰micro-RNA(miRNA)介导的mRNA剪辑[39]。不同马铃薯Y病毒属病毒编码的HC-Pro抑制基因沉默的效果不同,相较于TuMV和三叶草黄脉病毒(clover yellow vein virus,ClYVV)编码的HC-Pro,PVY编码的HC-Pro能够更有效地增加CMV的浓度[40]。除了HC-Pro具有RSSs功能外,最近的研究发现,在禾本科花叶病毒属(Poacevirus)的典型种TriMV中,P1蛋白作为RSSs抑制基因沉默。在WSMV与TriMV混合侵染小麦时,TriMV的P1蛋白具有抑制基因沉默的作用;与PVX混合侵染本生烟时,P1蛋白也能够促进PVX含量的积累[6,13,37]。
2.2经病毒介体传播互作
混合侵染的协同效应除了通过病毒编码的RSSs外,还与病毒的介体传播过程相关。幽影病毒属(Umbravirus)病毒与黄症病毒科(Luteoviridae)病毒的混合侵染过程清晰地揭示了这一机制[30]。幽影病毒属病毒缺乏编码外壳蛋白的遺传信息,单独侵染时无法通过蚜虫传播,与黄症病毒科病毒混合侵染时,黄症病毒科病毒作为一种辅助病毒能够编码外壳蛋白,并包被幽影病毒属病毒的基因组,进而可被蚜虫获取传播[3,30]。在撒哈拉以南的非洲地区,花生丛簇病是花生上的一种毁灭性病害,该病害由幽影病毒属的花生丛簇病毒(groundnut rosette virus,GRV)和其属于黄症病毒科的辅助病毒花生丛簇相关病毒(groundnut rosette assistor virus,GRAV)以及GRV的卫星RNA(satRNA)构成的病原复合体引起。GRV和GRAV在花生植株中独立地复制,并进行细胞间转运和植株体内的长距离运输,satRNA的复制依赖于GRV的RNA基因组。自然条件下,只有这3个病毒因子同时侵染花生时,才能引起严重症状。GRV及其satRNA经GRAV编码的外壳蛋白包被,然后通过蚜虫进行传播[3,30]。另外一种形式的病毒协同介体传播机制由马铃薯Y病毒属编码的HC-Pro蛋白完成[29,41]。马铃薯Y病毒属病毒编码的HC-Pro蛋白能够作为一个桥梁,一侧结合病毒粒体,一侧结合蚜虫口针内表皮,从而达到蚜传的目的。在混合侵染中,一个病毒编码的HC-Pro能够促进另外一种HC-Pro缺陷型病毒或者非相关病毒的蚜虫传播[3,42]。
2.3经病毒sRNA互作
近年来,随着高通量技术的发展,在小RNA(small RNA,sRNA)水平上探讨病毒混合侵染的机制成为可能。Tatineni等通过对WSMV与TriMV混合侵染的小麦的高通量测序结果发现,在混合侵染的植株体内,积累了大量的由病毒产生的小RNA分子(virus-derived small interfering RNAs,vsiRNA)[13]。这一结果证明,混合侵染过程中产生的沉默抑制子并不能抑制vsiRNA的形成,即WSMV与TriMV的协同效应与vsiRNA介导的基因沉默无关。Xia等发现,玉米褪绿斑驳病毒(maize chlorotic mottle virus,MCMV)和SCMV协同侵染玉米时,感病玉米植株内来源于MCMV的vsiRNA显著增加,且玉米植株DCLs和AGOs RNAs的含量与vsiRNA的量具有一定的相关关系[43],首次从vsiRNA的角度阐述了MCMV和SCMV协同侵染的致病机制。
3进化博弈论在病毒混合侵染中的应用
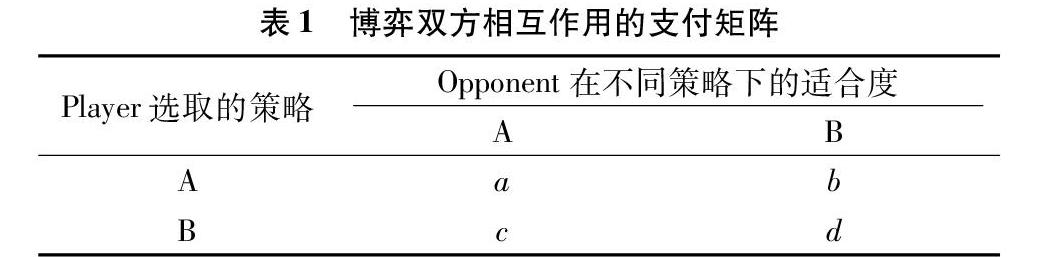
在混合侵染的2种病毒中,其中任一病毒种群都能够改变寄主的微环境,成为另外一种病毒种群的适合度景观(the fitness landscape)因素[5,12]。因此,在混合侵染中,任一病毒成功侵染寄主不仅需要该病毒与寄主植物的相互适应,还取决于该病毒与其共侵染病毒的互作机制[5,12]。病毒混合侵染的现象符合生物演化博弈理论的模型,能够根据博弈理论在数学框架内进行分析[44-45]。在演化博弈理论框架下,病毒选择的演化策略由其遗传特征决定,病毒的适合度(fitness)则表现为演化博弈的收益(payoff),收益取决于2种病毒所选策略的相互作用。表1中显示了博弈双方(Player与Opponent),在它们选取的策略(A与B)相互作用下的支付矩阵。在该表中,a、b、c与d代表博弈双方分别选择不同策略时的适合度,比如Player A与Opponent A互作时,Player A的适合度为a,而与Opponent B互作时,Player A的适合度为b;类似地,Player B分别与Opponent A和B互作时,适合度分别为c与d。在一个群体中,当其成员进行随机配对博弈时,可能会产生4种结果:当a>c且b>d时,Player A主导博弈过程;反之,当a
病毒混合侵染現象是解释进化博弈理论的天然模型,而通过进化博弈理论研究病毒的混合侵染对揭示病毒互作机制、探索寄主种类、寄主生长发育期对混合侵染病毒进化过程的影响以及推测混合侵染病毒的进化方向具有十分重要的意义。
参考文献:
[1]Hull R. Matthews plant virology[M]. New York:Academic Press,2014:184-188.
[2]Mukasa S B,Rubaihayo P R,Valkonen J P T. Interactions between a crinivirus,an ipomovirus and a potyvirus in coinfected sweetpotato plants[J]. Plant Pathology,2006,55(3):458-467.
[3]Syller J. Facilitative and antagonistic interactions between plant viruses in mixed infections[J]. Molecular Plant Pathology,2012,13(2):204-216.
[4]Tatineni S,Graybosch R A,Hein G L,et al. Wheat cultivar-specific disease synergism and alteration of virus accumulation during co-infection with wheat streak mosaic virus and triticum mosaic virus[J]. Phytopathology,2010,100(3):230-238.
[5]Elena S F,Bernet G P,Carrasco J L. The games plant viruses play[J]. Current Opinion in Virology,2014(8):62-67.
[6]Tatineni S,Qu F,Li R H,et al. Triticum mosaic poacevirus enlists P1 rather than HC-Pro to suppress RNA silencing-mediated host defense[J]. Virology,2012,433(1):104-115.
[7]Chen Z,Tan J Y,Wen Y,et al. A game-theoretic model of interactions between Hibiscus latent singapore virus and tobacco mosaic virus[J]. PLoS One,2012,7(5):e37007.
[8]García-Cano E,Resende R O,Fernández-Muoz R,et al. Synergistic interaction between tomato chlorosis virus and tomato spotted wilt virus results in breakdown of resistance in tomato[J]. Phytopathology,2006,96(11):1263-1269.
[9]Wintermantel W M,Cortez A A,Anchieta A G,et al. Co-infection by two criniviruses alters accumulation of each virus in a host-specific manner and influences efficiency of virus transmission[J]. Phytopathology,2008,98(12):1340-1345.
[10]Salvaudon L,de Moraes C M,Mescher M C. Outcomes of co-infection by two potyviruses:implications for the evolution of manipulative strategies[J]. Proceedings of the Royal Society B(Biological Sciences),2013,280(1756):2012-2959.
[11]Wege C,Siegmund D. Synergism of a DNA and an RNA virus:enhanced tissue infiltration of the begomovirus abutilon mosaic virus (AbMV) mediated by cucumber mosaic virus (CMV)[J]. Virology,2007,357(1):10-28.
[12]Martín S,Elena S F. Application of game theory to the interaction between plant viruses during mixed infections[J]. Journal of General Virology,2009,90(11):2815-2820.
[13]Tatineni S,Riethoven J J M,Graybosch R A,et al. Dynamics of small RNA profiles of virus and host origin in wheat cultivars synergistically infected by wheat streak mosaic virus and triticum mosaic virus.Virus infection caused a drastic shift in the endogenous small RNA profile[J]. PLoS One,2014,9(11):e111577.
[14]Pruss G,Ge X,Shi X M,et al. Plant viral synergism:the potyviral genome encodes a broad-range pathogenicity enhancer that transactivates replication of heterologous viruses[J]. Plant Cell,1997,9(6):859-868.
[15]Bance V B. Replication of potato virus X RNA is altered in coinfections with potato virus Y[J]. Virology,1991,182(2):486-494.
[16]Wang J,Turina M,Medina V,et al. Synergistic interaction between the Potyvirus,Turnip mosaic virus and the crinivirus,lettuce infectious yellows virus in plants and protoplasts[J]. Virus Research,2009,144(1/2):163-170.
[17]Perera M F,Filippone M P,Ramallo C J,et al. Genetic diversity among viruses associated with sugarcane mosaic disease in Tucumán,Argentina[J]. Phytopathology,2009,99(1):38-49.
[18]Xu D L,Park J W,Mirkov T E,et al. Viruses causing mosaic disease in sugarcane and their genetic diversity in southern China[J]. Archive of Virology,2008,153:1031-1039.
[19]Parameswari B,Bagyalakshmi K,Viswanathan R,et al. Molecular characterization of Indian sugarcane streak mosaic virus isolate[J]. Virus Genes,2013,46(1):186-189.
[20]Bagyalakshmi K,Parameswari B,Chinnaraja C,et al. Genetic variability and potential recombination events in the HC-Pro gene of sugarcane streak mosaic virus[J]. Archives of Virology,2012,157(7):1371-1375.
[21]He Z,Yasaka R,Li W F,et al. Genetic structure of populations of sugarcane streak mosaic virus in China:comparison with the populations in India[J]. Virus Research,2016,211:103-116.
[22]He Z,Li W F,Yasaka R,et al. Molecular variability of sugarcane streak mosaic virus in China based on an analysis of the P1 and CP protein coding regions[J]. Archives of Virology,2014,159(5):1149-1154.
[23]賀振,李文凤,李世访. 云南蔗区甘蔗线条花叶病毒分离物NIa基因形成新簇[J]. 微生物学报,2016,56(11):1802-1810.
[24]Li W F,He Z,Li S F,et al. Molecular characterization of a new strain of sugarcane streak mosaic virus (SCSMV)[J]. Archives of Virology,2011,156:2101-2104.
[25]Miralles R,Ferrer R,Solé R V,et al. Multiple infection dynamics has pronounced effects on the fitness of RNA viruses[J]. Journal of Evolutionary Biology,2001,14(4):654-662.
[26]Saldaa J,Elena S F,Solé R V. Coinfection and superinfection in RNA virus populations:a selection-mutation model[J]. Mathematical Biosciences,2003,183(2):135-160.
[27]Ziebell H,Carr J P. Cross-protection:a century of mystery[J]. Advances in Virus Research,2010,76:211-264.
[28]Folimonova S Y,Robertson C J,Shilts T,et al. Infection with strains of Citrus tristeza virus does not exclude superinfection by other strains of the virus[J]. Journal of Virology,2010,84(3):1314-1325.
[29]Syller J. The roles and mechanisms of helper component proteins encoded by potyviruses and caulimoviruses[J]. Physiological and Molecular Plant Pathology,2005,67(3/4/5):119-130.
[30]Syller J. Molecular and biological features of umbraviruses,the unusual plant viruses lacking genetic information for a capsid protein[J]. Physiological and Molecular Plant Pathology,2003,63(1):35-46.
[31]González-Jara P,Tenllado F,Martínez-García B,et al. Host-dependent differences during synergistic infection by potyviruses with potato virus X[J]. Molecular Plant Pathology,2004,5(1):29-35.
[32]González-Jara P,Atencio F A,Martínez-García B,et al. A single amino acid mutation in the plum pox virus helper component-proteinase gene abolishes both synergistic and RNA silencing suppression activities[J]. Phytopathology,2005,95(8):894-901.
[33]Wang M B,Metzlaff M. RNA silencing and antiviral defense in plants[J]. Current Opinion in Plant Biology,2005,8(2):216-222.
[34]Voinnet O. Induction and suppression of RNA silencing:insights from viral infections[J]. Nature Reviews Genetics,2005,6:206-220.
[35]Ding S W. RNA-based antiviral immunity[J]. Nature Reviews Immunology,2010,10(9):632-644.
[36]Ding S W,Voinnet O. Antiviral immunity directed by small RNAs[J]. Cell,2007,130(3):413-426.
[37]Young B A,Stenger D C,Qu F,et al. Tritimovirus P1 functions as a suppressor of RNA silencing and an enhancer of disease symptoms[J]. Virus Research,2012,163(2):672-677.
[38]Urcuqui-Inchima S,Haenni A L,Bernardi F. Potyvirus proteins:a wealth of functions[J]. Virus Research,2001,74(1/2):157-175.
[39]Kasschau K D,Xie Z X,Allen E,et al. P1/HC-Pro,a viral vuppressor of RNA silencing,interferes with Arabidopsis development and miRNA function[J]. Developmental Cell,2003,4(2):205-217.
[40]Fukuzawa N,Itchoda N,Ishihara T,et al. HC-Pro,a potyvirus RNA silencing suppressor,cancels cycling of cucumber mosaic virus in Nicotiana benthamiana plants[J]. Virus Genes,2010,40(3):440-446.
[41]Brault V,Uzest M,Monsion B,et al. Aphids as transport devices for plant viruses[J]. Comptes Rendus Biologies,2010,333(6/7):524-538.
[42]Manoussopoulos I N. Acquisition and retention of potato virus Y helper component in thetransmission of potato aucuba mosaic virus by aphids[J]. Journal of Phytopathology,2001,149(2):103-106.
[43]Xia Z,Zhao Z,Chen L,et al. Synergistic infection of two viruses MCMV and SCMV increases the accumulations of both MCMV and MCMV-derived siRNAs in maize[J]. Scientific Reports,2016,6:20520.
[44]Nowak M A. Five rules for the evolution of cooperation[J]. Science,2006,314(5805):1560-1563.
[45]Nowak M A,Sigmund K. Evolutionary dynamics of biological games[J]. Science,2004,303(5659):793-799.
