难溶电解质溶解平衡几类计算的解题技巧
2018-12-06内蒙古赵亚兵
内蒙古 赵亚兵
难溶电解质溶解平衡内容是人教版选修4《化学反应原理》第三章第四节内容。该内容节选于大学无机化学沉淀平衡章节部分,学生学起来较难掌握。纵观近几年高考各地试卷中无论是选择题还是综合性实验题、工艺流程题中都或多或少地出现了这几类题型。其实只需要掌握这几种类型题的解题技巧,就可以让考生举一反三、轻松应对。
第一部分 知识梳理
这类题的特点是题干中有效信息有物质的化学式及对应物质的Ksp。这类题可以从两方面进行考查:1.考查该难溶电解质饱和溶液某离子浓度的求算;2.比较几种难溶电解质在水中溶解性大小。
针对这两个问题先进行物质的分类,并对公式进行推导求算即可。
第一种组成:MA型(如AgCl、BaSO4等)
假设:MA饱和溶液中溶解出的M+浓度为amol/L,已知Ksp(MA),根据:

aa
第二种组成:MA2型[如Mg(OH)2、Cu(OH)2等]
假设:MA2饱和溶液中溶解出的M2+浓度为amol/L 。已知Ksp(MA2),根据:

第三种组成:MA3型[如Fe(OH)3等]
假设:MA3饱和溶液中溶解出的M3+浓度为amol/L,已知Ksp(MA3),根据:

其余类型仿照上述推导过程即可。
第二部分 题型应用
题型一:已知Ksp比较饱和溶液中某一离子浓度大小
例1.已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中Ag+浓度大小顺序正确的是
( )
A.AgCl>AgI>Ag2CrO4B.AgCl>Ag2CrO4>AgI
C.Ag2CrO4>AgCl>AgI D.Ag2CrO4>AgI>AgCl

答案:C
小结:在难溶盐的饱和溶液中某一离子浓度大小比较时,同种组成的类型直接比较Ksp。不同组成的类型相差非常大时也可以直接比较,相差不大时需要进行计算再比较。
题型二:已知物质的Ksp以及该物质溶解出某一离子的浓度,求另一离子浓度
这类题特点是已知Ksp与某一离子浓度,求未知离子浓度,只需按照浓度积常数表达式进行计算即可。计算时需要注意某离子浓度是否需要平方或者是立方甚至是更高次方。
例2.已知Cu(OH)2难溶于水,且Ksp[Cu(OH)2]=2.0×10-20。某硫酸铜溶液中c(Cu2+)=0.02 mol/L。如果生成Cu(OH)2沉淀,此时OH-的浓度为_____________。
分析:本题主要考查溶度积常数定义式的应用,已知条件有Ksp[Cu(OH)2]=2.0×10-20、c(Cu2+)。直接利用定义式进行计算即可。

答案:1.0×10-9mol/L
小结:注意此类题容易与题型一的方法混淆。所以解此类题目时要注意题型一已知条件只有Ksp。第二种题型已知条件除了Ksp之外还有另外一种离子浓度。
题型三:判断两种溶液混合后是否有沉淀产生
这类题特点是告诉两种溶液的浓度(物质的量与体积),判断当它们相互混合时是否产生沉淀。只需要利用浓度商Qc与Ksp大小进行比较即可。而浓度商的代数表达式与Ksp的表达式相同。只要Qc>Ksp时溶液必有沉淀产生。
例3.常温下,Ksp(CH3COOAg)=2.3×10-3,将浓度均为0.2 mol/L的硝酸银溶液与醋酸钠溶液等体积混合是否会有沉淀产生?
分析:本题主要判断Qc与Ksp大小。如果Qc>Ksp有沉淀,反之没有沉淀。
Qc=c(Ag+)·c(CH3COO-)=0.1×0.1=0.01>2.3×10-3,所以有CH3COOAg沉淀产生。
小结:在此类题中一定要注意等体积溶液混合后浓度减半的情况。
题型四:判断离子在某特定条件下是否沉淀完全
这类题型在化工流程题中经常出现,通常是以小问的形式出现。若要离子完全沉淀一般情况下该离子浓度小于1.0×10-5mol/L即可。但是需要注意的是,这类题看似已知条件只有Ksp。容易按照题型一去解决。但是隐含的条件是某一离子浓度小于1.0×10-5mol/L。所以求出的值为下限值。另外本类型还可以这样设问,求该离子沉淀完全时的最小pH。解法相同。
例4.常温下,已知Ksp[Mg(OH)2]=1.0×10-11。在含有Mg2+的溶液中,要使Mg2+完全转化为Mg(OH)2沉淀,需要溶液pH控制在 以上。
分析:本题主要考查浓度积表达式与pH的计算。题目中的隐含条件是c(Mg2+)<1.0×10-5mol/L。可以令c(Mg2+)=1.0×10-5mol/L。根据浓度积表达式求出c(OH-),进一步求出c(H+),最后求出pH。
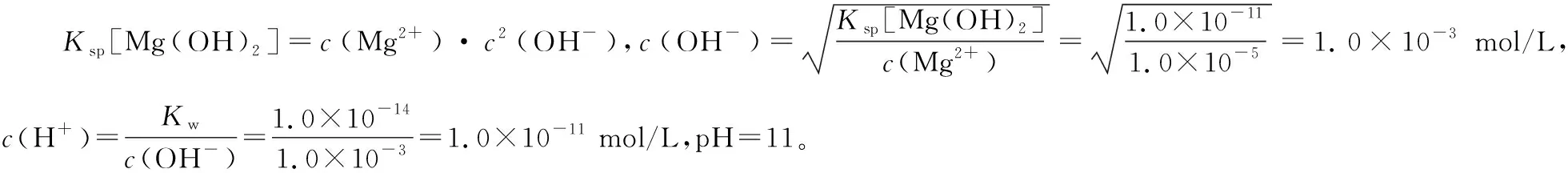
答案:11
小结:解答此类计算题时一定要抓住隐含条件某离子浓度小于1.0×10-5mol/L时可以认为该离子已经沉淀完全。如果计算该离子开始沉淀时pH可以按照题型二计算。
题型五:沉淀转化的计算
沉淀转化的方法有多种,如:酸碱溶解法、配位溶解法、氧化还原溶解法、沉淀转化溶解法等。而计算类型中主要以沉淀转化溶解法为主。原则上是溶解性小的沉淀转化为溶解性更小的沉淀容易转化。即同种组成类型Ksp大的转化Ksp小的容易实现。但是这里还有一种特殊的情况,同种组成类型Ksp小的在一定条件下也可以转化为Ksp大的。
例5.沉淀转化在生产中也有重要应用,如用Na2CO3溶液可以将锅炉水垢中的CaSO4转化为较为疏松而易清除的CaCO3,该沉淀转化达到平衡时,其平衡常数为K= (写数值)。
[已知:Ksp(CaSO4)=9.1×10-6,Ksp(CaCO3)=2.8×10-9]
分析:本题考查沉淀的转化。看似已知数据只有Ksp数值,但是不能按照题型一进行计算,需要写出平衡转化方程式,并且列出平衡常数表达式。适当地进行公式的转化来求算。
答案:3.25×103

