中国乳腺癌患者BRCA1/2基因检测与临床应用专家共识(2018年版)
2018-11-19中国医师协会精准治疗委员会乳腺癌专业委员会
中国医师协会精准治疗委员会乳腺癌专业委员会
中华医学会肿瘤学分会乳腺肿瘤学组
中国抗癌协会乳腺癌专业委员会
基于当前对乳腺癌易感基因(breast cancer gene 1,BRCA1)和乳腺癌易感基因2(breast cancer gene 2,BRCA2)在乳腺癌中发病、预防、治疗及预后认识的深化、检测技术的成熟以及新靶向药物的应用,中国医师协会精准治疗委员会乳腺癌专专业委员、中华医学会肿瘤学分会乳腺肿瘤学组及中国抗癌协会乳腺癌专业委员会参考美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)《遗传/家族性高风险评估:乳腺癌与卵巢癌(2018年第1版)》、欧洲临床肿瘤学会(European Society for Medical Oncology,ESMO)《乳腺癌BRCA基因筛查ESMO临床实践指南(2011年版)》及美国乳腺外科医师协会(American Society of Breast Surgeons,ASBS)《乳腺癌患者遗传基因检测指南(2016年版)》等指南以及近10年来发表的重要参考文献(包括中国人群的相关研究),结合我国部分肿瘤中心的数据和临床经验,在专家组讨论与投票的基础上,形成本共识。
1 BRCA1/2基因突变的临床意义
乳腺癌是中国女性最常见的恶性肿瘤,居癌症相关死因的第5位,年龄标化发病率为30.69/10万[1]。中国人群乳腺癌诊断时年龄主要集中在45~55岁[2-4],而美国81%的乳腺癌患者年龄大于50岁,平均诊断年龄为62岁,中国乳腺癌患者总体患病年龄比欧美女性更低[5]。研究表明,5%~10%的乳腺癌患者具有明确的遗传基因突变,称之为遗传性乳腺癌(hereditary breast cancer,HBC)[6-7],其中BRCA1/2基因突变占15%[8-10],其他主要易感基因有TP53、CDH1、LKB1、PTEN、CHEK2、ATM和PALB2等[8]。
BRCA1和BRCA2均属肿瘤抑制基因,分别于1990年与1994年被鉴定出来[11-12]。其中BRCA1位于人类染色体17q21上,含有23个外显子,编码由1 863个氨基酸残基构成的蛋白质[11];而BRCA2位于人类染色体13q12上,含有27个外显子,编码由3 418个氨基酸残基构成的蛋白质[12]。BRCA1/2编码的蛋白作用于多种细胞生命活动过程,包括DNA损伤修复、基因转录调控和细胞周期调节等[13-15]。
1.1 BRCA1/2基因突变携带者乳腺癌发病风险
携带BRCA1/2基因突变的女性不仅乳腺癌发病风险增加,其他如卵巢癌、输卵管癌、胰腺癌、胃肠癌及黑素瘤等发病风险也增加,男性罹患乳腺癌、前列腺癌风险增加[16-20]。欧美研究数据表明,女性BRCA1基因突变携带者70岁前发生乳腺癌累积风险为57.0%~60.0%,70岁前发生卵巢癌累积风险为40.0%~59.0%;女性BCRA2基因突变携带者风险分别为49.0%~55.0%和16.5%~18.0%,相较于一般人群,BRCA1和BRCA2基因突变携带者乳腺癌发病风险提高了10~20倍[21-24]。男性BRCA1基因突变携带者乳腺癌发病风险增加10~50倍,BRCA2基因突变携带者乳腺癌发病风险增加50~100倍[25-26]。中国人群数据显示,BRCA1基因突变携带者乳腺癌发生风险在79岁前为37.9%,BRCA2基因突变携带者为36.5%[27]。
1.2 BRCA1/2基因突变种类、突变位点及种族、地域差异性
BRCA基因突变分为两种类型:一种为胚系突变(germline mutation,gBRCAmut),是指来源于精子或卵母细胞的生殖细胞突变,导致机体所有细胞都带有突变,可以遗传给后代[28];另一种为体细胞突变(somatic mutation,sBRCAmut),是指发生于肿瘤细胞中的BRCA基因突变,为非遗传性突变[29]。截至2017年12月,乳腺癌信息中心(Breast Cancer Informationcore,BIC)报道约1 800个BRCA1和2 000多个BRCA2基因突变位点,其中53%~55%是个体突变,仅在个别家族中发现。致病突变(pathogenic mutation)大多是小片段缺失、插入及非同义突变,导致蛋白质功能缺陷。除BRCA基因编码区突变外,内含子发生的一些变异亦可能通过干扰RNA剪切等方式影响蛋白质功能,尤其是靠近剪接位点附近的突变[30-31]。
这些致病突变分散遍布于整条基因序列,很难找到固定的突变热点,并且即使存在突变热点,在不同地域及不同种族之间差异也很大,但在特定人群存在“始祖突变(founder mutation)”现象。最著名的“始祖突变”出现于德系犹太人中,表现为BRCA1 185delAG(携带率为1.00%)、BRCA1 5382insC(携带率为0.13%)和BRCA2 6174delT(携带率为1.52%)位点突变[32-33]。中国人群BRCA突变的数据,一项纳入8 085例中国乳腺癌患者的研究发现BRCA总突变率为5.3%,其中5589del8突变共检测到28次,占总突变的6.5%[34]。复旦大学附属肿瘤医院在177例家族性和早发性乳腺癌患者及426例散发性乳腺癌患者中发现3例5589del8突变携带者[35]。当前正在进行的一项针对2万多例中国散发性乳腺癌大样本研究发现,BRCA总阳性突变率为5.37%,其中BRCA1阳性突变率为2.14%,BRCA2阳性突变率为3.23%。图1列出已知的中国人群相对高频变异位点,其中5589del8位点突变率高达0.17%,占总突变的3%,由此推测BRCA1 5589del8 位点在汉族人群中可能具有部分始祖效应,而该位点突变频次在欧美极低,表明突变热点在不同人群、不同地域之间存在显著差异[36]。
1.3 BRCA1/2基因突变乳腺癌临床病理特点
BRCA1/2基因突变相关性乳腺癌的病理学特征与非BRCA1/2关联的散发性乳腺癌相比有很大不同。三阴性乳腺癌(triple-negative breast cancer,TNBC)的BRCA1/2基因突变率约为12%[37],激素受体(hormone receptor)阳性/人表皮生长因子受体2(human epidermal growth factor receptor2,HER-2)阴性的乳腺癌BRCA1/2基因突变率为4%[38]。60%~80%的BRCA1基因突变乳腺癌为TNBC,超过75%的BRCA2基因突变乳腺癌为Luminal型[39-40]。总体来说,这部分患者往往分期较高,分化较差。激素受体阳性乳腺癌虽然BRCA1/2基因突变率较低,但该部分患者占整个乳腺癌人群的70%[40],不可忽视,尤其对于有家族史的患者。
1.4 BRCA1/2基因突变与乳腺癌患者预后
BRCA1/2基因突变与乳腺癌患者预后关系,目前尚无定论[41-42]。POSH研究结果显示,对于年轻时(≤40岁)确诊患乳腺癌的患者,携带BRCA基因突变的患者与未携带基因突变的患者生存率相似;在TNBC患者中,携带BRCA基因突变的患者比未携带此基因突变的患者2年生存率高,但5年和10年生存率差异无统计学意义[43]。一项汇总13项大型研究的Meta分析结果显示,BRCA1基因突变乳腺癌总生存期(overall survival,OS)短于未突变患者(HR=1.50,95%CI:1.11~2.04),而BRCA2基因突变与患者OS无相关性[44]。另一项纳入60项研究共105 220例乳腺癌患者的Meta分析显示,BRCA1基因突变患者OS和乳腺癌特异性生存期(breast cancerspecific survival,BCSS)短于未突变者(OS:HR=1.30,95%CI:1.11~1.52,P=0.001;BCSS:HR=1.45,95%CI:1.01~2.07,P=0.045),BRCA2突变患者BCSS短于未突变者(HR=1.29,95%CI:1.03~1.62,P=0.03),但OS差异无统计学意义。此外,该分析显示TNBC患者中BRCA基因突变者预后较好(HR=0.49,95%CI:0.26~0.92,P=0.03)[45],生存趋势与POSH研究结果类似。一项纳入119例早发性乳腺癌(确诊年龄<41岁)的研究发现,BRCA1/2基因突变早发乳腺癌患者是否接受化疗与患者预后存在相关性(HR=3.0,95%CI:1.2~7.7,P=0.014)[46]。关于BRCA1/2基因突变与淋巴结转移的关系,2014年一项纳入159例BRCA1/2基因突变HBC患者的研究发现,BRCA1/2基因突变与淋巴结转移无显著相关性[47]。
专家组意见:BRCA1/2基因突变与乳腺癌的预后相关性并不十分明确,现有研究结果不一致,需要更多的前瞻性研究进一步分析。

图 1 BRCA在中国、亚洲其他国家和欧洲的突变热点对比
1.5 BRCA1/2基因突变与乳腺癌患者的治疗决策
B R C A基因编码蛋白通过同源重组(homologous recombination)参与DNA双链(dsDNA)损伤修复,BRCA1/2基因突变乳腺癌患者由于同源重组修复功能缺陷,可能对铂类或多聚(ADP-核糖)聚合酶[poly(ADP-ribose)polymerase,PARP]抑制剂等致DNA损伤药物更为敏感[48-54]。
1.5.1 基于BRCA基因突变的靶向治疗药物
PARP是DNA单链断裂进行有效修复视频必需的。当PARP抑制剂与DNA相关的PARP活性位点结合,抑制其酶活性,同时将其捕获在DNA上,从而阻滞修复。当复制叉遇到PARP DNA复合物时,这也引起DNA双链断裂(double strand break,DSB)的形成。在BRCA1/2基因突变导致的同源重组修复功能缺陷肿瘤中,DNA DSB无法得到准确或有效的修复,替代性和易错配通路被激活,如典型的非同源性末端连接(non-homologous end joining,NHEJ)通路,引起基因组不稳定性增加,从而引起肿瘤细胞死亡[55-57]。
2017年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)会议报道了PARP抑制剂奥拉帕利(Olaparib)用于转移性乳腺癌患者的Ⅲ期临床试验结果。该研究纳入302例gBRCAmut转移性激素受体阳性或TNBC患者,入组患者前期最多接受两线化疗,激素受体阳性乳腺癌患者至少接受1个疗程内分泌治疗并在内分泌治疗期间进展。研究结果显示,Olaparib组与标准化疗组相比降低了gBRCAmut乳腺癌42%的疾病进展风险,无进展生存期(progressionfree survival,PFS)延长约2.8个月。Olaparib组客观缓解率(overall response rate,ORR)达59.9%,显著高于化疗组(59.9% vs 28.8%)。同时与对照组相比健康相关生活质量更好[59]。2018年1月美国食品药品管理局(Food and Drug Administration,FDA)批准了Lynparza(Olaparib)用于治疗携带BRCA基因突变的HER-2阴性的转移性乳腺癌的治疗。目前尚有OlympiA、BROCADE3和BRAVO等3项PARP抑制剂在晚期乳腺癌中的研究,OlympiA乳腺癌辅助治疗的研究正在进行中。已经完成的晚期/复发转移性乳腺癌中的PARP抑制剂Ⅱ/Ⅲ期临床研究汇总见表1。
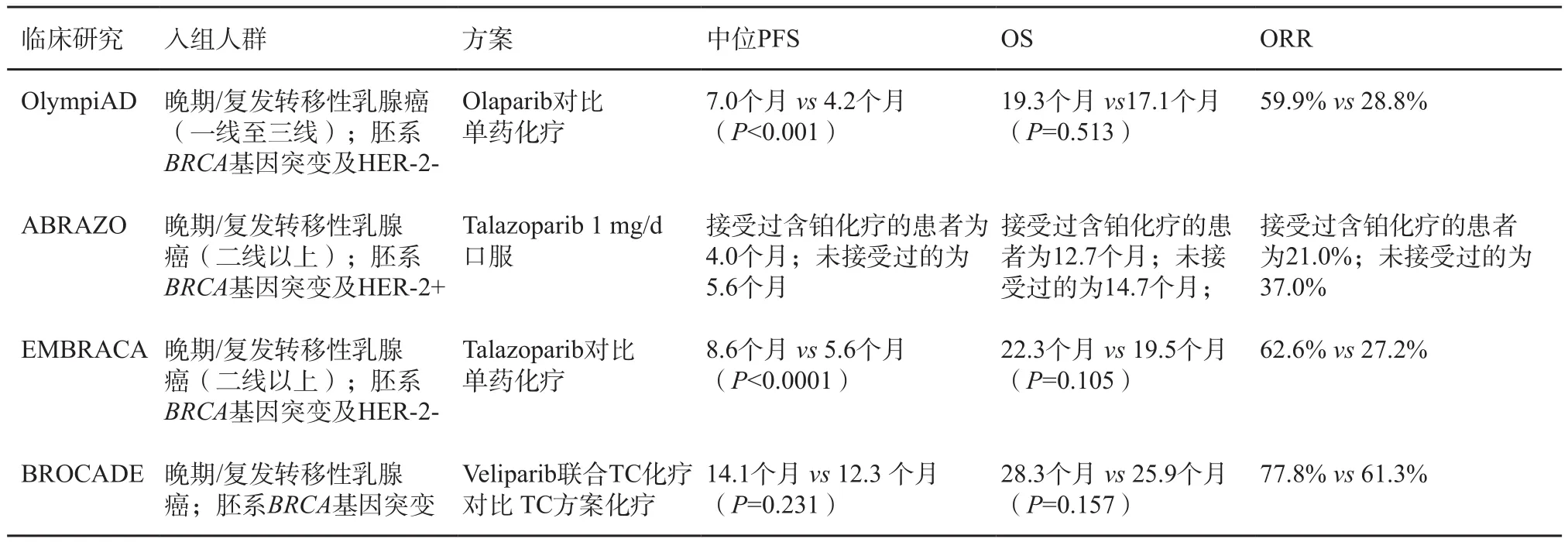
表 1 已完成PARP抑制剂在BRCA基因突变性乳腺癌的临床研究汇总
一项Meta分析纳入两项RCT(n=733)旨在评价单药PARP抑制剂用于BRCAmutHER-2阴性转移性乳腺癌患者的疗效,分析发现单药PARP抑制剂相比单药化疗显著改善PFS(HR=0.56,95%CI:0.45~0.70)和ORR(HR=0.82,95%CI:2.82~6.10),但OS差异无统计学意义(HR=0.82,95%CI:0.64~1.05)。在安全性方面,单药PARP抑制剂相比单药化疗显著增加贫血和任何级别头痛,但能降低中性粒细胞减少症和手足综合征的风险,其他不良事件和治疗中断率差异无统计学意义[60]。
专家组意见:对于伴有BRCA基因突变的晚期或复发转移性乳腺癌患者,可以选择PARP抑制剂如Olaparib作为化疗方案的替代方案,在部分美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)的ECOG评分较高、或对化疗不耐受、或对生活质量有较高要求的患者可以优先考虑使用PARP抑制剂(证据等级2A类)。
1.5.2 化疗药物
研究结果显示,BRCA1/2基因突变的乳腺癌细胞对导致DNA交联的药物更加敏感,如顺铂、卡铂和丝裂霉素等[61-62]。由于这些药物所致的DNA损伤需要DNA同源重组修复,而BRCA1/2基因突变所致功能缺陷使得肿瘤细胞对此类药物更加敏感。有研究结果显示,紫杉醇诱导细胞调亡需要BRCA1蛋白参与,故BRCA1基因突变导致对紫杉醇耐药。上述针对晚期TNBC的研究结果较为一致。2014年圣美国圣·安东尼奥乳腺癌会议(San Antonio Breast Cancer Symposium,SABCS)首次报道,2018年更新结果的TNT研究结果显示,BRCA1/2胚系突变患者中接受卡铂治疗组的ORR为多西他赛治疗组的2倍,PFS也显著延长(ORR: 68.0% vs 33.3%,P=0.030;PFS:6.8个月 vs 4.4个月,P=0.002),但该研究中纳入胚系BRCA1/2基因突变患者数量过少(n=43)。另一项铂类单药治疗86例mTNBC患者的多中心单组Ⅱ期临床研究(TBCRC009研究)也得到了类似的研究结果,BRCA1/2基因突变携带组(n=11)ORR为54.5%,BRCA1/2非基因突变携带组(n=66)ORR为19.7%(P=0.02)。但一项针对TNBC新辅助化疗的Ⅱ期回顾性研究(GeparSixto研究)有不一致的结果,共计291例患者中50例患者存在致病性BRCA1/2胚系突变。在非卡铂组,BRCA1/2基因突变患者的pCR率为66.7%,无BRCA1/2基因突变患者的pCR率为36.4%(OR=3.50,95%CI:1.39~8.84,P=0.008)。在BRCA1/2基因突变患者中观察到的高pCR率,并未因为添加卡铂而被进一步提高(65.4% vs 66.7%)。相反,卡铂提高了无BRCA基因突变患者的pCR率(55.0% vs 36.4%,OR=2.14,95%CI:1.28~3.58,P=0.004)和无病生存率(85.3% vs 73.5%,HR=0.53,95%CI:0.29~0.96,P=0.04)[63]。
专家组意见:在晚期或者复发转移性乳腺癌患者中,若存在BRCA1/2胚系突变,制定化疗方案时可以优先考虑铂类药物而非紫杉类药物[64](证据等级2B类),而在新辅助化疗时,目前研究尚不充足,需要进一步研究(证据等级3类)。
2 对乳腺癌患者进行BRCA基因检测的建议
目前NCCN、ESMO、ASBS及英国国家卫生与临床优化研究所(National Institute for Health and Clinical Excellence,NIHCE)等指南对于BRCA基因检测人群的选择主要基于以下因素:确诊时乳腺癌患者年龄较低,有高风险家族史以及TNBC患者,但对于BRCA基因检测建议的具体细节仍存在较大差异(如年龄、患者乳腺癌原发灶数量及家族史的定义等)。本专家组结合NCCN、ESMO等国外指南,以及我国现有的临床数据,提出推荐进行BRCA基因筛查的乳腺癌患者特征(证据等级2B类),具体内容见表2。

表 2 乳腺癌患者推荐进行BRCA基因检测的专家共识
3 乳腺癌遗传门诊的建立以及个人/家系随访的专家共识意见
3.1 乳腺癌遗传咨询门诊
为了保障对遗传高风险人员进行规范的肿瘤遗传学专业评估,共识推荐有条件的医院或肿瘤中心建立乳腺癌遗传咨询门诊。具体评估内容包括以下几个方面:
⑴ 患者需求和关注:主要向患者介绍用于癌症风险评估的基因检测,包括其益处、风险和局限;让患者了解通过癌症家庭风险评估能够实现哪些目标。
⑵ 家族史:对家族史的询问需要进一步拓展,这些信息主要围绕被诊断为癌症的个体,近亲包括三代亲属;了解并采集家族内患者所患的癌症类型、单双侧和诊断年龄;每个患者的化学预防史和(或)降风险手术史;收集必要的医疗记录文档,尤其需要原发癌的病理诊断报告。
⑶ 详细的医疗史和手术史:针对患者个人,采集详细的肿瘤病史,包括诊断年龄、病变组织类型及部位;询问并记录患者致癌物暴露情况(比如放射治疗史);个人的孕产史;激素或口服避孕药的使用情况;前期的乳腺活组织检查和病理结果;是否有输卵管-卵巢切除术史。
⑷ 专项查体:需要由有资质的内科医师实施,明确患者乳腺癌或卵巢癌的基本情况;为了鉴别诊断,同时需要进行针对Cowden综合征/PHTS的专项检查,主要包括皮肤、口腔黏膜、头周长和甲状腺检查。
⑸ 其他检测:完成以上评估后,还需继续考察咨询者是否符合BRCA相关的乳腺和(或)卵巢癌症综合征、Li-Fraumeni综合征或Cowden综合征/PTEN错构瘤综合征(PTEN hamartoma tumor syndrome,PHTS)各自对应的靶向基因检测标准,或者更适合进行多基因检测。
3.2 高危患者或BRCA1/2突变患者随访监测
乳腺肿瘤的监测以临床触诊结合影像学检查为主。影像学检查以超声、钼靶及磁共振成像(magnetic resonance imaging,MRI)为主要检测手段,不同影像学方法各有优缺点(表3)。鉴于东方女性乳房较致密,且遗传性乳腺癌年轻患者相对较多,钼靶筛查检出率较低。一项前瞻性研究比较BRCA基因突变者不同筛查手段,发现MRI检出率为77%,而钼靶为36%,超声为33%[65-68]。研究发现,BRCA基因突变携带者每年通过MRI检测,可以显著降低晚期乳腺癌的发生率[69-70]。每年一次MRI和钼靶检查相结合,可以使BRCA1基因突变者的生存期延长2年,使BRCA2突变者的生存期延长18个月[71]。虽然超声联合钼靶检查可提高肿瘤检出率,但研究结果表明在肿瘤检出方面MRI优于超声,特别是在已知或怀疑BRCA基因突变的情况[72]。
专家组意见:建议在有条件的地区,对于BRCA基因突变携带者首选MRI检测;对于没有条件进行MRI检查的地区或人群,可以考虑超声联合钼靶的检查(证据等级2B类)。

表 3 BRCA基因突变携带者影像学监测建议
4 BRCA基因突变携带者预防性措施的专家共识意见
2018年更新的Cochrane综述指出,预防性双侧乳腺切除术能有效地降低乳腺癌的发生率和死亡率,但仍需要更严格的前瞻性研究验证。预防性对侧乳腺切除术被证明可以降低对侧乳腺癌的发生率,但没有足够的证据表明预防性对侧乳腺切除术能提高生存率,并且存在偏移情况,比如选择更健康、年轻女性入组等。在进行预防性乳房切除手术时,不要忘记还有其他的措施,应进行综合考量,如预防性双侧输卵管卵巢切除术和药物预防[73]。
基于当前国内对于BRCA基因突变携带者外科预防研究较少,专家组成员主要根据已发表的国外文献进行筛选和解读,结合国内部分中心的经验,经讨论后进行相应的推荐。
4.1 预防性乳腺切除术(risk-reducing mastectomy,RRM)及预防性双侧输卵管卵巢切除术(prophylactic bilateral salpingooophorectomy,PBSO)
早期基于受试者家族史区别危险程度的回顾性分析发现,中高危患者采取预防性双侧乳腺切除术(bilateral risk-reducing mastectomy,BRRM)可降低约90%的乳腺癌发病风险,其中亚组分析结果显示,BRRM可降低BRCA突变基因携带者85%~100%的乳腺癌发病风险[74-76];前瞻性非随机队列研究6.4年随访发现,BRRM可以降低BRCA基因突变者95%的乳腺癌发病风险[77]。2004年后几项研究基本与之前大型研究结果一致,目前尚无明确的生存获益分析,通过分析决策模型显示突变基因携带人群可获得约3年的生存获益。一项纳入6项研究总计2 555例患者的Meta分析表明,预防性双侧乳腺切除术可以降低乳腺癌发生的风险(RR=0.11,95%CI:0.04~0.32),但手术并不能显著降低全因死亡率,并且手术并发症也不容忽视。一项前瞻性队列研究对112例BRRM后即刻乳房重建术的患者进行了2.8年随访,其中10%发生出血,9%发生感染,14%发生包膜挛缩。共有33%的女性患者需要再次手术[78]。除此之外,社会心理学问题也应重视,手术前应进行多学科评估,选择不同的重建方式,也应有整形科医师一同参与。
在突变基因携带者中仅行PBSO或合并BRRM均可显著降低总死亡率、乳腺癌相关死亡率及妇科癌症相关死亡率[79-81]。进一步分析BRCA基因突变人群,研究结果显示BRCA1组存在显著意义的生存获益,而BRCA2组无显著获益(可能与该项研究中纳入的BRCA2病例数过少有关)[82]。肿瘤相关死亡率降低与总生存率的提高主要发生在小于50岁的女性患者中,总的预期生存率会随着接受手术年龄的增长而降低。
专家组意见:对于携带BRCA基因突变的健康人群,预防性切除可以减少肿瘤的发生风险。但考虑到我国患者群体BRCA基因突变数据不够完善、接受程度有限以及存在手术相关并发症,总体原则为慎重,建议对于基因检测存在BRCA基因突变的人群要重视乳腺癌筛查,可考虑行预防性BRRM(证据等级3类)。对于计划乳房重建的患者,为了保持双侧乳房对称美观,可以考虑预防性对侧切除及双侧乳房重建。考虑做BRRM的女性应该首先进行全面的多学科评估,包括乳房检查、双侧钼靶和MRI检查,在结果正常的情况下,可考虑进行手术。对于罹患乳腺癌的BRCA基因突变携带患者,如果组织学分级、细胞增殖指数较高,且激素受体表达阴性,对侧乳房预防性切除手术也是可以考虑推荐的治疗策略(证据等级2B类)。对于小于50岁的高危年轻患者可以推荐尽早行PBSO以取得最大获益(证据等级2B类)。
4.2 药物预防
已有三项前瞻性大型临床试验(NSABP P1试验、IBIS-1试验和STAR试验)显示SERM类药物对于高危人群乳腺癌有预防作用。在NSABP-P1研究中[83],19例突变携带者,他莫昔芬使得BRCA2基因突变者乳腺癌发生风险降低了50%,但是对BRCA1基因突变者的预防效果不佳。由于突变患者过少,所以证据似乎还不够充分。到目前为止,应用他莫昔芬及其类似药物预防BRCA相关性乳腺癌的有效性尚未得到充分肯定。
目前有两项大型预防性临床研究结果显示,芳香化酶抑制剂不仅可降低绝经后妇女浸润性乳腺癌的发生率,而且可用于乳腺癌早期患者对侧乳腺癌的预防。以上两项临床研究都没有限定在BRCA基因突变人群,所以阿那曲唑和依西美坦是否能够预防BRCA相关乳腺癌的发生目前结论不明确[84-85]。
专家组意见:目前对BRCA基因突变携带者的药物预防效果,还需要进一步研究确认(证据等级3类)。但对于ER阳性的BRCA基因突变的乳腺癌患者,可以推荐使用内分泌治疗进行预防(证据等级2A类)。
5 BRCA基因突变携带者监测和管理方案的专家共识意见
BRCA基因检测结束后应告知被检者其亲属可能的癌症遗传风险以及他(她)的风险评估和管理策略。如果检测到已知的BRCA致病突变,则可按照表4中的方案进行管理及预防。

表 4 不同BRCA突变阳性携带者人群对应的管理方案
6 BRCA1/2基因突变检测流程、质控及报告内容和解读规范
6.1 检测前咨询
询问家族史信息,一级、二级及三级双方亲属是否有乳腺癌、卵巢癌、前列腺癌及胰腺癌病史;家族中是否有人已进行过BRCA1/2基因检测;评估被检者的患病风险;告知被检者关于乳腺癌遗传方式、外显率、遗传异质性及变异多样性的相关知识;告知被检者检测潜在的风险及可能的检测结果,并签署知情同意书。
6.2 突变检测及验证
① 家族中存在已知变异位点:建议采用一代测序的方法检测家族特异位点;② 家族中未存在已知变异位点或家族中从未进行过BRCA基因检测:建议采用二代测序技术结合大片段缺失检测方法检测BRCA1/2基因的全部外显子以及外显子和内含子连接区域±20 bp。
6.3 检测后咨询
向被检者详细解释检测结果以及针对检测结果应采取何种预防和治疗手段;向被检者推荐一些临床帮助,比如参与药物临床试验及其他疾病互助资源;建议家族中其他高风险成员进行BRCA基因检测(图2)。

图 2 BRCA具体检测及风险管理流程
6.4 检测报告格式和解读流程
建议参考《中华病理学杂志》2017年第5期刊发的《BRCA数据解读中国专家共识》。
6.5 BRCA1/2检测结果的解读
结果解读的责任属于临床实验室,应根据所检测的人群特征、综合临床分子诊断的实验数据和临床信息,对医师和患者描述此结果对疾病诊断的含义,为个体化用药提出建议。临床解释的责任属于临床医师,其应根据检测结果和临床信息向患者解释检测结果。
对于阳性结果的判定解读是BRCA基因检测中最为重要的环节。BRCA基因突变解读需要依据各类信息(包括来自群体数据库、疾病数据库、文献和患者病史的信息)进行综合评判。在国外数据分析的基础之上,构建我国大样本BRCA基因突变数据库并进行规范解读,可以指导与规范BRCA基因检测在我国的临床应用,改善相应患者的治疗策略,提高高危人群的筛查和预防水平。相信随着中国人群特有的BRCA基因突变数据库的建立以及BRCA基因突变的致病性理解加深,我们对BRCA基因检测结果的判定会越来越准确。
