基于CRISPR/Cas9技术的人胚胎干细胞多模态示踪系统构建
2018-11-14路兴爱赵振奥胡士军
路兴爱,吴 洁,赵振奥,胡士军
(1.苏州大学 心血管病研究所,江苏苏州 215000; 2.苏州大学 附属第一医院心脏大血管外科,江苏苏州 215006)
干细胞领域的飞速发展给再生医学带来了革命性的改变.特别是人胚胎干细胞(human Embryonic Stem Cells, hESCs),其无限制的自我更新能力及可分化成任何一种细胞的特性[1-2],使其在干细胞研究、人类疾病模型建立、药物筛选中发挥着巨大的作用,更是细胞治疗的重要供体来源.然而进一步的研究发现hESCs的移植面临着细胞存活率低、畸胎瘤形成、以及免疫排斥等一系列问题[3],构建稳定表达报告基因的细胞株可对移植干细胞的命运进行实时监控,有助于移植策略的优化.
多模态成像是指将光学成像与其他成像模式相结合,同时获得多种参数的成像方式,最新的进展是三融合报告基因技术,由生物发光,荧光和PET(Positron Emision Tomograph)报告基因组成[4].生物发光是生物利用体内的酶将化学能转化为光能而发光的一种现象,常见的酶包括萤火虫荧光素酶(Fluc)和海肾荧光素酶(Renilla Luciferease, Rluc)等,可以通过与底物反应产生光,从而被电荷耦合器(CCD)捕获,这种影像模式目前可用于小动物成像,具有灵敏度高、特异性强等优点,但是其固有的劣势局限了在人类疾病临床中的应用.荧光显像,在生物学领域应用十分广泛,常见的报告基因有copGFP、eGFP和RFP等,但是这种成像方式信噪比和灵敏度较低.PET是核医学领域比较先进的临床检查影像技术,其分子探针为正电子核素(如放射性核素F18等)标记分子(HSV-ttk),具有快速、高分辨率和高灵敏度显像的特点,弥补了前两种成像方式的不足.这种多模态成像的方式可更准确、敏感地跟踪检测移植细胞在体内的动态变化,监控副作用.
第三代基因编辑技术CRISPR/Cas9(Clustered Regulatory Interspaced Short Palindromic Repeat/associated 9)技术通过具有引导作用的单链RNA(Single Guide RNA, sgRNA)指导Cas9蛋白在与sgRNA互补处剪切双链DNA,导致DNA双链断裂进而利用同源重组或非同源末端连接机制修复DNA并插入靶基因.CRISPR/Cas9技术具有高效、低毒性、低成本等优势,为快捷高效地对基因组进行编辑提供了条件.
AAVS1位点是位于人19号染色体上PPP1R12C基因第一个内含子中的一段特定序列,在该区域内引入外源核苷酸序列已被证明不会影响PPP1R12C基因或其他内源基因的表达,并且对细胞的毒性小,是一个经过验证后确保插入靶基因正常转录且不影响邻近基因表达的安全港位点[5].AAVS1位点对DNA酶Ⅰ(DNaseⅠ)敏感,是一个开放的染色体结构[6],同时与绝缘子样顺式作用元件相联系,使得外源插入基因沉默的可能性最小化[7].已证明,在hESCs的AAVS1位点转入的靶基因可长期稳定表达[8].因此AAVS1位点可以作为生成含有三融合报告基因细胞株的有效位点.但是有文献报道在AAVS1位点处EF1等启动子有沉默现象[9],因此本研究采用CRISPR/Cas9技术将两种常用强启动子(CAG和UB)启动的3个报告基因(copGFP、Fluc和HSVttk)插入H7细胞株的AAVS1位点处,建成含有3个报告基因的H7细胞株(H7-TR),同时对3个报告基因的表达进行了分析,进而比较不同启动子对报告基因表达的影响,从而选出三融合报告基因高效、平衡表达的最优载体结构,为后续干细胞移植策略的优化提供了有效的多模态成像手段,并为人胚胎干细胞中基因表达的启动子的选择提供了实验依据.
1 材料与方法
1.1 材料
pX330-U6-Chimeric_BB-CBh-hSpCas9质粒购自Addgene公司(Plasmid#42230),pAAVS1-EF1由复旦大学生命科学学院王永明教授馈赠;大肠杆菌E.coliStbl3感受态细胞购自TaKaRa公司.
1.2 方法
1.2.1 CRISPR载体
pCRISPR/Cas9-sgRNA-AAVS1靶向PPP1R12C第一个内含子序列gggccactagggacaggat(图1(a)).
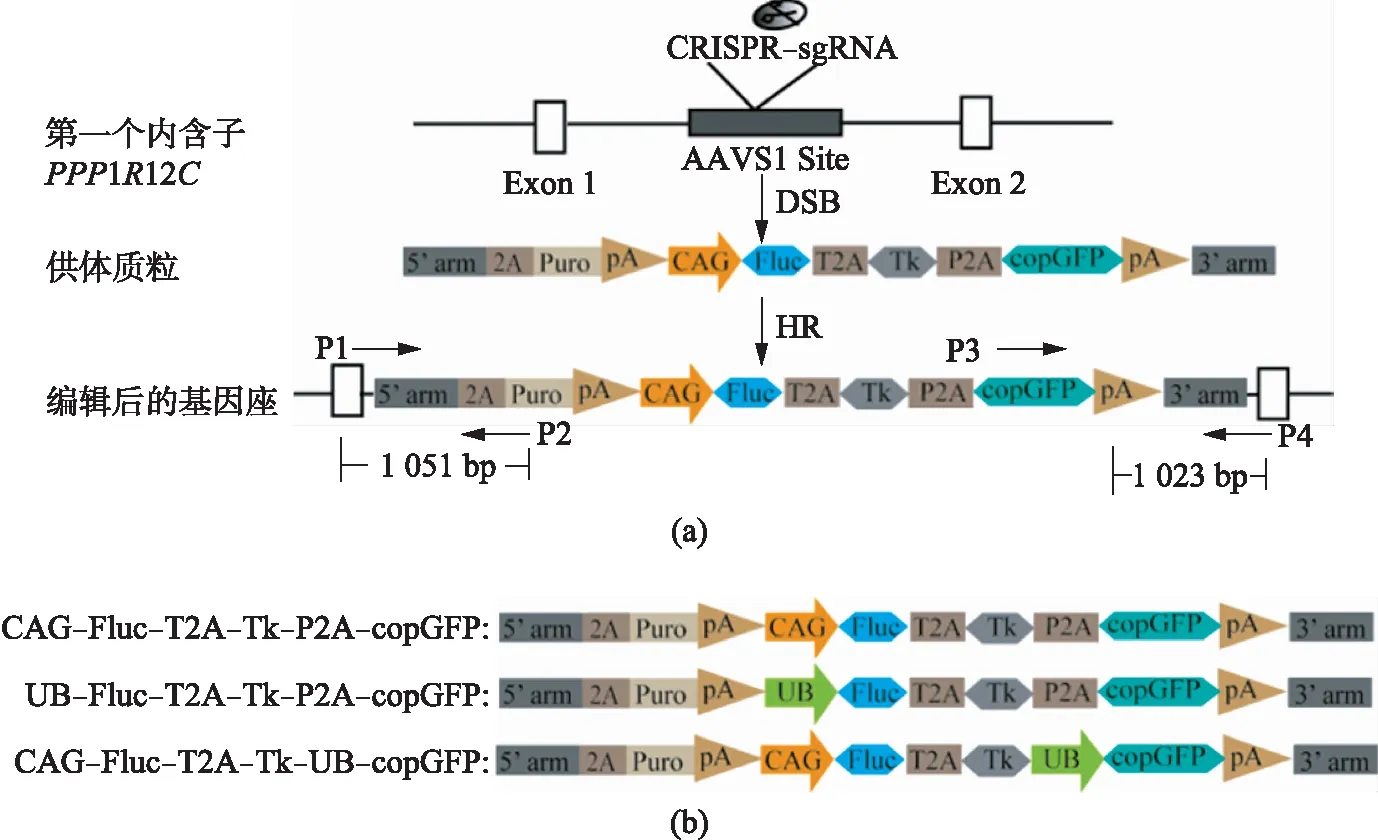
图1 pCRISPR/Cas9-sgRNA-AAVS1双载体系统及供体质粒敲入位点的设计Fig.1 Schematic diagram of CRISPR/Cas9 vector and CRISPR target site of donor vectors(a) 不同启动子启动的三融合报告基因结构图;(b) CRISPR/Cas9介导干细胞AAVS1位点三融合报告基因敲入原理图;DSB(double-strand breaks),双链断裂;HR(homologous recombination),同源重组.
首先,使用BsmBⅠ酶将sgRNA载体pX330-U6-Chimeric_BB-CBh-hSpCas9进行酶切线性化,产生不同的黏性末端.根据酶切后的sgRNA载体的特点设计靶向序列引物AAVS1-sgRNA-F和AAVS1-sgRNA-R,由苏州金唯智生物公司合成,引物序列见表1.将sgRNA的上下游进行变性、退火(60μL体系: 10μmol/L上下游引物各10μL+1.2μL 5mol/L NaCl,用去离子水定容到60μL;95℃,5min,自然冷却至室温).用T4 DNA连接酶将退火的sgRNA上下游引物和线性化的sgRNA载体连接(10μL体系: 1μL退火产物+1μL sgRNA载体线性化产物+1μL T4 DNA连接酶+1μL T4 DNA连接酶缓冲液+6μL去离子水),4℃过夜.转化大肠杆菌感受态细胞Stbl3,Amp+平板筛选后,选取阳性克隆送去苏州金唯智生物有限公司测序,测序引物Human-U6,如表1所示.将测序正确的菌落37℃摇床过夜培养,离心后收集菌体,按质粒试剂盒说明书完成质粒提取.
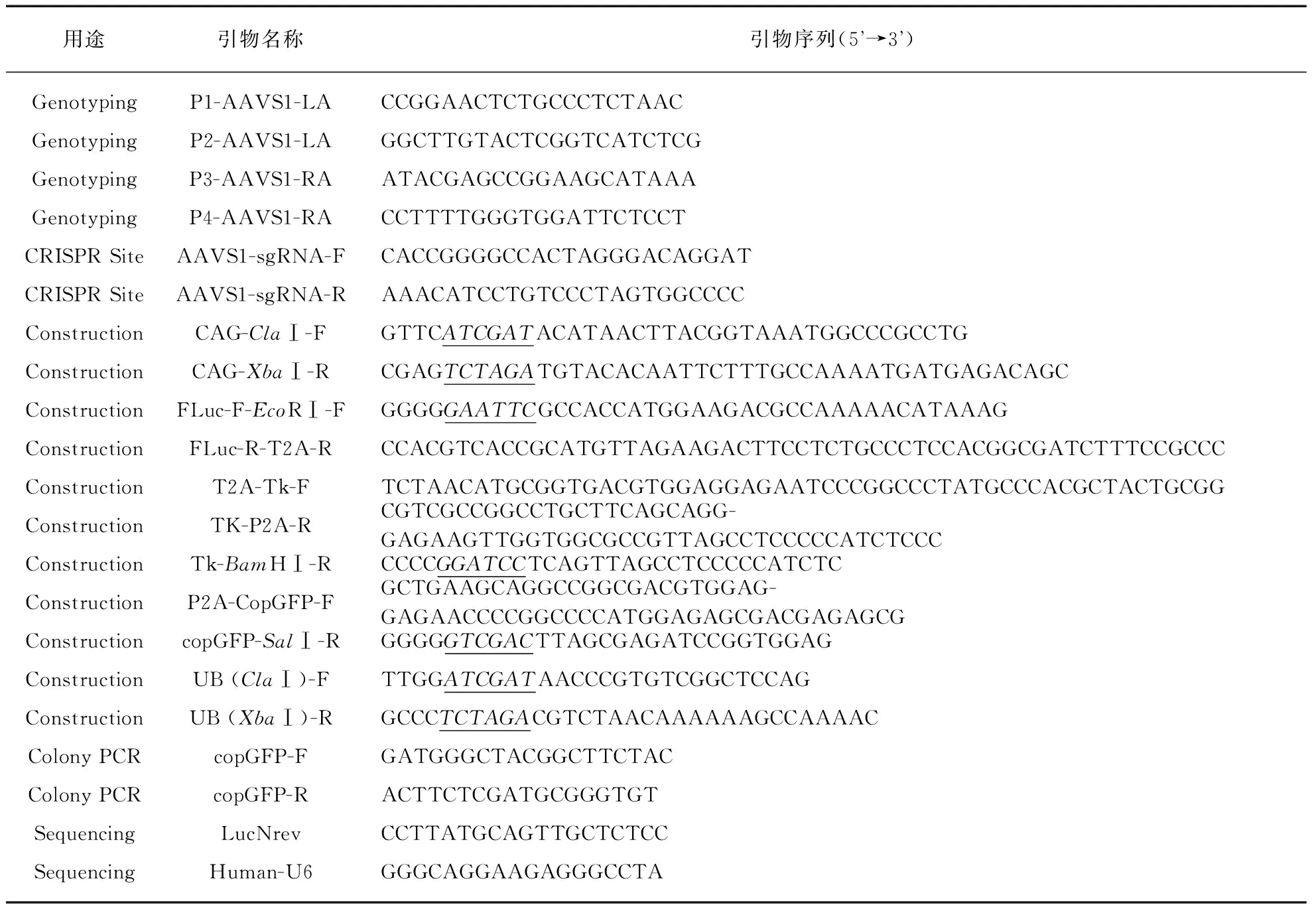
表1 引物列表
注: 下划线处表示限制性内切酶酶切位点.
1.2.2 供体质粒构建
构建的H7-TR载体包括pAAVS1-CAG-Fluc-T2A-Tk-P2A-copGFP、pAAVS1-UB-Fluc-T2A-Tk-P2A-copGFP和pAAVS1-CAG-Fluc-T2A-Tk-UB-copGFP(图1(b)),都由pAAVS1-EF1衍生而来.
1.2.3 细胞培养和转染
H7细胞培养于mTeSRTM1(STEMCELL Techonologies)完全培养基中,培养条件为37℃、5% CO2.本研究使用Thermo Fisher公司的Lipofectamine®3000 Transfecting Kit进行瞬时转染的方法.H7细胞密度达到60%~70%时,用125μL mTeSRTM1基础培养液加2.5μg pCRISPR/CAS9-sgRNA-AAVS1和2.5μg H7-TR质粒后再加入5μL P3000TMreagent(Thermo Fisher),充分混匀后与125μL mTeSRTM1基础培养液稀释的LipofecteminTM3000(Thermo Fisher)充分混匀,室温孵育15min,加到事先准备的细胞中,37℃、5% CO2培养,48h后荧光显微镜下观察转染效率.
1.2.4 稳定细胞系的筛选
转染48h后,维持1μg/mL嘌呤霉素筛选压力下,每天更换新鲜培养液,37℃,5% CO2连续培养4d,经500μL StemPro Accutase(Thermo Fisher)消化为单个细胞,在含1μg/mL嘌呤霉素的mTeSRTM1完全培养基连续培养7~12d,挑取阳性克隆.
1.2.5 单克隆细胞基因型鉴定
用质粒小提试剂盒(TIANGEN)提取传代后单克隆的基因组.为了检测供体质粒是否插入到AAVS1位点,分别在供体质粒和AAVS1位点设计5’端鉴定引物P1-AAVS1-LA(位于PPP1R12C基因第一个内含子区,左侧同源臂上游)和P2-AAVS1-LA(在供体质粒Puro筛选基因内),产物1051kb;3’端鉴定引物P3-AAVS1-RA(供体质粒copGFP基因内)和P4-AAVS1-RA(右侧同源臂下游),产物长度为1023kb.引物序列如表1所示.PCR反应条件为: 95℃预变性5min;30个循环(94℃变性30s,60℃退火30s,72℃延伸1min);72℃后延伸7min.PCR产物经0.8%的琼脂糖凝胶电泳检测.
1.2.6 萤光素酶报告基因检测(启动子活性)实验(Luciferase Assay)
将构建成功的3个H7-TR细胞株培养于mTeSRTM1完全培养基中,培养条件为37℃、5% CO2.待细胞密度达到80%,吸走废液,经1mL DPBS洗2遍后,加入300μL PLB(Passive Lysis Buffer,Promega),室温,摇30min,将上述裂解液收集到1.5mL离心管中,1000g,4℃,离心10min,用BCA试剂和测出蛋白浓度,定量到1μg/mL,吸取10μL与96孔板中同时快速加入50μL萤光素酶检测试剂Ⅱ(Promega),用酶标仪检测吸光值对萤火虫萤光素酶(Firefly Luciferase,Fluc)的活性定量.
1.2.7 流式细胞仪检测
通过流式检测copGFP强度和阳性细胞率.H7-TR细胞经500μL StemPro Accutase(Thermo Fisher),37℃消化1min,吸走消化液,DPBS洗两遍,然后流式细胞仪鉴定copGFP阳性细胞的比率和强度.
1.2.8 丙氧鸟苷(Ganciclovir, GCV)敏感实验
H7-TR细胞株培养于mTeSRTM1完全培养基中,37℃、5% CO2条件下连续培养2d后,在mTeSRTM1完全培养基中添加并维持10μmol/L GCV条件下,连续培养3d,显微镜观察细胞状态.
1.2.9 统计学分析
本实验数据均采用均数±标准差表示,使用GraphPad 6.0软件进行统计学分析,两组结果之间的比较采用t检验,设定P<0.05则具有统计学意义.(注:*P<0.05,**P<0.01,NSP>0.05).
2 结 果
2.1 pCRISPR/Cas9-sgRNA-AAVS1载体和供体质粒构建
为了克服人胚胎干细胞中病毒载体的基因沉默现象,我们设计了专门针对AAVS1位点的sgRNA,将其克隆到sgRNA载体中,命名为pCRISPR/Cas9-sgRNA-AAVS1.pAAVS1-CAG-Fluc-T2A-Tk-UB-copGFP的鉴定见图2(a).

图2 琼脂糖凝胶电泳鉴定pCRISPR/Cas9-sgRNA-AAVS1及供体质粒Fig.2 The detection for the vector pCRISPR/Cas9-sgRNA-AAVS1 and donor plasmid by agarose gel electrophoresis(a) PCR扩增产物的鉴定.1,2,3,4和5泳道分别是CAG、UB、Fluc-2A-Tk-2A-copGFP、UB-copGFP、AAVS1-EF1经XbaⅠ和ClaⅠ双限制性内切酶的酶切结果;(b) 菌落PCR扩增产物的鉴定.1,2,3分别代表质粒pAAVS1-UB-Fluc-T2A-Tk-P2A-copGFP、pAAVS1-CAG-Fluc-T2A-Tk-P2A-copGFP和pAAVS1-CAG-Fluc-T2A-Tk-UB-copGFP.
具体步骤为: 利用CRISPR/Cas9技术形成双链切口,利用同源重组,将不同启动子驱动的Fluc、HSVttk和copGFP插入到AAVS1位点.利用引物CAG-ClaⅠ-F和CAG-XbaⅠ通过高保真酶扩增获得CAG(1641bp),通过同样的方法,用引物UB-ClaⅠ和UB-XbaⅠ获得UB(1236bp),通过ClaⅠ和XbaⅠ双限制性内切酶进行酶切,连接到载体pAAVS1-EF1(6445bp)中,获得载体pAAVS1-CAG和pAAVS1-UB.用引物FLuc-F-EcoRⅠ-F、FLuc-R-T2A-R、T2A-Tk-F、TK-P2A-R、P2A-CopGFP-F通过重叠PCR获得Fluc-T2A-Tk-P2A-copGFP片段(3510bp),用于构建pAAVS1-CAG-Fluc-T2A-Tk-P2A-copGFP和pAAVS1-UB-Fluc-T2A-Tk-P2A-copGFP;同理,利用引物FLuc-F-EcoRⅠ-F、FLuc-R-T2A-R、T2A-Tk-F、Tk-BamHⅠ-R获得片段Fluc-T2A-Tk(2696bp)连接到载体pAAVS1-CAG中,获得pAAVS1-CAG-Fluc-T2A-Tk;利用引物UB(ClaⅠ)-F、copGFP-SalⅠ-R通过普通PCR获得片段UB-copGFP(1992bp),连接到载体pAAVS1-CAG-Fluc-T2A-Tk中,成功构建pAAVS1-CAG-Fluc-T2A-Tk-UB-copGFP(所用引物序列见表1).转化后每种载体取一个阳性克隆进行菌落PCR,所用引物为copGFP-F/R(表1).图2(b)结果显示3种载体均为copGFP阳性.将菌落PCR鉴定为copGFP阳性的克隆送去测序,测序引物LucNrev(表1).
2.2 H7-TR细胞株筛选和鉴定
本研究使用LipofectaminTM3000转染的方法将2.5μg目的质粒(pAAVS1-CAG-Fluc-T2A-Tk-P2A-copGFP,pAAVS1-UB-Fluc-T2A-Tk-P2A-copGFP和pAAVS1-CAG-Fluc-T2A-Tk-UB-copGFP)分别与2.5μg pCRISPR/Cas9-sgRNA-AAVS1质粒共同转染H7细胞,构建H7-TR细胞株,分别命名为CTR(CAG-drived Triple Reporters),UTR(UB-drived Triple Reporters)和CUTR(CAG and UB-drived Ttriple reporters).经1μg/mL 嘌呤霉素(Puro)连续筛选后挑取阳性单克隆进行基因型鉴定,结果3种H7-TR细胞株均在AAVS1位点成功插入三融合报告基因,3种细胞株均为杂合(图3(a)).对其传代后第一代(P1)进行荧光观察,3种细胞株均全部表达copGFP,CUTR细胞株copGFP较强,CTR次之,UTR稍弱(图3(b)).培养3d后加入10μmol/L 的HSVttk敏感试剂GCV,连续处理72h后细胞大多死亡,证明3种细胞系均成功表达HSVttk基因,且CTR对GCV较为敏感,UTR次之,而CUTR较弱(图3(c)).萤光素酶报告基因检测结果证明细胞株CTR中的Fluc表达强度高于UTR,CUTR细胞株Fluc表达强度较低(图3(d)).

图3 H7-TR细胞株的构建Fig.3 The construction of H7-TR cell line(a) 基因型鉴定,LA左臂1051bp;RA右臂1023bp;WT野生型1884bp;(b) H7-TR细胞株第一代copGFP荧光照片,标尺为100μm;(c) GCV敏感实验: 10μmol/L GCV连续处理3d后,细胞生长状况,标尺为200μm;(d) 萤光素酶报告基因检测实验,细胞株CTR中荧光素酶蛋白表达强度高于UTR,CUTR细胞株中表达强度较低;(e) 实时定量检测细胞编辑后干细胞标记基因NANOGO、OCT4、SOX2表达水平;*P<0.05,**P<0.01,NSP>0.05.
实时定量分析结果证明3个细胞株CTR、UTR、CUTR干细胞标志基因OCT4、NANOGO、SOX2表达量均无显著差异(图3(e)).通过上述综合分析证明CAG启动子在AAVS1位点的表达活性强于UB启动子,且采用双启动子并没有提高相关基因的转录活性,总之CAG启动的三融合报告基因最具优势.
2.3 细胞传代对不同启动子在AAVS1位点表达强度的影响
对3个细胞株进行连续培养观察发现CTR细胞株荧光强度强于UTR细胞株,且无沉默现象(图4(a)).流式检测发现CTR细胞株荧光强度明显强于UTR细胞株,验证了荧光观察的结果,且copGFP阳性率在90%以上(图4(b)和(c)).同时跟踪检测Fluc基因表达水平,CTR细胞株Fluc表达强度最高,UTR次之,而CUTR细胞株最低(图4(d)).通过连续跟踪观察,进一步证明在hESCs细胞的AAVS1位点处,CAG启动子转录活性高于UB启动子,且无沉默现象.此外发现含UB单启动子的UTR细胞株中UB启动的Fluc和copGFP报告基因有显著沉默现象,而含CAG和UB双启动子的CUTR细胞株中由UB启动的copGFP无显著沉默现象,其具体机制还不清楚,推测与所载基因有关.
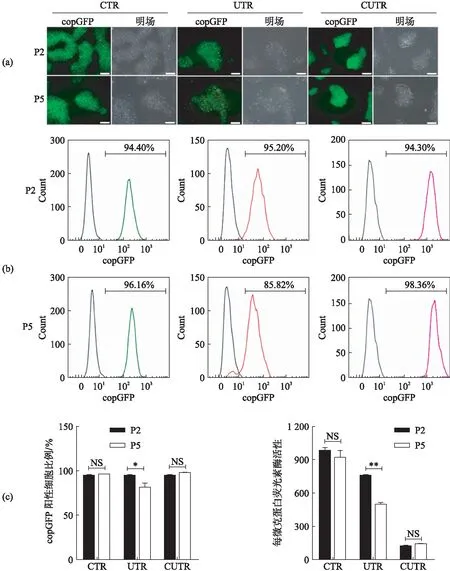
图4 在AAVS1位点处CAG启动子表达活性强于UBFig.4 The transcriptional activity of promoter CAG is stronger than that of UB promoter(a) H7-TR细胞株挑取阳性单克隆传2代后(P2)和传5代后(P5)copGFP荧光结果,标尺为100μm;(b)和(c) 流式分析copGFP表达情况,左侧,为细胞株CTR P2和P5;中间,细胞株UTR P2和P5;右侧,细胞株CUTR P2和P5;(d) 萤光素酶报告基因检测实验,H7-TR细胞株P2和P5代Fluc基因表达分析,*P<0.05,**P<0.01,NS P>0.05.
3 讨 论
为了高效地示踪移植细胞,通常选用多模态成像方式,这就需要多基因共同表达.为了保证多基因同水平共同表达,普遍采用融合蛋白的方式使其在同一个载体中共同表达,这种方式可保证多基因共同表达且不需要中介序列,然而有研究报道融合蛋白表达的方式可降低蛋白的表达活性,具有改变蛋白功能的危险[10-11].而在多基因之间插入2A序列或2A类似序列能够缓解这些问题[12].本实验主要采用2A序列连接三融合报告基因,排除了融合蛋白结构对蛋白活性带来的影响.
AAVS1位点位于人类19号染色体PPP1R12C基因第一个内含子中.在该区域内引入外源基因已被证明不会影响PPP1R12C基因及其他内源基因的表达,且对培养细胞无已知副作用.因此,理论上可以在此区段引入外源基因及其调控序列,以实现功能蛋白正常表达的目的.然而在不同细胞中,报告基因在AAVS1位点的表达及表达强度对启动子具有很强的依赖性,例如CMV,EF1在hESCs细胞中容易发生沉默现象,而在HEK293细胞中却又有较强的表达活性[13].泛素启动子UB启动效率较高、甲基化程度相对较低、遗传性状稳定,是目前研究较多的启动子.用ZNF技术将三融合报告基因Fluc、RFP和HSVttk插入到AAVS1位点后,Fluc并没有沉默现象[14].
2014年报道称强启动子CAG在AAVS1位点启动的eGFP无论是在分化前还是分化后也都没有沉默现象[9].因此,为了高效表达多基因,我们选用强启动子CAG和UB,构建了3种报告基因载体分别由CAG、UB及CAG和UB共同启动自裂解多肽2A连接的三融合报告基因,通过CRISPR/Cas9技术,利用同源重组定向整合到人胚胎干细胞H7中的AAVS1位点,成功构建出CTR、UTR和CUTR 3个细胞株,并比较了其在AAVS1位点的表达活性.通过对3个细胞株进行连续跟踪培养,荧光观察和流式细胞仪检测,发现CTR细胞株中CAG启动的报告基因荧光强度强于UTR细胞株中UB启动的,且无沉默现象,同时对Fluc跟踪检测发现CTR细胞株中CAG启动的Fluc报告基因表达水平明显高于UTR细胞株中UB启动的,证明了CAG启动子在AAVS1位点表达活性强于UB启动子.此外通过荧光观察和流式细胞仪分析发现CUTR细胞株中CAG和UB共同启动的三融合报告基因中copGFP荧光强度明显强于CTR和UTR细胞株中分别由CAG和UB单启动子启动的,但是Fluc活性检测发现Fluc报告基因表达活性明显低于CTR和UTR细胞株中分别由CAG和UB单启动子启动的,3个报告基因的表达出现了失衡现象,根据文献报道这可能由双启动子之间相互干扰所致[15-16].
综上所述,本研究表明在AAVS1位点同时启动基因时,CAG启动子转录活性高于UB启动子,且无明显沉默现象,在构建过表达目的基因胚胎干细胞系时可优先选用CAG启动子.本研究构建的三融合报告载体系统可用于后续移植细胞的多模态成像,优化移植策略.
