响应面分析法优化α-环糊精的酶转化工艺*
2018-11-13陈晓彤黄立萍郝建华
陈晓彤 黄立萍 孙 谧 郝建华
响应面分析法优化α-环糊精的酶转化工艺*
陈晓彤1,2黄立萍1,2孙 谧1郝建华1①
(1. 农业农村部极地渔业开发重点实验室 青岛海洋科学与技术试点国家实验室海洋药物与生物制品功能实验室 中国水产科学研究院黄海水产研究所 青岛 266071;2. 上海海洋大学食品学院 上海 201306)
为获得较高的α-环糊精转化产率,采用单因素实验和响应面实验方法,筛选底物种类、底物浓度、加酶量、酶作用时间、作用温度和pH等多个单因素,对海洋芽孢杆菌Y112产的α-环糊精葡萄糖基转移酶产α-环糊精的条件进行了优化。然后利用Plackett-Burman实验筛选得到影响α-环糊精转化率的3个主要因素:底物浓度、温度和pH值。最终采用响应面分析法得到的最佳转化条件为马铃薯淀粉浓度为5%,加酶量200 U/g(淀粉),pH值为8.4,温度30℃,200 r/min反应6 h,α-环糊精转化率均值为28.67%,比优化前的产率提高了2.48倍。
α-环糊精葡萄糖基转移酶;响应面分析法;α-环糊精;转化工艺
环糊精(CD)是由环糊精葡萄糖基转移酶(CGTase)作用于直链淀粉而产生的环状低聚糖(Valle, 2004),常见的有α-、β-和γ-环糊精。环糊精可以包埋形状各异和适当大小的疏水性客体分子,进而改变它们的理化性质(Biwer, 2002)。环糊精的化学性质均较稳定,α-环糊精在体内的代谢作用最慢且无毒(Arima, 2011)。环糊精在医药(朱征等, 2016),化妆品(李姝静等, 2016)、环保领域(张洪伟, 2014)等有良好的应用前景,而且作为一种新型的膳食纤维逐渐走入人们的视野(Artiss, 2006)。
大多数CGTase生成的是多种环糊精的混合体。Bharat等(2001)利用来自肺炎克雷伯菌AS-22分泌的CGTase酶生产α-环糊精。Duan等(2013)以α-CGTase和异淀粉酶作用于马铃薯淀粉,CD的总产量达到84.6%,比单独使用α-CGTase的转化率提高了31.2%。目前,环糊精的应用依然受到环糊精产量的制约,继续研究提高环糊精产率的方法具有重要意义。
本研究对前期筛选到的来自黄海海域的海洋芽孢杆菌Y112的α-CGTase生产α-环糊精的条件进行优化,旨在提高α-环糊精的产量,以便应用于食品药品等领域。
1 材料与方法
1.1 酶的来源
α-CGTase酶:由菌株海洋芽孢杆菌Y112(与DSM8721的同源性为100%,本实验室分离自中国黄海水域)发酵提取制备获得。
1.2 主要试剂
α-环糊精标准品(Aladdin, HPLC级);可溶性淀粉,玉米淀粉,马铃薯淀粉,麦芽糊精(索莱宝);水溶性淀粉-底物(Aladdin, 药用级);甲基橙(Aladdin, AR);其他化学试剂,国药集团化学试剂有限公司。
1.3 α-CGTase酶活力的测定
实验组:取4 g水溶性淀粉,用配制好的pH=8.5的0.2 mol/L的NaOH-甘氨酸缓冲液100 ml (现用现配)溶解并进行加热糊化作为底物,待其冷却后取0.9 ml液体在试管中,放入50℃水浴锅中预热5 min,然后加入适当稀释倍数的粗酶液0.1 ml混合均匀, 50℃水浴反应4 min,取出后迅速加入1 ml盐酸溶液(1 mol/L)终止反应,最后加入4 ml稀释4倍的甲基橙溶液,混匀,室温静置20 min。
对照组:取底物0.9 ml于试管中,预热5 min。随实验组放入水浴反应4 min后,加入1 ml盐酸溶液混合均匀后,再加入与实验组相同的粗酶液,其他处理与实验组相同。用分光光度计在507 nm测定实验组与对照组的吸光度。1个单位酶活定义为上述条件下生成1 μg α-环糊精需要的酶量(张晓磊等, 2015)。
1.4 绘制标准曲线
取一支试管,分别加入1 ml梯度浓度的α-环糊精标准溶液和1 ml 1 mol/L的盐酸,再加入4 ml稀释4倍的甲基橙溶液于试管中,摇匀,室温静置20 min,在507 nm处测吸光度。其中,空白不含α-环糊精,其余操作相同。以环糊精浓度为横坐标,吸光度差值为纵坐标,绘制标准曲线。吸光度差值(DOD)=空白溶液吸光度-样品吸光度。
1.5 α-环糊精含量测定
将待测溶液按照1.4的步骤进行测定,根据标准曲线计算得到α-环糊精的浓度,然后得出α-环糊精的含量值。
1.6 单因素法优化α-CGTase作用淀粉产α-环糊精条件
1.6.1 底物种类对α-CD产量的影响 取5%浓度的玉米淀粉、马铃薯淀粉、麦芽糊精和可溶性淀粉溶液各100 ml加热溶解,待冷却后,温度30℃,pH为9,加酶量200 U/g淀粉,200 r/min,6 h取出煮沸灭活测α-CD产量。每个梯度做3次,取平均值。
1.6.2 底物浓度对α-CD产量的影响 分别取3%、5%、8%、10%、15%、20%浓度的马铃薯淀粉溶液各100 ml加热溶解,待冷却后,温度30℃,pH为9,加酶量200 U/g淀粉,200 r/min,6 h取出煮沸灭活测α-CD产量。每个梯度做3次,取平均值。
1.6.3 酶添加量对α-CD产量的影响 5%浓度的马铃薯淀粉溶液100 ml,温度为30℃,pH为9,分别加入100、150、200、250、300 U/g马铃薯淀粉的α-CGTase进行反应,200 r/min摇床反应6 h后灭活测α-CD产量。每个梯度做3次,取平均值。
1.6.4 温度对α-CD产量的影响 5%浓度的马铃薯淀粉溶液100 ml,pH为9,加酶量200 U/g马铃薯淀粉,分别在20℃、30℃、40℃、50℃、60℃反应,200 r/min摇床反应6 h后煮沸灭活测定α-CD产量。每个梯度做3次,取平均值。
1.6.5 反应时间对α-CD产量的影响 5%浓度的马铃薯淀粉溶液100 ml加热溶解,待冷却后,温度为30℃,pH为9,加酶量为200 U/g马铃薯淀粉,200 r/min,反应分别进行1、2、4、6、8、10、12、24 h后煮沸灭活测定α-CD产量。每个梯度做3次,取平均值。
1.6.6 pH对α-CD产量的影响 5%浓度的马铃薯淀粉溶液100 ml,温度30℃,加酶量200 U/g马铃薯淀粉,分别在pH为6、7、8、9、10条件下反应,200 r/min摇床反应6 h后煮沸灭活,测定α-CD产量。每个梯度做3次,取平均值。
1.6.7 Mg2+浓度对α-CD产量的影响 5%浓度的马铃薯淀粉溶液100 ml,pH值为9,温度为30℃,加酶量为200 U/g马铃薯淀粉,分别加入终浓度为0~60 mmol/L的镁离子,200 r/min摇床反应6 h后灭酶测定α-CD产量。每个梯度做3次,取平均值。
1.7 响应面法优化产α-环糊精条件
1.7.1 Plackett-Burman实验 根据单因素实验,选取底物浓度、加酶量、温度、时间和pH共5个因素,通过PB实验为响应面实验筛选出酶催化淀粉生成α-环糊精的主要影响因子。
表1 Plackett-Burman实验设计

Tab.1 Experiment design of Plackett-Burman
1.7.2 中心组合确定最佳条件 根据PB实验结果用Design-Expert 8.06软件设计BBD实验并进行分析(表2)(董延娟等, 2016)。
表2 Box-Behnken实验设计

Tab.2 Experiment design of Box-Behnken
2 结果与分析
2.1 α-环糊精的标准曲线
α-环糊精的标准曲线见图1,方程为=0.0373(2=0.9994)。

图1 α-环糊精的标准曲线
2.2 单因素实验设计与分析
2.2.1 底物种类对α-环糊精生产的影响 底物种类对α-环糊精转化率的影响如图2所示。由图2可以看出,可溶性淀粉的环糊精转化率最高,麦芽糊精的转化率最低。马铃薯淀粉的转化率略低于可溶性淀粉。

图2 不同底物对α-CD产量的影响
环糊精可以由环糊精酶作用于不同种类的淀粉、糊精、直链淀粉和支链淀粉产生,得到高转化率环糊精的底物是淀粉。而淀粉是由直链淀粉和支链淀粉组成,由于直链淀粉与脂质容易形成复合物,不易酶活性的作用;支链淀粉有更多的还原端,与直链淀粉相比再生缓慢,以支链淀粉为底物的环糊精产量高于直链淀粉(Pishtiyski, 2006)。马铃薯淀粉的价格比较低,使得生产环糊精的成本降低,因此,本研究中马铃薯淀粉是适合生产环糊精的底物。
2.2.2 底物浓度对α-环糊精生产的影响 底物浓度对环糊精转化率的影响如图3所示。由图3可以看出,当淀粉浓度为5%时,α-环糊精的转化率为25.9%,当淀粉浓度升到10%时,α-环糊精的转化率和5%时相比下降50%,二者相差较大,继续增大底物浓度,转化率降低越明显。可能是因为马铃薯淀粉浓度过大,加热糊化后粘性过大,不利于酶与底物的反应过程。相反,底物浓度越小,环糊精转化率越高,但成本升高,总的产量过低,综合考虑,选用5%的马铃薯淀粉作为生产α-环糊精的淀粉浓度。

图3 底物浓度对α-CD产量的影响
2.2.3 加酶量对α-环糊精生产的影响 图4显示,在一定范围内,α-环糊精的转化率随着加酶量的增加呈现先上升后下降的趋势。当加酶量为200 U/g时,转化率达到最高。
环化反应的逆反应是耦合反应,加酶量的增加,使酶的歧化、耦合反应能力均增强,增加了体系中小分子糖的存在,促进耦合反应的进行,使得α-环糊精向β-环糊精转化,不利于α-环糊精的生产。控制酶的添加量可以有效提高α-环糊精的产量,减少酶的用量也可以降低成本。通过单因素实验,选择200 U/g的加酶量。

图4 酶添加量对α-CD生产的影响
2.2.4 温度对α-环糊精生产的影响 从图5可以看出,不同的温度对转化率的影响比较明显,转化率在30℃时最高,之后随着温度的继续升高,α-环糊精的转化率降低幅度增大。该酶的最适反应温度是 55℃,在40℃以下稳定,高于50℃对酶活影响较大,与实验结果基本保持一致,在不失活的状态下, 30℃时最有利于α-环糊精的生产。

图5 温度对α-CD生产的影响
2.2.5 作用时间对α-环糊精生产的影响 由图6可知,α-环糊精转化率达到最高点的时间为6 h,继续增加反应时间,转化率并没有增高,反而有明显的降低趋势。随着反应时间的加长,酶的其他作用增强,造成α-环糊精的分解。另一方面,反应时间的减少,更有利于节约成本。
2.2.6 pH对α-环糊精生产的影响 通过考察不同pH下α-环糊精的转化率,结果显示(图7),初始pH为9时,转化率最高,此时即为α-环糊精转化的最适反应pH。不同的CGT酶反应的体系的pH值是不同的,大多数是弱碱性或中性介质(Jung, 2007)。有研究表明,底物种类–缓冲液类型对环糊精有重要的作用(Mau, 2007),在此未对缓冲液的类型是否对转化率有一定的影响做进一步的探讨。

图6 反应时间对α-CD生产的影响

图7 pH值对α-CD生产的影响
2.2.7 Mg2+浓度对α-环糊精生产的影响 之前的实验中,Mg2+对酶活性有一定的促进作用,本实验考察反应过程中添加量对反应的影响。由图8可知,由于生产α-环糊精的时间比较短,在一定范围内Mg2+浓度的增减对环糊精的转化率并没有很大的影响,因此,后期实验中不考率金属离子的添加量。
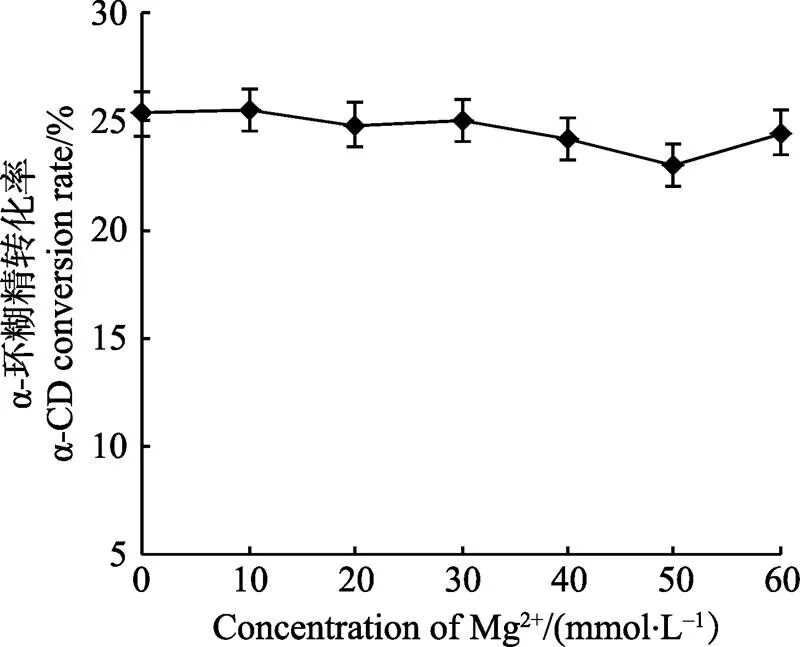
图8 Mg2+浓度对α-CD生产的影响
2.3 响应面实验设计与分析
2.3.1 PB实验结果 用Design-Expert 8.0.6软件对实验结果进行处理,得到PB实验设计分析如表4,底物浓度、温度和pH的值小于0.055为显著,因此,确定三者为酶转化淀粉生产α-环糊精的主要影响因子。
2.3.2 中心组合实验设计与结果 利用Design- Expert 8.06软件对实验结果进行多元回归拟合(表6),发现该模型是显著的,值为506.71表示仅有0.01%的可能是由噪音引起的,其中A、B、C、AC、A2、B2、C2的值均小于0.05,是显著模型项,失拟值为0.96(=0.4921)表示该模型的失拟不显著,因此该模型是合适的。方程的2=0.9985,说明α-环糊精转化率的实测值与预测值的拟合度较好,该模型能较好解释环糊精产率的变化。值越大,表明影响因子对实验指标的影响越大。由方差分析表可得出,FA=369.36,FC=303.67,FB=33.64,即各因素对产物制备的影响程度大小顺序为底物浓度>pH>温度。
表3 PB实验设计及结果

Tab.3 Design and results in PB
表4 PB实验结果分析
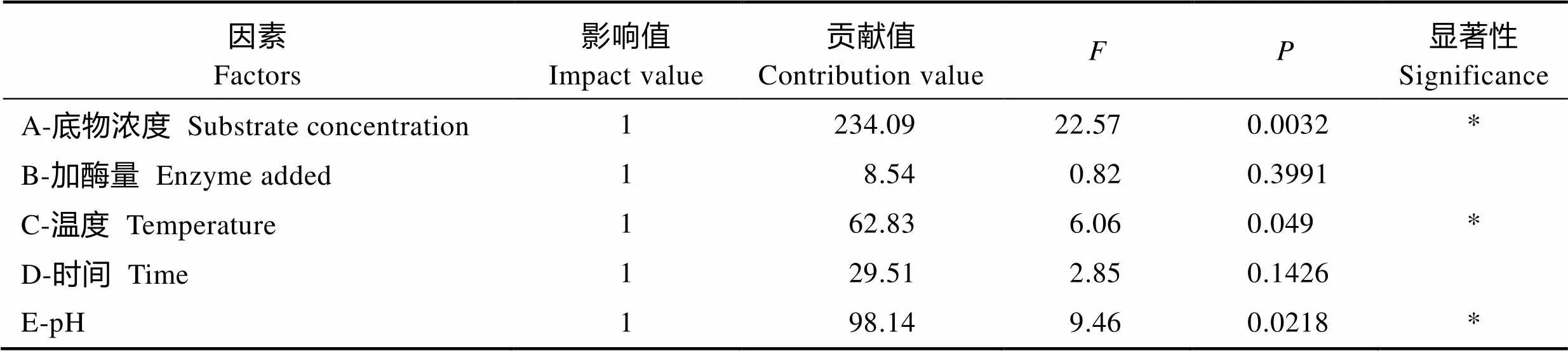
Tab.4 The analysis of the results of PB
“*”表示差异显著(<0.05) * means significant difference (<0.05)
二次多项式回归方程为:
=+28.58–0.91+0.28–0.83+0.012+0.57– 0.13–1.302–2.302–2.762
根据回归方程,做响应面图(图9)。
软件分析得到最大响应值(产量)时A、B、C对应的最佳实验条件为:底物浓度4.61、温度30.2℃、pH=8.4、反应时间6 h,α-环糊精最大预测转化率为28.84%。按照实验筛选出的最佳条件,为方便实验操作,在底物浓度5%、温度30℃、pH=8.4、加酶量200 U/g、反应6 h条件下进行反应,实际转化率为28.67%,与理论值接近。
3 讨论
郭永华等(2016)通过定点饱和突变技术得到CGTase突变体N623T,在酶的最适温度60℃和pH为6.5条件下反应24 h,淀粉总转化率从11.3%提高至39.7%,其中,α-环糊精、γ-环糊精所占比例分别为32.8%和7.7%,α-环糊精的总转化率为13.02%。王琰等(2017)利用重组的α-CGTase酶转化5%的马铃薯淀粉,58℃反应15 h后,环糊精的总转化率可达40.7%,转化生成α-CD、β-CD和γ-CD比例分别为43.6%、41.8%和14.6%,即α-CD的转化率为17.75%。与已报道的产环糊精最高的酶相比(Duan, 2013),菌株Y112产的CGTase酶在碱性环境中更加稳定,反应时间仅为6 h,大大降低了生产成本,且在不添加有机试剂的条件下,转化率可达到28.67%,减小了环糊精的毒性,使得环糊精应用范围更广,特别是医药,食品,化妆等方面,具有不可比拟的优势。
表5 Box-Behnken实验设计及结果

Tab.5 Design of Box-Behnken and results
4 结论
本研究采用单因素实验分析了α-CGTase催化淀粉制备α-环糊精的条件,初步筛选得到的条件为:以马铃薯淀粉溶液为底物,5%的浓度,加酶量200 U/g (淀粉),温度30℃,pH为9,反应时间6 h;利用Plackett-Burman实验设计对影响α-环糊精转化率的5个因素进行筛选,通过分析得知主要影响因素为底物浓度、温度和pH值。采用响应面分析法对α-CGTase转化淀粉制备α-环糊精条件进行优化,得到的最佳转化条件为底物浓度5%、pH 8.4、温度30℃、200 r/min、反应6 h。在最佳条件下制备α-CD转化率均值为28.67%,比优化前的产率提高了2.48倍。
表6 回归模型系数的显著性
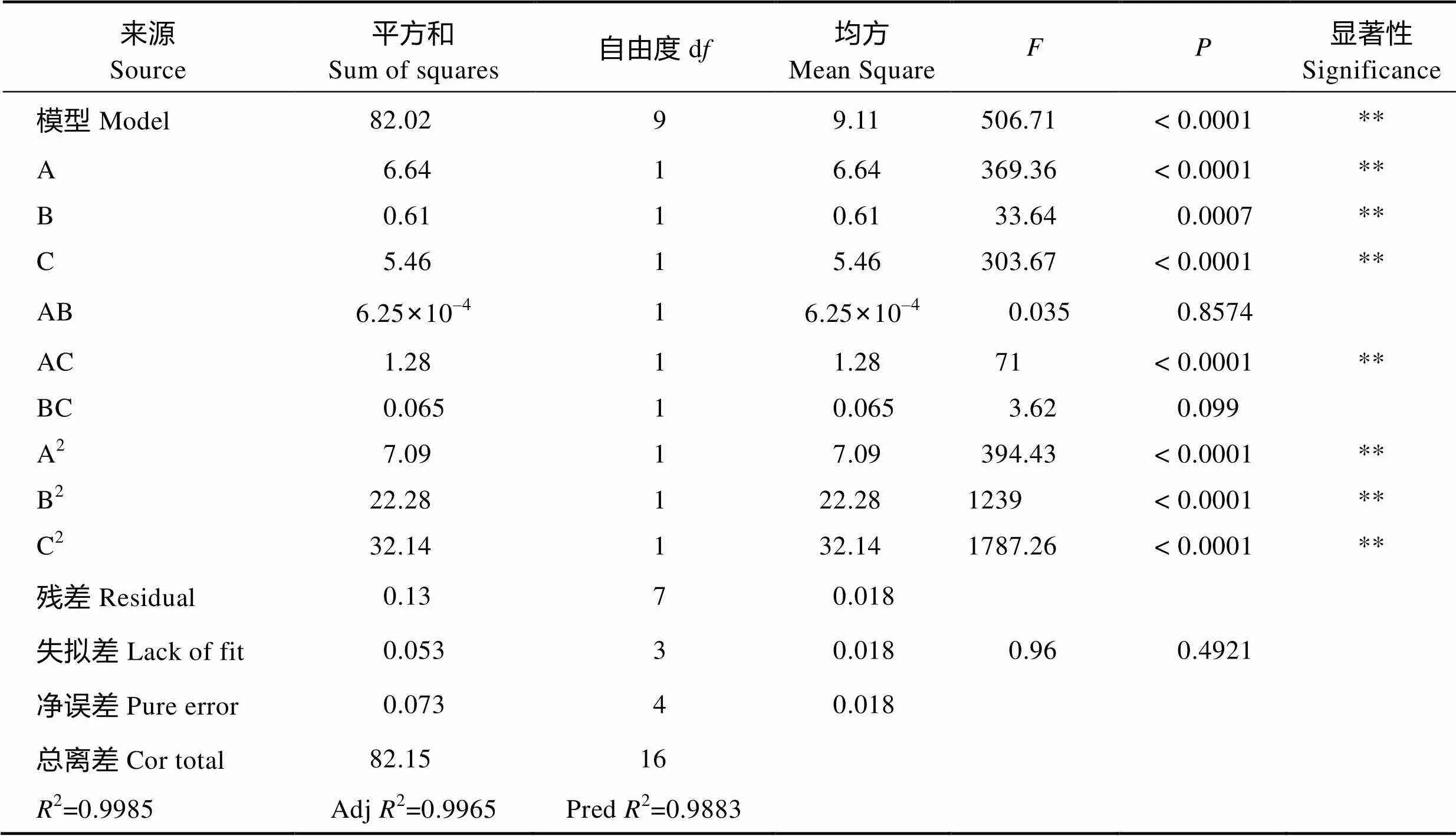
Tab.6 Significance of regression coefficients for the model
“**”表示差异极显著(<0.01) ** means highly significant difference (<0.01)

图9 两两因素交互作用3D图和等高线图
表7 与其他研究成果的比较

Tab.7 Comparison with other research results
Arima H, Motoyama K, Irie T,. Recent findings on safety profiles of cyclodextrins, cyclodextrin conjugates and polypseudorotaxanes. John Wiley & Sons, Inc., Hoboken, 2011, 32: 91–123
Artiss JD, Brogan K, Brucal M,. The effects of a new soluble dietary fiber on weight gain and selected blood parameters in rats. Metabolism, 2006, 55(2): 195–202
Bharat G, Anant P. Alpha-cyclodextrin production using cyclodextrin glycosyltransferase fromAS-22. Starch Starke, 2001, 53(2): 75–83
Biwer A, Antranikian G, Heinzle E. Enzymatic production of cyclodextrins. Applied Microbiology and Biotechnology, 2002, 59(6): 609–617
Dong YJ, Hao JH, Zhang HF,. Optimization of the fermentation conditions for xylanase-producing strain YS1069. Progress in Fishery Sciences, 2016, 37(3): 154–159 [董延娟, 郝建华, 郑鸿飞, 等. 产木聚糖酶菌株YS1069的产酶条件优化. 渔业科学进展, 2016, 37(3): 154–159]
Duan X, Chen S, Chen J,. Enhancing the cyclodextrin production by synchronous utilization of isoamylase and α-CGTase. Applied Microbiology and Biotechnology, 2013, 97(8): 3467–3474
Guo YH, Chen JC, Cai HS,. Saturated mutation effects on catalytic efficiency and product specificity of starch binding site N623 of cyclodextrin glucanotransferase fromsp. CHB1. China Biotechnology, 2016, 36(11): 30–38 [郭永华, 陈济琛, 蔡海松, 等.sp.CHB1环糊精葡萄糖基转移酶淀粉结合位点N623饱和突变对催化效率与产物特异性的影响. 中国生物工程杂志, 2016, 36(11): 30–38]
Jung SW, Kim TK, Lee KW,. Catalytic properties of beta-cyclodextrin glucanotransferase from alkalophilicsp. BL-12 and intermolecular transglycosylation of stevioside. Biotechnology and Bioprocess Engineering, 2007, 12(3): 207–212
Li SJ, Zhou ZR. Application of cyclodextrins in the cosmetic field. Applied Chemical Industry, 2016, 45(10): 1942–1945 [李姝静, 周自若, 邓小锋, 等. 环糊精在化妆品领域中的应用研究. 应用化工, 2016, 45(10): 1942–1945]
Mau GK, Muhammad MN, Osman H,. The effects of reaction conditions on the production of γ-cyclodextrin from tapioca starch by using a novel recombinant engineered CGTase. Journal of Molecular Catalysis, B: Enzymatic, 2007, 9(1–4): 118–126
Pishtiyski I, Zhekova B. Effect of different substrates and their preliminary treatment on cyclodextrin production. World Journal of Microbiology and Biotechnology, 2006, 22(2): 109–114
Valle D, Martin EM. Cyclodextrins and their uses: A review. Process Biochemistry, 2004, 39(9): 1033–1046
Wang Y, Li J, Yang GW,. Study of soluble expression inof-cyclodextringlycosyl transferase produced byandproperties of its derivatives. China Food Additives, 2017(2): 81–86 [王琰, 李皎, 杨国武, 等. 多黏芽孢杆菌产ɑ-环糊精葡萄糖基转移酶在大肠杆菌中的可溶性表达及其转化产物特异性研究. 中国食品添加剂, 2017(2): 81–86]
Zhang HW. Structural characteristics of cyclodextrin and its research status in environmental protection. Environment and Life, 2014(22): 319–320 [张洪伟. 环糊精的结构特性及其在环保领域的研究现状. 环境与生活, 2014(22): 319–320]
Zhang XL, Hao JH, Zhang HF,. Optimized fermentation of α-cyclodextrin glucosyltransferase producing strain. Chinese Journal of Marine Drugs, 2015, 34(5): 63–70 [张晓磊, 郝建华, 郑鸿飞, 等. 1株产α-环糊精葡萄糖基转移酶菌株的产酶条件优化. 中国海洋药物, 2015, 34(5): 63–70]
Zhu Z, Yang M. Evaluation of the effect of high blood fat elimination by alpha cyclodextrin to the clinical biochemical measurement. Sichuan Medical Journal, 2016, 37(9): 1048–1052 [朱征, 杨敏. α-环糊精消除高脂血对临床生化测定影响的效果评价. 四川医学, 2016, 37(9): 1048–1052]
Optimization of Conversion Process of α-Cyclodextrin with Enzyme Using Response Surface Methodology
CHEN Xiaotong1,2, HUANG Liping1,2, SUN Mi1, HAO Jianhua1①
(1. Key Laboratory of Polar Fisheries Development, Ministry of Agriculture and Rural Affairs; Laboratory for Marine Drugs and Bioproducts, Pilot National Laboratory for Marine Science and Technology (Qingdao); Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071; 2. College of Food Sciences & Technology, Shanghai Ocean University, Shanghai 201306)
In order to obtain a higher yield of α-cyclodextrin conversion, we use a single factor experiment and response surface experiment method, to optimize the production of α-cyclodextrin conditions by α-cyclodextrin glucosyltransferase. The enzyme is derived from strain Y112. First, the single factor method was used to screen six factors including substrate species, substrate concentration, enzyme content, reaction time, temperature, and pH. Second, these main variables affecting the conversion of α-cyclodextrin were evaluated with the Plackett-Burman test. The results suggested that substrate concentration, temperature, and pH were the most impactful factors. Finally, the optimal levels of the three factors were determined with central composite design and Design-Expert 8.05 software. The optimum conversion conditions were shown as follows: the concentration of potato starch was 5%, the amount of enzyme 200 U/g (starch), pH 8.4, 200 r/min, reacted at 30℃ for 6 h. Under the optimized conditions, the average value of α-CD conversion was 28.67%, which was an increase of 2.48 times compared with the pre-optimization yield.
α-Cyclodextrin glucosyltransferase; Response surface analysis; α-Cyclodextrin; Conversion process
* 国家重点研发计划(2018YFC0311100)、青岛海洋科学与技术试点国家实验室-鳌山科技计划(2016ASKJ14)和青岛市市南区科技发展计划(2018-4-002-ZH)共同资助 [This work was supported by National Key R&D Program of China(2018YFC0311100), Aoshan Science & Technology Plan of Pilot National Laboratory for Marine Science and Technology (Qingdao) (2016ASKJ14), and Qingdao Shinan Science & Technology Plan (2018-4-002-ZH)]. 陈晓彤,E-mail: cxt1103609717@163.com
郝建华,研究员,E-mail: haojh@ysfri.ac.cn
HAO Jianhua, E-mail: haojh@ysfri.ac.cn
2017-04-27,
2017-08-04
10.19663/j.issn2095-9869.20170427001
陈晓彤, 黄立萍, 孙谧, 郝建华. 响应面分析法优化a-环糊精的酶转化工艺. 渔业科学进展, 2018, 39(5): 143–151 Chen XT, Huang LP, Sun M, Hao JH. Optimization of conversion process of α-cyclodextrin with enzyme using response surface methodology. Progress in Fishery Sciences, 2018, 39(5): 143–151
S932
A
2095-9869(2018)05-0143-09
(编辑 冯小花)
