内蒙古地区马铃薯黑痣病立枯丝核菌融合群及致病性研究
2018-11-12曹春梅王晓娇逯春杏
曹春梅,王晓娇,许 飞,逯春杏,陈 铭
(1.内蒙古农牧业科学院,内蒙古 呼和浩特 010031;2.内蒙古农业大学,内蒙古 呼和浩特 010018;3.内蒙古呼和浩特武川县农业技术推广中心,内蒙古 武川 011700)
马铃薯黑痣病是由立枯丝核菌(Rhizoctonia solani Kuhn)引起的一种土传和种子传播的真菌性病害[1],立枯丝核菌是Kuhn[2]于1858年发现的一个新种,是以菌丝或菌核形态在土壤中习居。该菌的寄主范围广阔,形态特征存在较大的差异,日本的生越明[3]根据立枯丝核菌的形态特征,形成了一套具体而统一的鉴定标准,可准确鉴定立枯丝核菌,这些立枯丝核菌的分类特征在全世界已经获得共识,沿用至今。菌丝融合群(Anastomosis group,简称AG)是指当两个菌株配对培养时,光学显微镜下可观察到菌丝生长和交叠现象[4]。生越明[3]根据菌丝融合的特性建立了立枯丝核菌的菌丝融合群,并根据融合群内不同的融合频率、培养性状、致病性等划分为不同的亚群。到1999年,已报道的立枯丝核菌被分为14个菌丝融合群,即AG-1~AG-13和AG-BI[5]。
侵染马铃薯引起黑痣病的立枯丝核菌,在不同国家和地区病原菌的融合群也有所不同,Balali等[6]报道侵染澳大利亚马铃薯黑痣病的融合群为AG-3、AG-4和AG-5,分别占90%、7%和2%。Yanar等[7]研究鉴定出土耳其侵染马铃薯黑痣病有11个融合群,其中AG-3占83.9%,AG-2-1占5.6%,其他融合群分离到的菌株比例不到5%。Campion等[8]和Bandy等[9]研究发现,从来自美国和法国的马铃薯黑痣病上分离得到AG-3,AG-5和AG-2-1融合群。Virgen-Calleros等[10]对墨西哥马铃薯黑痣病进行调查,发现优势融合群为AG-3,占73.5%,AG-4占26.5%。Yang和Wu[11,12]分离甘肃、黑龙江和吉林黑痣病,分别得到融合群AG-4-HG-II,AG-5和AG-A。王宇[13]从内蒙古和河北马铃薯黑痣病病样分离得到AG-1-IB,AG-2-1, AG-3, AG-4-HG-I, AG-4-HG-II,AG-4-HG-III,AG-5,AG-9和AG-A共9个融合群。田晓燕等[14]从内蒙古马铃薯黑痣病病样中分离得到融合群AG-3占86.36%,AG-1-IB占2.27%,非融合类占11.36%。
近年来,随着中国马铃薯面积的不断扩大以及种植效益的不断提高,重迎茬问题在马铃薯种植区较为普遍,由此导致马铃薯黑痣病普遍发生,且逐年加重[15,16]。据2015年内蒙古中西部马铃薯主产区调查,一般马铃薯田块黑痣病发病率在30%~40%,严重的薯田发病率高达90%~100%。为了防止病害发生,种植者不断加大化学药剂施用量,不仅增加投入,更加剧对环境的污染,黑痣病已经成为内蒙古马铃薯产业发展的一大障碍。因此,本研究将针对内蒙古中西部马铃薯主产区开展黑痣病立枯丝核菌病原菌菌株分离、形态鉴定、病原菌生长速度测定、菌丝融合观察及病原菌致病性等工作,以期明确内蒙古中西部地区马铃薯黑痣病立枯丝核菌种内分化情况、生长情况、融合群间致病力情况以及各地区融合群分布情况,为内蒙古地区马铃薯黑痣病的抗病育种及病害有效防治提供依据。
1 材料与方法
1.1 供试材料
融合群5个标准菌株:AG-1-IA,AG-1-IB,AG-2-1,AG-2-IIIB和AG-3。
采集于内蒙古中西部马铃薯主产区120个不同地点的148份菌株。
1.2 马铃薯黑痣病立枯丝核菌病原菌的分离、纯化和鉴定方法
从内蒙古15个马铃薯主产旗县的120个地区采集了马铃薯黑痣病典型症状的新鲜病害标本进行分离、纯化、鉴定(菌株来源见表1)。从田间取回的带有褐色溃疡病斑的病茎或带有棕褐色菌核的块茎用流水冲洗,除去表面脏物,用手术刀取下溃疡斑和健康茎部交界处的边长0.5~0.7 cm的小方块或菌核进行表面消毒,先放入75%的酒精中3~5 s,再放入0.1%HgCl2中浸泡2~3 min,取出用无菌水冲洗3~5遍,放在3层无菌滤纸上吸干水分,再放入PDA培养基中,每皿放入2~3个病块或菌核,封口,放到25℃恒温培养箱中黑暗培养48 h后,发现有菌丝长出,即在超净工作台无菌环境下,挑取菌丝尖端,移入PDA培养基中继续纯化培养,对疑似立枯丝核菌的菌株经过镜检和形态学鉴定,确认为马铃薯黑痣病病原菌。鉴定为黑痣病的菌株合计148份保存备用。
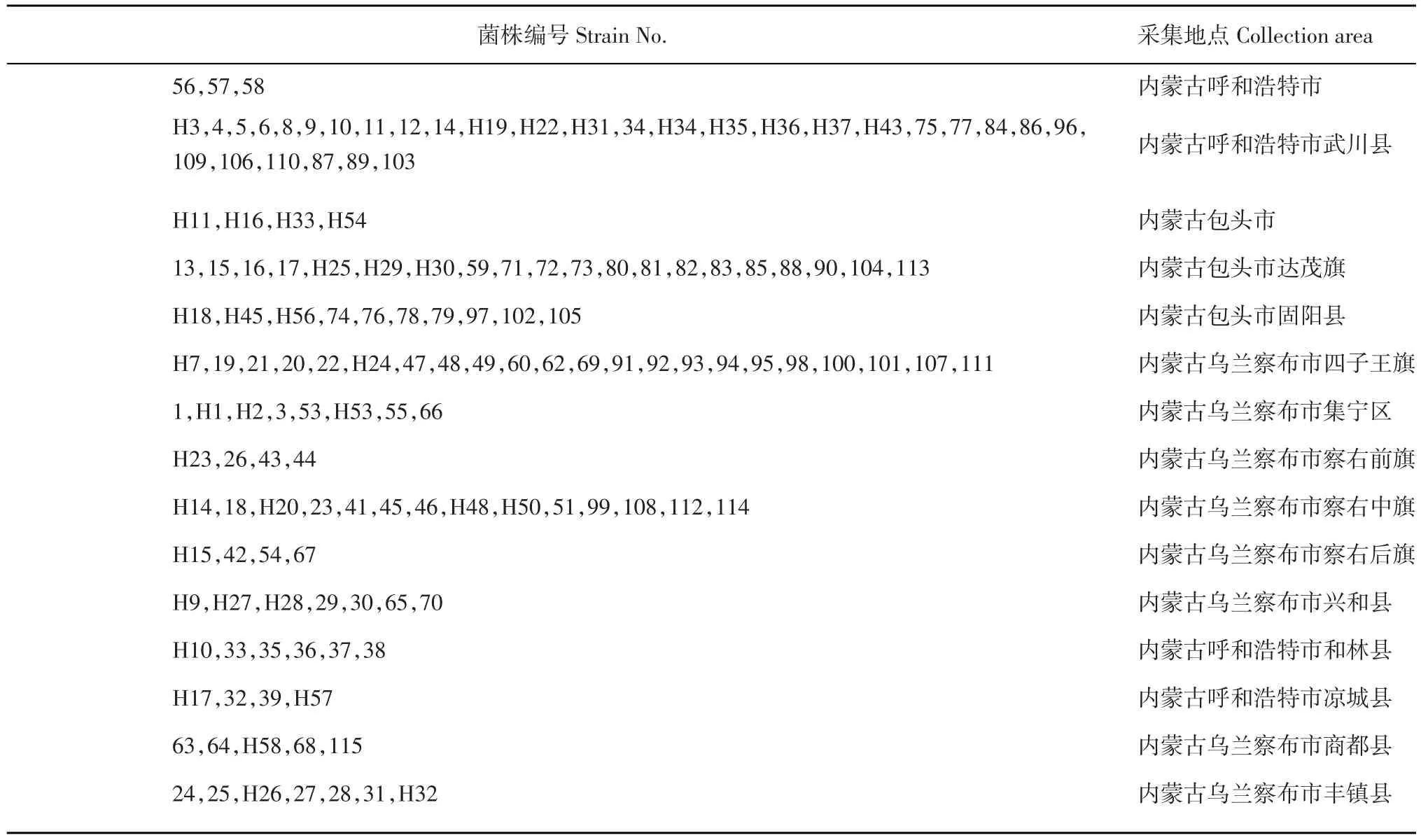
表1 黑痣病菌株编号及采集地点Table 1 Rhizoctonia solani strains isolated from potatoes in different areas
1.3 马铃薯黑痣病立枯丝核菌病原菌生长速度测定
将保存备用的马铃薯黑痣病立枯丝核菌菌株148个进行活化,活化后,在无菌的条件下,用打孔器打出直径为5 mm的待测菌株菌饼,接种到直径为90 mm的PDA培养基平板的正中央,每个菌株做3个重复,然后将培养皿放在温度为25℃的培养箱中黑暗培养,记录培养时间、测量菌落的直径、计算生长速度。
1.4 马铃薯黑痣病立枯丝核菌融合群鉴定
选取具有地域代表性的马铃薯黑痣病(立枯丝核菌)病原菌61份,与已知融合群的标准菌株:AG-1-IA,AG-1-IB,AG-2-1,AG-2-IIIB和AG-3共5个菌株进行融合鉴定。
鉴定方法参照陈延熙等[17]玻片对峙法,本研究略加改进,将待测定的61份黑痣病菌株与5个标准菌株分别配对培养。具体方法如下:活化待测菌株与标准菌株,同时置于25℃恒温箱黑暗培养48 h后,在菌落边缘用打孔器取直径5 mm的菌饼,将无菌载玻片上涂满一薄层水琼脂培养基凝固后,挑取标准菌株菌饼置于载玻片中央,再把同一个待测菌株的两个菌饼分放两侧,与标准菌株相间1.5~2.0 cm,然后将载玻片放入无菌培养皿内,25℃黑暗恒温培养36~48 h,重复试验3次。待测定菌株与标准菌株的菌落前端生长相遇,观察交叠至5 mm时,直接显微镜下镜检二者菌丝融合情况。
融合群的鉴定标准如下:
A.完全融合:接触后细胞间细胞壁溶解,细胞质融合,互有引诱现象,细胞质、细胞核流入另一细胞内,属于同一菌株内的菌丝融合。
B.不完全融合:接触后细胞间细胞壁溶解,造成另一细胞发生畸形,原生质减少或消失,细胞壁溶解后死亡,属于同一融合群内不同菌株间融合。
C.完全不融合:接触后细胞壁不融合,没有异常反应,各菌丝按原来方向继续生长,互不干扰,属于不同菌丝融合。
1.5 不同融合群立枯丝核菌致病力的测定
选取具有地域代表性的生长速度不同、融合群种类不同的9个菌株进行致病力测定(表2),寄主为马铃薯,品种为‘克新1号’原原种。测定方法:将选用的菌株分别培养在PDA平板培养基上,25℃恒温条件下培养15 d,每个菌株培养3皿,作为接种体。采用盆栽种植马铃薯,接菌采用土壤拌菌法,3 kg高温灭菌土壤与培养好的3皿菌株均匀搅拌后放入营养钵,‘克新1号’原原种用0.5%的高锰酸钾表面消毒10 min,每盆5粒原原种,播种深度10 cm,另用不接菌作对照,每个处理4次重复。培养期间定期定量加水保持土壤湿度,温室内培养,温度控制在18~28℃,生长90 d后,根据曹春梅等[18]和张春艳等[19]的病情分级标准,调查发病情况,计算病情指数。试验过程中除了菌种以外其他条件均保持一致。
黑痣病薯块分级标准如下:
0:无病斑;
1:病斑小,病部面积占整个薯块面积的5%以下;
3:病斑较小,病部面积占整个薯块面积的5%~10%;
5:病斑较小或个别较大,病斑面积占整个薯块的11%~25%;
7:病斑大小均有分布,病斑面积占整个薯块面积的26%~50%;
9:病斑大小均有分布,病部面积相连占整个薯块面积的51%以上。
病情指数=∑(各级病块茎数×相对级数值/调查总块茎数×9)×100
2 结果与分析
2.1 马铃薯黑痣病立枯丝核菌病原菌的分离、纯化和鉴定
对从内蒙古中西部地区采集到的148份马铃薯黑痣病病样进行了分离鉴定,通过镜检、形态学测定,分离到的148份菌株均具有立枯丝核菌的分类特征:菌丝生长速度较快,不产生分生孢子,主枝与侧枝呈直角或锐角,且分枝处有明显缢缩现象,近分枝处有隔膜,菌丝细胞无锁状联合等(图1),因此将分离得到的菌株鉴定为立枯丝核菌。
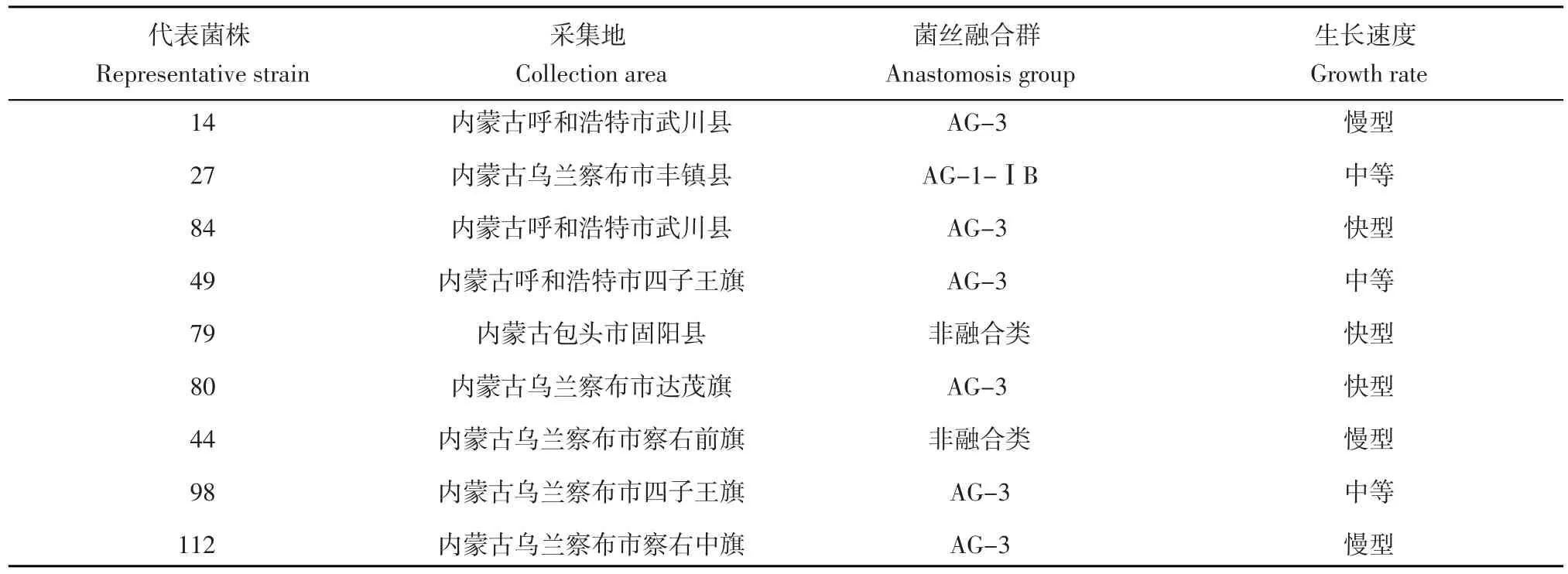
表2 马铃薯黑痣病立枯丝核菌菌株Table 2 Selections of R.solani strains

图1 供试菌株形态Figure 1 Morphologic traits of R.solani strain
2.2 马铃薯黑痣病立枯丝核菌病原菌生长速度
测定了148株马铃薯黑痣病立枯丝核菌病原菌在PDA上的生长速度(mm/h)。根据测定的菌株在PDA上平均生长速度,采用欧氏距离按非加权组平均法(UPGMA)进行菌株生长速度聚类分析,如图2所示,148个菌株被划分为生长速度慢、中等和快3种类型。其中病原菌生长速度为慢类型的菌株28株,占测定菌株的18.92%,菌株生长速度在0.180~0.400 mm/h,平均生长速度为0.333 mm/h;生长速度为中等类型的菌株58株,占测定菌株的39.19%,菌株生长速度在0.410~0.524 mm/h,平均生长速度为0.467 mm/h;生长速度为快类型的菌株62株,占测定菌株的41.89%,菌株生长速度在0.528~0.692 mm/h,平均生长速度为0.610 mm/h。结果表明,马铃薯黑痣病立枯丝核菌病原菌的生长速度是不同的,从内蒙古中西部地区采集的黑痣病病原菌以中、快生长速度类型为主。
2.3 马铃薯黑痣病立枯丝核菌融合群
选用的61株马铃薯黑痣病立枯丝核菌菌株,与5株标准菌株分别进行菌丝融合群鉴定。鉴定结果,最终将61株立枯丝核菌菌株分为3个类群:AG-1-IB为4个,其中1株为不完全融合,其余3株完全融合,AG-1-IB融合群所占比例为6.56%;AG-3为45个,其中6株不完全融合,其余39株均为完全融合,AG-3所占比例较高为全部菌株的73.77%;AG-2为3个,都是不完全融合,占4.92%;非融合类9个(均不与5株标准菌株融合),所占比例为14.75%。从测定的61株菌株结果得出,内蒙古各地区的马铃薯黑痣病立枯丝核菌的优势融合群为AG-3。菌丝之间融合与否的具体表现如图3、图4、图5所示。
2.4 不同融合群立枯丝核菌致病力
接种供试菌株90 d后,调查块茎的病情指数。不同融合群的马铃薯黑痣病病原菌进行人工接种致病力测定,结果表明供试菌株都可侵染马铃薯,在马铃薯块茎上出现典型的黑痣病症状,不接菌的对照无任何症状,但生长速度不同、融合群不同的病原菌菌株致病力强弱不同(表3),生长速度不同的病原菌,致病力出现明显差异,编号84的菌株为快速生长型,侵染马铃薯的病情指数为55.56,为强致病菌株,编号44的菌株为慢速生长型,侵染马铃薯的病情指数为19.19,为弱致病菌株;同一生长速度类型的菌株,致病能力也不相同,出现明显差异,在慢型中,编号112的菌株侵染马铃薯的病情指数为32.32,为中等致病菌株,编号44的菌株侵染马铃薯的病情指数为19.19,为弱致病菌株;不同融合群的病原菌,致病力不同,出现明显差异,编号14的菌株,属于AG-3融合群,侵染马铃薯的病情指数为28.91,为弱致病菌株,编号27的菌株,属于AG-1-IB融合群,侵染马铃薯的病情指数为46.25,为强致病菌株;同一融合群的菌株,致病能力也不相同,出现明显差异,同是AG-3融合群的编号为49和44的菌株,编号49的菌株侵染马铃薯的病情指数为32.03,为强致病菌株,编号为44的菌株侵染马铃薯的病情指数为19.19,为弱致病菌株。从试验结果可以看出生长速度相同与不同、融合群相同与不同立枯丝核菌致病能力都是不相同的,存在显著差异,表明内蒙古各地区马铃薯黑痣病病原菌侵染能力的多样性。

图2 148株马铃薯黑痣病立枯丝核菌病原菌生长速度的欧氏距离非加权组平均法(UPGMA)聚类图Figure 2 UPGMA using arithmetic means cluster of 148 Rhizoctonia solani strains,constructed with a Euclidean distance algorithm based on means of growth rate
图3 完全融合Figure 3 Complete fusion of two mycelia

图4 不完全融合Figure 4 Incomplete fusion of two mycelia

图5 完全不融合Figure5 Non-fusion of two mycelia
2.5 马铃薯黑痣病立枯丝核菌菌株生长速度与致病力之间的关系
对内蒙古中西部地区马铃薯黑痣病立枯丝核菌菌株的生长速度和致病力进行相关性分析,通过直线相关分析,得到拟合的直线相关方程为:Y=542.7X+8.759,Y代表菌株的病情指数,X代表菌丝生长速度,决定系数为0.286,说明菌丝的生长速度与致病力两者之间存在一定正相关性(图6)。从分析结果可见,菌株的致病力与其生长速度快慢存在一定的关系,除此之外还可能与菌株的其他因素有关。
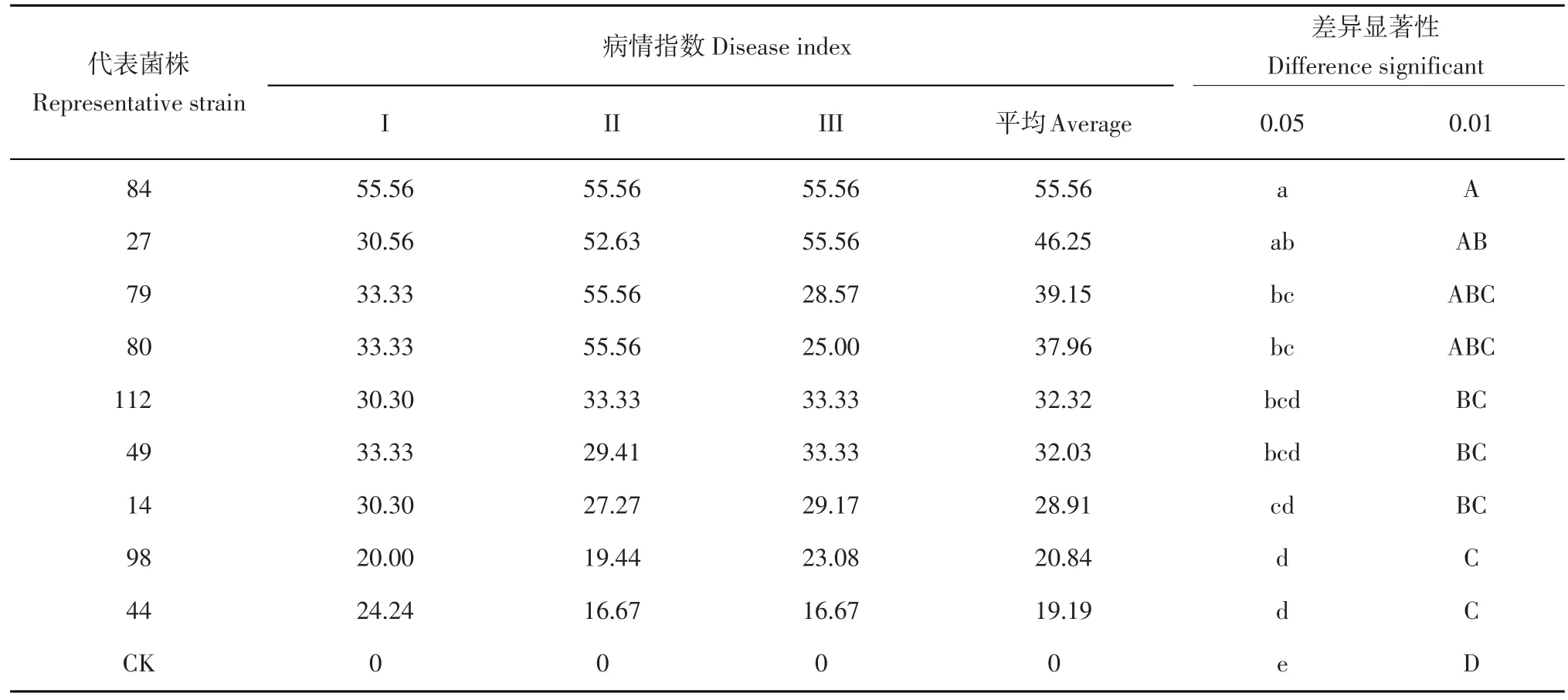
表3 不同菌株致病力测定Table 3 Pathogenicity of different strains
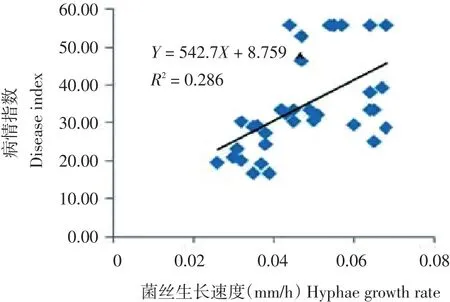
图6 马铃薯黑痣病立枯丝核菌菌丝生长速度与其致病力的相关分析Figure 6 Correlation analysis of Rhizoctonia solani growth rates and disease index
3讨 论
本研究发现,在内蒙古中西部地区采集到的148份马铃薯黑痣病立枯丝核菌各菌株生长速度不同,出现差异,根据生长速度进行聚类分析发现,可分成3类,快速生长型,中速生长型和慢速生长型。不同地区病原菌生长速度不同,在武川地区分离到的30个菌株,9个为快速生长型,13个为中速生长型,8个为慢速生长型,且发现不同生长速度,致病力不同,根据生长速度和致病力进行相关性分析,发现致病力与菌丝生长速度具有一定的正相关性。了解一个地区病原菌生长状态的分布情况,对于预防和防治病害发生具有一定指导意义。
由于病样标本的来源或发生地不同,马铃薯黑痣病病原菌种类构成存在一定的差异性。本研究发现,在内蒙古中西部地区采集的菌株存在融合群AG-1-IB,AG-2,和AG-3,其中AG-3出现频率最高,占总数的73.77%,为优势融合群,融合群AG-1-IB占6.56%,融合群AG-2占4.92%,这与田晓燕等[14]报道内蒙古黑痣病菌存在AG-3和AG-1-IB两个融合群基本一致。但张春燕等[19]研究发现内蒙古地区马铃薯黑痣病菌中共存在8个融合群及亚群,分别为AG-1-IB,AG-2-1,AG-3, AG-4-HG-II, AG-4-HG-III, AG-5,AG-9及AG-A,其中AG-3,占77.06%,为优势菌群。在本研究中存在14.75%非融合群,不与标准菌株融合,可能属于其他融合群,但本实验室没有相应标准菌株,还需进一步研究。在国内,Yang和Wu[20]、Yang等[21]报道,马铃薯黑痣病菌存在 AG-4-HG-II,AG-5,AG-A,AG-K,AG-F,AG-I和AG-U融合群。在国外,Woodhall等[22]报道英国存在AG-2-1,AG-3和AG-5融合群。Balali等[6]发现澳大利亚的黑痣病菌融合群为AG-3,AG-4和AG-5。Yanar等[7]在土耳其发现存在 AG-1,AG-2,AG-3,AG-5,AG-6,AG-8,AG-9,AG-10,AG-12和AG-13共10个融合群,其中AG-3占总数的83.9%,为优势融合群。国内外研究均表明,马铃薯黑痣病菌融合群构成多样,但优势融合群仍为AG-3,本研究结果与其一致。在不同国家和地区,马铃薯黑痣病菌融合群存在不同,可能与地域环境或种植品种不同有关,具体原因需进一步研究。
马铃薯黑痣病立枯丝核菌不同融合群对马铃薯的致病力存在明显差异。Yanar等[7]研究发现AG-3对马铃薯的致病力最强,其次是AG-4和AG-5,AG-2-1,AG-9和AG-1-IB最弱,而AG-A不致病。Chand和Logan[23]发现在北爱尔兰的马铃薯上分离得到AG-3和AG-2-1融合群,并证明AG-3较AG-2-1有更强的致病性。EI Bakali等[24]首次报道在西班牙地区,AG-3融合群为该地区马铃薯黑痣病的主要致病类群。王宇[13]研究发现在内蒙古和河北两省分离的9个融合群中AG-3为主要致病群。本试验将内蒙古中西部地区马铃薯黑痣病立枯丝核菌分为AG-1-IB,AG-2和AG-3 3个融合群,其中AG-3为优势菌群,可能是引发黑痣病的主要菌群,这一点值得抗病育种专家加以重视。研究还发现同一融合群AG-3中的不同菌株的致病力不同,说明马铃薯黑痣病立枯丝核菌致病力发生分化。从达茂旗同一块田地里分离到的菌株编号13和H29,分别属于AG-3和AG-2,说明同一块田里存在不同的立枯丝核菌融合群,反映了马铃薯黑痣病立枯丝核菌的多样性、丰富性以及融合群间关系的复杂性,所以在生产中应加强对马铃薯黑痣病菌不同融合群动态变化的监测,才可有效预防和防治马铃薯黑痣病的发生。
