TGF-β1对AngⅡ作用后的心肌细胞表面积和心钠素合成影响
2018-11-09聂明金培印
聂明,金培印
心肌缺血、高血压等心血管系统疾病的发生与心肌肥厚有关,是心脏受到多种刺激以后产生的一种代偿性的反应,是猝死、心力衰竭等发生的危险因素,肾素-血管紧张素系统是心室肥厚发生的重要原因,而血管紧张素Ⅱ(AngⅡ)是肾素-血管紧张素系统中重要的促心肌细胞肥大因子[1,2]。转化生长因子β1(TGF-β1)具有广泛的生物学作用,其是生长因子超家族中的一员,在胚胎发育、免疫反应、肿瘤发生等过程中具有重要作用[3,4]。近年来的研究显示,TGF-β1参与心力衰竭发生,在心力衰竭大鼠模型中表达升高,并且可以调控细胞的生长、凋亡等过程,在心肌纤维化和细胞外基质的异常增多等过程中发挥关键作用[5,6]。本实验拟通过体外分离培养乳鼠心肌细胞,探讨TGF-β1在AngⅡ诱导的心肌肥大中的作用,并对其作用机制进行初步探讨。
1 资料与方法
1.1 研究对象和分组出生72 h的SD乳鼠由华中科技大学同济医学院动物实验室提供;参照文献[7],取出生72 h的SD乳鼠,用乙醚麻醉以后,取出心脏,用眼科剪把心肌组织剪碎(<1 mm3),添加5倍体积的消化酶(0.125%胰蛋白酶+0.04%的EDTA),混合后,在提前预热的37℃的水浴中消化5 min。静置3 min,把上清吸除。在沉淀中加入5倍体积的0.1%的Ⅰ型胶原酶,继续在37 ℃的水浴中消化5 min。吸取上清,加入到15%胎牛血清的DMEM中,重复用Ⅰ型胶原酶消化直至组织消化完全。将消化后的所有上清以1200 g离心10 min,在细胞沉淀中加入PBS洗涤2次。用15%胎牛血清的DMEM悬浮细胞,按照约106个细胞/ml种植到细胞瓶中,贴壁差1 h分离心肌细胞。心肌细胞经α-actin免疫组化测定分离的心肌细胞纯度超过95%。原代的心肌细胞分为5组,分别为:对照组、AngⅡ组、实验1组、实验2组、实验3组。AngⅡ组、实验1组、实验2组、实验3组在实验0 h时在细胞培养液中添加0.1 μmol/L的AngⅡ;实验1组、实验2组、实验3组在实验0 h时同时在细胞培养液中添加20、30、40 μmol/L的TGF-β1抑制剂SB431542;对照组为常规条件下培养的原代心肌细胞。
1.2 主要试剂TGF-β1抑制剂SB431542购自美国Selleck;胰蛋白酶、AngⅡ、Ⅰ型胶原酶购自美国Sigma;一氧化氮(NO)含量测定试剂盒购自上海翊圣生物;TRIZOL裂解试剂购自上海碧云天;TGF-β1、甘油醛-3-磷酸脱氢酶(GAPDH)引物为上海生工合成;B细胞淋巴瘤/白血病-2(Bcl-2)一抗、smad2一抗购自美国PL Laboratories;二喹啉甲酸(BCA)蛋白定量试剂盒购自北京博凌科为;心钠素含量测定试剂盒购自北方免疫试剂研究所;辣根过氧化物标记的二抗购自北京百奥莱博。
1.3 AngⅡ作用后的心肌细胞中TGF-β1 mRNA表达测定取心肌细胞,按照对照组和AngⅡ组方法分别处理48后,用TRIZOL提取各组心肌细胞中的RNA,测定RNA的A260/A280的比值处于1.8~2.0之间。逆转录合成cDNA后进行RT-PCR。TGF-β1上游引物(5,-3’)CTGGCGATACCTCAGCAAC,下游引物(5,-3’)TAAGGCGAAAGCCCTCAAT。G A P D H上游引物(5,-3’)CCTGCACCACCAACTGCTTAG,下游引物(5,-3,)CAGYCTTCTGGGTGGCAGTGA。2-△△Ct法以GAPDH为内参分析TGF-β1水平。
1.4 AngⅡ作用后的心肌细胞中TGF-β1蛋白表达测定取心肌细胞,按照对照组和AngⅡ组方法分别处理48 h后,收集各组细胞,按照1000 g离心10 min,加入PBS洗涤2次,每次洗完以后1000 g离心10 min。再加入细胞裂解液,把细胞放在冰上孵育15 min。低温4 ℃离心5 min,转速为12 000 g,收集上清保存在-20 ℃冰箱中。待测蛋白样品用BCA法定量,用Loading buffer煮沸变性以后,每个泳道内添加50 μg的样品,100 V电泳至溴酚蓝距离底部2 cm处停止电泳。转膜:电压为90 V,电转时间为90 min。封闭:在室温,用5%脱脂奶粉封闭1 h。把TGF-β1一抗按照1:600稀释,将膜放在稀释后的一抗中,在4 ℃过夜。把二抗按照1:3000稀释以后,把膜放在稀释后的二抗中,在室温孵育60 min。显色,光密度扫描仪对蛋白进行定量,GAPDH为内参。
1.5 细胞表面积检测对照组、AngⅡ组、实验1组、实验2组、实验3组细胞分别培养48 h以后,随机选取5个视野,每个视野选取10个细胞,用SimplePCI软件检测细胞的表面积,取均值。
1.6 心钠素合成检测用免疫放射法测定心肌细胞中心钠素的表达。对照组、AngⅡ组、实验1组、实验2组、实验3组细胞分别培养48 h以后,收集培养液上清,与4 ℃预冷的7.5%的EDTA二钠、抑肽酶混合后,在-20 ℃保存。按照心钠素含量测定试剂检测样品中的心钠素的含量。
1.7 心肌细胞蛋白含量检测对照组、AngⅡ组、实验1组、实验2组、实验3组细胞分别培养48 h以后,消化细胞,对细胞进行计数,提取细胞蛋白,用蛋白含量测定试剂盒测定蛋白含量,计算每个细胞中蛋白含量。
1.8 NO含量测定对照组、AngⅡ组、实验1组、实验2组、实验3组细胞分别培养48 h以后,收集培养液上清,以硝酸还原法测定样品中的NO含量,步骤参照试剂盒说明书。
1.9 Western blot测定Bcl-2、smad2蛋白水平对照组、AngⅡ组、实验1组、实验2组、实验3组细胞分别培养48 h以后,按照上述材料与方法5中Western blot法测定各组心肌细胞中Bcl-2、smad2蛋白水平。
1.10 统计学分析实验重复3次,取均值。所有实验数据用SPSS 21.0统计分析,计量资料用平均数±标准差(±s)表示,两组数据用独立样本t检验,多组差异之间的比较用单因素方差,组间比较用SNK-q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 AngⅡ作用后的心肌细胞中TGF-β1的表达
从图1和表1可以看出,心肌细胞经过AngⅡ处理后细胞中的TGF-β1 mRNA和蛋白水平均明显升高,说明AngⅡ诱导心肌细胞中TGF-β1的转录和表达。
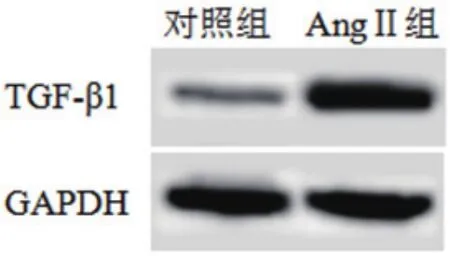
图1 Western blot测定AngⅡ作用后的心肌细胞中TGF-β1蛋白水平(TGF-β1:转化生长因子β1;GAPDH:甘油醛-3-磷酸脱氢酶)
2.2 TGF-β1抑制后对AngⅡ诱导的心肌细胞肥大的影响从表2可以看出,AngⅡ作用后的心肌细胞表面积明显增加,并且心肌细胞合成的心钠素水平也明显升高,心肌细胞蛋白含量也明显升高,而心肌细胞合成的NO含量下降。用不同浓度的TGF-β1抑制剂作用后的心肌细胞表面积有所降低,细胞合成的心钠素减少,心肌细胞蛋白含量也下降,心肌细胞合成的NO水平升高。AngⅡ诱导心肌细胞肥大,减少NO合成,而TGF-β1抑制剂可以呈浓度依赖的拮抗AngⅡ诱导的心肌细胞肥大,促进NO合成。
表1 AngⅡ作用后的心肌细胞中TGF-β1蛋白水平(±s)
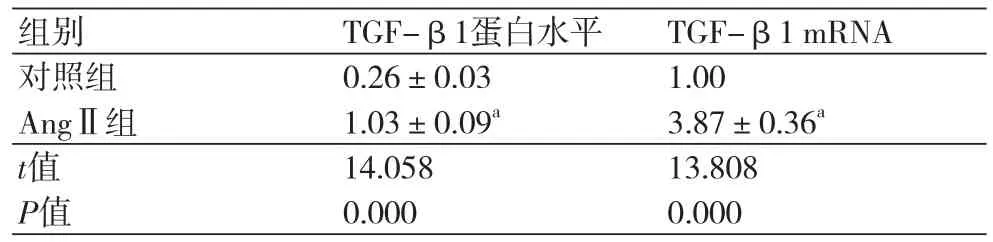
表1 AngⅡ作用后的心肌细胞中TGF-β1蛋白水平(±s)
注:AngⅡ:血管紧张素Ⅱ;与对照组相比,aP<0.05;TGF-β1:转化生长因子β1
组别 TGF-β1蛋白水平 TGF-β1 mRNA对照组 0.26±0.03 1.00 AngⅡ组 1.03±0.09a 3.87±0.36a t值 14.058 13.808 P值 0.000 0.000
2.3 TGF-β1抑制后对AngⅡ诱导的心肌细胞凋亡影响从图2和表3可以看出,AngⅡ作用后的心肌细胞凋亡率升高,而用不同浓度的TGF-β1抑制剂作用后的心肌细胞凋亡率下降。AngⅡ诱导心肌细胞凋亡,而TGF-β1抑制剂可以呈浓度依赖的减弱AngⅡ诱导心肌细胞凋亡作用。
2.4 TGF-β1抑制后对AngⅡ作用后的心肌细胞中Bcl-2、smad2蛋白表达影响从图3和表4可以看出,AngⅡ作用后的心肌细胞中Bcl-2蛋白水平下降,smad2表达增多,而用不同浓度的TGF-β1抑制剂作用后的心肌细胞中Bcl-2蛋白表达增多,smad2表达减少。TGF-β1抑制剂可以呈浓度依赖的拮抗AngⅡ对心肌细胞中Bcl-2、smad2表达影响。
表2 各组细胞表面积、蛋白含量及合成心钠素、NO水平比较(±s)

表2 各组细胞表面积、蛋白含量及合成心钠素、NO水平比较(±s)
注:AngⅡ:血管紧张素Ⅱ;NO:一氧化氮;与对照组相比,aP<0.05;与AngⅡ组相比,bP<0.05;与实验1组相比,cP<0.05;与实验2组相比,dP<0.05
组别 细胞表面积(μm2) 心钠素(ng/ml) 心肌细胞蛋白含量(pg) NO(μmol/L)对照组 1554.32±116.25 398.24±33.26 413.25±25.18 14.36±1.20 AngⅡ组 3351.26±235.68a 816.36±55.91a 984.61±65.87a 7.61±0.74a实验1组 2863.15±121.57b 632.17±28.65b 846.28±88.36b 12.31±1.24b实验2组 2361.87±237.29bc 538.64±33.28bc 746.32±69.97bc 14.59±1.47bc实验3组 1964.23±134.68bcd 461.97±27.86bcd 589.27±63.89bcd 18.72±1.83bcd F值 47.955 57.689 34.084 27.096 P值 0.000 0.000 0.000 0.000
3 讨论
近年来,随着对心肌肥厚的不断研究,人们逐渐发现心肌重塑是心力衰竭发生的重要原因,在心肌重塑过程中常常伴随着心肌细胞过度凋亡、心肌细胞肥大等病理学变化,这些病理变化可以引发心室容量异常增加、心室形状异常等现象,造成心肌损伤[8]。TGF-β1是一种在血小板中发现的效应因子,是TGF-β异构体中的一种,在人体内广泛表达,其具有诱导细胞外基质的形成、降低免疫反应等作用[9]。TGF-β1参与人体的多种慢性纤维性疾病的发生,如肾小球肾炎、肺纤维化、类风湿性关节炎、心肌纤维化等,TGF-β1过度表达是多种慢性纤维性疾病发生的重要原因[10,11]。最近的研究表明,TGF-β1在心力衰竭中高表达,且与心肌肥厚有关[12,13]。本实验结果表明,AngⅡ处理后的心肌细胞中的TGF-β1 mRNA和蛋白水平均升高,这与上述实验报道相一致,都说明TGF-β1与心肌肥厚有关。
心肌肥厚与心肌细胞肥大有关,而心肌细胞肥大主要表现为心肌细胞表面积增大和心钠素合成增多,心钠素是心肌细胞的胚胎基因,在心肌肥厚组织中表达增多[14]。NO具有调控心室重构的作用,能够传导细胞信号和调控血管舒张,具有保护心肌组织的功能,其在心力衰竭心肌组织中水平下调[15]。很多研究报道表明,AngⅡ能够诱导心肌细胞表面积增加,心钠素合成增加,促进心肌细胞肥大的发生[16]。本实验结果表明,AngⅡ处理后的心肌细胞合成的NO水平降低,心钠素合成增加,细胞表面积增加,细胞中的蛋白含量增加,而TGF-β1抑制剂可以逆转AngⅡ诱导的心肌细胞肥大,促进细胞合成NO,抑制TGF-β1具有保护心肌组织的作用。

图2 TGF-β1抑制剂对AngⅡ作用后的心肌细胞凋亡影响
表3 各组细胞凋亡率比较(±s)

表3 各组细胞凋亡率比较(±s)
注:AngⅡ:血管紧张素Ⅱ;与对照组相比,aP<0.05;与AngⅡ组相比,bP<0.05;与实验1组相比,cP<0.05;与实验2组相比,dP<0.05
组别 细胞凋亡率(%)对照组 6.87±0.67 AngⅡ组 31.68±3.61a实验1组 25.61±2.38b实验2组 20.36±2.15bc实验3组 14.28±1.28bcd F值 55.033 P值 0.000
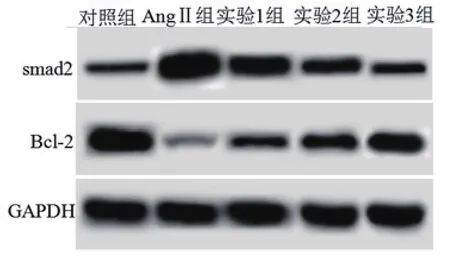
图3 Western blot测定细胞中Bcl-2、smad2蛋白水平
表4 各组细胞中Bcl-2、smad2蛋白水平比较(±s)
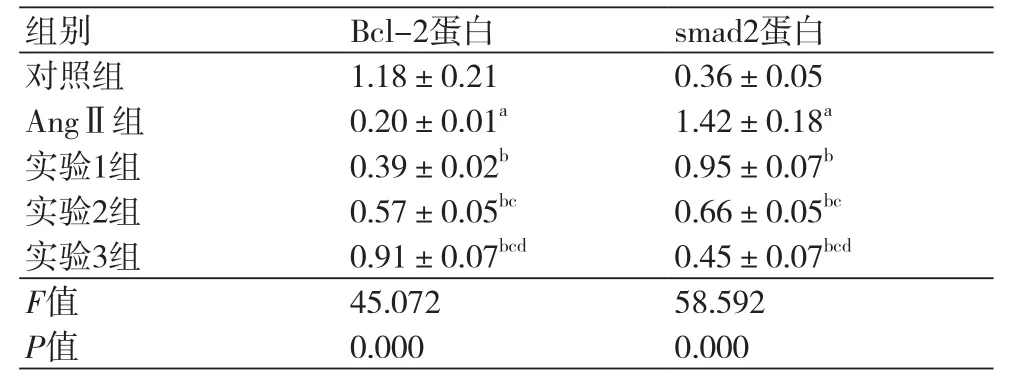
表4 各组细胞中Bcl-2、smad2蛋白水平比较(±s)
注:AngⅡ:血管紧张素Ⅱ;与对照组相比,aP<0.05;与AngⅡ组相比,bP<0.05;与实验1组相比,cP<0.05;与实验2组相比,dP<0.05
组别 Bcl-2蛋白 smad2蛋白对照组 1.18±0.21 0.36±0.05 AngⅡ组 0.20±0.01a 1.42±0.18a实验1组 0.39±0.02b 0.95±0.07b实验2组 0.57±0.05bc 0.66±0.05bc实验3组 0.91±0.07bcd 0.45±0.07bcd F值 45.072 58.592 P值 0.000 0.000
心肌肥厚发生以后,心肌细胞在高负荷的刺激下体积不断增加,心脏为了维持心肌组织的正常功能而启动凋亡程序,诱导细胞凋亡发生,这样就使得心肌肥厚由原来的代偿期逐渐转化为失代偿期,造成心肌数目异常减少,导致心功能受损,进一步促进心肌肥厚发展为心力衰竭[17]。AngⅡ不仅能够诱导心肌细胞肥大,而且还能够促进心肌细胞凋亡[18]。Bcl-2是与心肌细胞凋亡有关的一种抗凋亡蛋白,其表达水平升高后可抑制细胞凋亡的发生[19]。在本实验中发现,TGF-β1被抑制后可减少AngⅡ诱导的心肌细胞凋亡,促进心肌细胞中Bcl-2的表达,说明TGF-β1对心肌细胞肥大的作用机制可能与减少心肌细胞凋亡有关。
TGF-β1在细胞膜上与其受体特异性结合以后,可以促进其下游的受体激活,而smad2是这一过程中的调节型受体,TGF-β1与smad2结合形成异聚体以后可以转移至细胞核内,从而调控相关转录因子的表达[20,21]。smad2已经被证实参与心肌肥厚的发生,在心肌肥厚组织中表达上调[22]。本实验显示,AngⅡ促进心肌细胞中smad2的表达,而TGF-β1被抑制以后可以降低细胞中smad2蛋白水平,这提示TGF-β1可能通过作用于smad2影响AngⅡ诱导的心肌细胞肥大,而对于其具体的作用机制仍需日后进行探讨和验证。
AngⅡ诱导心肌细胞中TGF-β1高表达,下调TGF-β1可以减弱AngⅡ对心肌细胞肥大的诱导作用,这可能与减少心肌细胞凋亡、促进NO合成和减少smad2蛋白表达有关,本研究在原代心肌细胞中进行了探讨,以后会在多株心肌细胞及体内进行验证,以期为明确TGF-β1在心肌肥厚中的作用奠定基础。
