小鼠肌源性干细胞悬浮培养的可行性
2018-11-02于璐徐筑秋冯蔚枫陆海滨周经黄慜璐杨晓楠祁佐良
于璐,徐筑秋,冯蔚枫,陆海滨,周经,黄慜璐,杨晓楠,祁佐良
(中国医学科学院整形外科医院,北京100144)
肌源性干细胞(MDSC)是存在于成体动物肌肉组织中的一种具有自我更新和多向分化潜能的干细胞群。正常条件下MDSC在体内可分化为肌管和肌纤维,从而使注射入骨骼肌或心肌内的移植物保持长期持久性[1,2]。在特定条件下,MDSC能被诱导分化为内皮细胞、骨细胞、脂肪细胞、神经细胞等,可用于治疗压力性尿失禁、杜氏肌营养不良、周围神经缺损修复和心血管疾病等[3]。目前MDSC的获取主要通过差速贴壁法培养,但细胞贴壁量小、扩增时间长,使用时需用胰酶消化,可导致细胞损伤。2017年8~12月,我们利用MDSC不易贴壁的特性,采取悬浮培养法在培养皿中对肌源性原代细胞进行纯化培养并提取MDSC,旨在探讨悬浮培养法获取MDSC的可行性。现报告如下。
1 材料
2周龄C57BL/6小鼠,由中国医学科学院整形外科医院提供,实验动物使用许可证号:SYXK(京)2015-0009。IMDM培养基、FBS、马血清、双抗溶液、Ⅰ型胶原酶、中性蛋白酶Dispase Ⅱ均购自美国Sigma公司,普通中性蛋白酶、佛司可林(Forskolin)购自北京索莱宝科技有限公司,乙二胺四乙酸(EDTA)胰蛋白酶购自美国Sigma公司,表皮细胞生长因子(EGF)、胰岛素样生长因子(IGF)、碱性成纤维细胞生长因子(bFGF)、血小板衍生生长因子(PDGF)、Heregulin-β1均购自美国Peprotech公司,甘油磷酸购自北京酷来搏科技有限公司,NB4I酶购自德国Serva公司,鸡胚提取物(CEE)购自美国Gemini公司,异硫氰酸荧光素标记大鼠抗小鼠抗干细胞抗原1(Sca-1)购自美国BD公司,eFluor660标记抗小鼠CD34购自美国eBioscience公司。
2 方法与结果
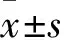
2.2 MDSC分离与培养 将2周龄C57BL/6小鼠CO2窒息处死,置于75%乙醇中浸泡消毒15 min,置于超净台,将表面皮肤脱套样分离,剪除四肢骨骼肌周围脂肪组织,仔细剥离神经、血管,眼科剪剪取四肢骨骼肌,沿肌肉长轴剪碎,以利于组织消化。将剪碎的肌肉组织置于IMDM培养基中,转移至细胞培养室。依次置于0.1% Ⅰ型胶原酶90 min、1.2 U/mL中性蛋白酶45 min、0.1% EDTA胰蛋白酶30 min消化,将得到的混悬液依次置于100、200、300、400目细胞筛过滤,滤后的细胞以1 000 r/min离心5 min,去上清,加入IMDM培养基、bFGF 12.5 ng/mL、EGF 0.4 ng/mL、IGF 20 ng/mL、20% FBS、1%双抗(成纤维细胞培养基),置于37 ℃、5% CO2的培养箱中进行分离培养(pp0时段)。2 h后(pp1时段),取上清液,离心,加入新鲜成纤维细胞培养基培养。之后每24 h取上清液离心,加入MDSC增殖培养液(IMDM 10 ng/mL、bFGF 10 ng/mL、EGF 20 ng/mL、PDGF 10 ng/mL、10% FBS、10% HS、0.5% CEE、1%双抗)培养,共5次(分别设为pp2、pp3、pp4、pp5和pp6时段)。显微镜下观察各时段悬浮细胞形态变化并计数,绘制细胞生长曲线。
显微镜下可见,细胞接种后5 min即开始贴壁;24 h时贴壁细胞以成纤维细胞形态为主,呈长梭形、核大、折光率低;pp2时段开始时仍有部分细胞贴壁,但悬浮细胞数量逐渐增多,细胞呈小球形,单个或成团,表面光滑,折光率高,悬浮细胞未见明显细胞融合或收缩现象。至pp3、pp4、pp5时段悬浮细胞保持小球形,体积逐渐增大,数量逐渐增多,呈单个或小团簇状聚集。pp6时段细胞量最多,细胞聚集成团,团内细胞保持小球形、高折光率状态。细胞计数结果显示,pp2、pp3、pp4、pp5和pp6时段悬浮细胞数量依次增多,分别为(2.64±0.20)×105、(3.08±0.19)×105、(3.63±0.13)×105、(4.64±0.15)×105、(6.06±0.26)×105个,各时段悬浮细胞数量两两比较P均<0.05。
2.3 MDSC表面标记物检测 收集pp2~pp6时段培养上清液(含悬浮细胞),1 000 r/min离心5 min,去上清;流式分析缓冲液吹打重悬,300目细胞筛过滤,1 000 r/min离心5 min,去上清;加入100 μL流式分析缓冲液重悬细胞团,再加入CD34、Sca-1直标抗体,并设不加抗体的对照组,充分混匀后室温避光反应30 min;加1 mL缓冲液,1 000 r/min离心5 min,去上清,加入200 μL缓冲液重悬细胞团;流式细胞仪检测CD34、Sca-1阳性细胞所占比例。结果显示,CD34+、Sca-1+、CD34++Sca-1+细胞所占比例随培养时间延长均逐渐增加(P均<0.05)。见表1。

表1 各时段CD34+、Sca-1+、CD34++Sca-1+细胞比例(%)
2.4 MDSC成神经诱导分化 骨骼肌取材同时取坐骨神经,置于培养基中,1 000 r/min离心5 min,去上清,加入NB4I酶溶液4 mL、0.2% Dispase Ⅱ溶液2 mL,振荡消化90 min;1 000 r/min离心5 min,去上清,加入施万细胞培养基(bFGF 10 ng/mL、heregnlin-β110 ng/mL、Forskolin 2 mol/L、10% FBS、低糖DMEM)7 mL,吹打重悬,置于37 ℃、5% CO2培养箱中培养,每3天换液一次,1周后传代纯化培养,留取上清液备用。取悬浮培养pp6时段细胞1 000 r/min离心5 min,去上清,加入施万细胞培养上清液,每3天换液一次,拍照记录细胞形态变化,免疫荧光检测诱导细胞p75 NGF表达。结果显示,施万细胞诱导培养7天,光镜下见小球形、高折光率细胞逐渐分化为长条形、串珠样类施万细胞,部分细胞死亡,部分仍保持小球形。免疫荧光显示,约90%的诱导细胞p75 NGF受体反应阳性,说明分离培养的细胞具有良好的成神经诱导能力。
2.5 MDSC成骨诱导分化 取悬浮培养的pp6时段细胞1 000 r/min离心5 min,去上清,加入成骨诱导液(维生素C 50 mg/L、甘油磷酸 10 mmol/L、地塞米松 100 nmol/L、10% FBS、DMEM),每3天换液一次,拍照记录细胞形态变化,并进行茜素红染色。结果显示,诱导培养21天,光镜下可见小球形折光率高的细胞大量分化为长条形细胞,部分显示片状,有晶体形成。茜素红染色大部分红染,并可见棕褐色结晶状矿化结节形成。表明分离培养的细胞有良好的成骨分化能力。
3 讨论
MDSC作为一种成体干细胞,具有多向分化能力,不仅可在正常条件下通过细胞融合形成肌管,在特定诱导条件下还可分化为中胚层其他类型细胞,甚至外胚层细胞[3],如内皮细胞、脂肪细胞、骨细胞、神经细胞等。MDSC其作为组织工程研究的种子细胞和基因治疗的转染细胞,目前已被用于多种疾病的治疗[4~7]。
1970年Richler等[8]采用胰蛋白酶消化培养法获取MDSC,之后学者们陆续改进了MDSC的提取步骤,目前主要采用联合消化酶法,并取得了较好效果。骨骼肌是MDSC的主要来源。肌源性干细胞的提取与培养已在多种动物中得以应用。目前比较成熟的方法为骨骼肌机械分离与多步酶消化法。骨骼肌机械分离过程采用眼科剪将肉眼可见的血管、神经、脂肪剔除,剪取骨骼肌,并将骨骼肌初步剪碎,有利于后续的酶消化。剪碎过程中应注意尽量沿肌纤维走行方向,减少肌纤维碎片混入。取下的骨骼肌碎块采取多步酶消化法,首先是胶原酶,由于胶原酶分为不同类型(Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ型),按照骨骼肌中结缔组织的类型,我们选择Ⅰ型胶原酶。胶原酶本身属于一种蛋白质,可以解离纤维结缔组织,分散肌纤维,使之成为单根肌纤维,以利于之后中性蛋白酶和胰蛋白酶消化。在消化振荡过程中应注意观察组织分解情况。之后加入中性蛋白酶,其属于一种内切酶,可水解蛋白质,使组织消化更彻底。最后加入EDTA胰蛋白酶消化,可将细胞间蛋白质水解,继而达到分散细胞的目的。使用胰蛋白酶过程中,应掌握好浓度、温度和时间,实验过程不超过30 min,胰蛋白酶作用较强,如果浓度较高或作用时间太长易致细胞死亡。
MDSC的体外扩增能力与所用培养基及血清等密切相关。FBS的质量和浓度可直接影响MDSC增殖。采用优质FBS与马血清有利于细胞增殖,延缓细胞分化。FBS浓度过高或过低均易导致细胞融合及其向肌管分化[9],然而其适宜浓度尚未明确,本研究选取应用较普遍的10% FBS。CEE在肌肉来源细胞培养过程中的作用十分重要。CEE含有大量刺激或抑制细胞周期的成分,不同厂家和不同批次CEE质量也有差异,可能影响MDSC的培养过程。值得注意的是,CEE在使用过程中不应进行离心和超滤,经过超滤的CEE效价会降低[10]。
MDSC的自我更新能力较低,目前MDSC的分离方法主要有差速贴壁法、密度梯度离心法、流式细胞分选法和免疫磁珠分选法等[11]。差速贴壁法是各国实验室最常用的方法,已成功分离培养出不同种属动物的MDSC。其优势为操作简单,可获得纯度相对较高的MDSC。但在实际操作过程中发现,该方法分离培养的MDSC扩增数量有限,约80%慢贴壁细胞在第1周保持静默状态,这些静默状态的慢贴壁细胞仅有极少量会在接下来的2周内增殖,仅在培养瓶中形成小的克隆集落[10]。既往MDSC的培养均采用2D贴壁培养法,而实验室获取的细胞均是从正常的3D组织生长条件下分离而来的,这种非生理培养条件必然会改变细胞行为,进而限制细胞的体外扩增与分化潜能[12]。MDSC不仅具有自我更新和分化能力,还具有间隙连接细胞通讯缺陷、接触不敏感生长及非贴附性生长的特点。在其他类型的间充质干细胞,如人脂肪源性干细胞和人骨髓源性干细胞中,约50%可以在软琼脂中形成克隆集落[12]。上述研究均证实,MDSC有能力进行非贴附性生长。研究者们将细胞以悬浮球模式培养,使细胞在类似于组织内的三维环境中排列生长。由于肿瘤的悬浮球与原位实体肿瘤十分相似,因此这种悬浮培养技术目前主要应用于肿瘤研究。与传统的单层细胞培养相比,悬浮培养可模拟细胞在机体内的三维环境,对维持培养细胞的干性和分化潜能十分重要。
因MDSC具有不易贴壁的特性,故本课题组尝试采用悬浮培养法对原代MDSC进行培养。从细胞计数和光镜下观察来看,细胞数量随培养时间延长而增加,且逐渐形成一个个细胞团,团内可见较多小球形、折光率高的正常细胞,显示出较好的自我更新能力。证实悬浮培养法可得到相当数量的MDSC,且在细胞收集过程中不需采用胰蛋白酶,有利于保持细胞的原始特性。
MDSC作为一个细胞群体,目前尚没有特异性的表面标记物。CD34与Sca-1是目前已知的MDSC表达较高的表面标记物[13,14]。CD34是一种高度糖基化Ⅰ型跨膜蛋白,选择性表达于造血干、祖细胞等表面,随干细胞分化而表达逐渐减少,CD34+细胞所占比例升高一定程度上说明干细胞所占比例增加。Sca-1是小鼠造血干细胞的标志分子,几乎可在所有器官、组织干细胞中表达。CD34和Sca-1作为表达量相对较高的干性因子已为大多数研究者所公认。但由于各国实验室的实验条件、实验步骤和材料等差异,细胞缺乏具有一致共识的表面蛋白或标记物,使得直接进行其表面标记物表达量的比较(即纯度比较)难以进行,而且一些标记物(尤其是表面蛋白)可以在体外因各种原因上调或下调,让情况更加复杂。本研究流式检测结果显示,细胞随培养时间延长,CD34与Sca-1阳性细胞所占比例逐渐增多,提示干性细胞数量逐渐增加。但出现上述结果是否为悬浮培养过程中杂细胞不断贴壁导致纯度增加所致,仍需要进一步验证。
除表面标记物的检测外,干细胞的鉴定同样取决于细胞的形态和分化能力。在体外基本培养条件下,MDSC可自发分化为肌管[15]。本研究采用表面标记物检测与诱导分化同时进行的方法验证悬浮培养MDSC的分化潜能,证实MDSC发生了自发分化,形成了高、亮、粗长条形的肌管,并具有收缩性,这种自发分化的情况可能与培养基中血清含量过高,模拟了体内的再生过程所致[9]。德国学者采用与我们类似的动态支持培养方法发现,MDSC在悬浮状态下易分化,可能是这种连续增殖的细胞表达了特定的表面标记物,而这种表面特性可以造成没有或先于细胞融合的终末分化[16]。研究发现,当以诱导因子刺激时,MDSC显示出强大的分化能力,可分化为中、外胚层的各种类型细胞[7];将MDSC移植入坐骨神经严重受损的小鼠体内后,其不仅可以分化为施万细胞,还可向神经束膜/神经内膜细胞分化,分别形成髓鞘和神经束膜/内膜,包绕再生的轴突,促进断端神经再生[17]。鉴于成熟的施万细胞可分泌各种神经生长因子、营养因子等,模拟体内MDSC的分化条件,本研究选择以施万细胞条件培养液进行诱导分化,将所获得的pp6时段悬浮细胞进行成神经诱导。结果显示,诱导后细胞由小球形、高折光率细胞逐渐分化为长条形,部分细胞可见串珠状的类施万细胞样外观,免疫荧光染色显示p75 NGF受体反应阳性。成骨诱导的细胞在培养1周左右开始由小球形细胞变为长条形,至培养2~3周约90%细胞变为长条形,且细胞颜色加深,茜素红染色大部分红染。证实MDSC具有向中、外胚层细胞分化的能力。
综上所述,悬浮培养法可获取初始细胞量约3倍的小鼠MDSC,且培养获得细胞具有良好的成神经、成骨分化能力。
