CUG连接蛋白1在胃癌组织中的表达及对SGC7901细胞增殖和侵袭能力的影响
2018-10-10桂芬芳罗子华吴京华黎发明郑建伟
朱 倩,桂芬芳,罗子华,吴京华,黎发明,郑建伟
1)深圳市龙华区中心医院消化内科 广东深圳 518110 2)华中科技大学同济医学院附属同济医院普外科 武汉 430030
胃癌作为消化系统高发恶性肿瘤,具有较高的病死率。近年来随着诊疗技术的进步,胃癌预后得到一定改善,但进展期患者依然生存率较低[1]。研究[2-3]表明,早期转移是影响胃癌预后的主要因素。因此,积极探讨影响胃癌侵袭转移的相关因素对改善预后具有重要意义。CUG连接蛋白1(CUG-binding protein 1,CUGBP1)作为一种RNA连接蛋白家族成员,在mRNA翻译及降解中发挥重要作用,与胚胎发育、组织形成、细胞分化关系密切[4]。近年来研究[5-7]发现,CUGBP1在多种肿瘤组织中表达异常,可能与肿瘤发生关系密切。本研究分析了胃癌组织中CUGBP1蛋白的表达;通过RNA干扰技术沉默人胃癌SGC7901细胞中CUGBP1基因,观察细胞生物学特性的改变;以期为胃癌侵袭转移机制的研究提供基础资料。
1 材料与方法
1.1胃癌组织中CUGBP1蛋白表达的检测
1.1.1 临床资料 组织标本来源于2014年2月至2017年3月在深圳市龙华区中心医院择期行根治性手术治疗的胃癌患者,均经病理学检查确诊,共82例,患者术前均未接受放化疗。其中,男45例,女37例,年龄40~74岁,≥60岁52例;肿瘤直径≥5 cm17例;组织分型:肠型53例,弥漫型29例;分化程度:低分化26例,中高分化56例;TNM分期:Ⅰ、Ⅱ期38例,Ⅲ、Ⅳ期44例;浸润深度:T1有13例,T2、T3共69例;发生淋巴结转移45例。术中留取癌组织及距癌灶边缘>5 cm并经病理学检查证实的正常组织,福尔马林固定,石蜡包埋保存。本研究通过医院伦理委员会批准,患者均知情同意。
1.1.2 CUGBP1蛋白表达的检测 EnVision二步法免疫组化试剂盒购自北京中杉生物技术有限公司,一抗兔抗人CUGBP1多克隆抗体购自美国Abcam公司。取石蜡标本,切片,用二甲苯和梯度乙醇脱水,用过氧化氢除去内源性过氧化物酶,用柠檬酸盐(pH 6.0)行高压抗原修复,按照试剂盒说明完成检测。一抗稀释度1∶500。DAB显色,苏木精复染,封片,透明,镜下观察。胞核中出现棕黄色颗粒状物质为阳性细胞。高倍镜下选取5个视野,根据染色强度和阳性细胞比例进行结果判定[8]:无染色、浅黄色、棕黄色、棕褐色染色分别计为0、1、2、3分;无阳性细胞,阳性细胞比例<10%、10%~、51%~、>75%分别计为0、1、2、3、4分;两项计分相乘,0~2分为阴性,≥3分为阳性。
1.2沉默CUGBP1基因后SGC7901细胞生物学特性的观察
1.2.1 细胞培养和分组 SGC7901细胞购自中科院上海细胞生物学研究所。DMEM培养基、胎牛血清、胰蛋白酶购自美国Gibco公司。将SGC7901细胞置于含体积分数10%胎牛血清的DMEM培养基中,在含体积分数5% CO2、37 ℃恒温培养箱中培养24 h,2.5 g/L胰蛋白酶消化,传代培养,取对数生长期细胞用于实验。实验分3组,空白对照组、对照siRNA组和CUGBP1 siRNA组。CUGBP1 siRNA组、对照siRNA组用Lipofectamine2000转染试剂盒(美国Invitrogen公司)分别转染 CUGBP1 siRNA(序列5’-CTAGCCGGGATTGAAGAATGCCGGATATTCAAGAGATATCCGGCATTCTTCAATCTTTTTAAT-3’)和对照siRNA序列(5’-CTAGCCCGGTTCTCCGAACGTGTCACGTATCTCGAGATACGTGACACGTTCGGAGAATTTTTTTAAT-3’),空白对照组不作任何处理。siRNA由上海锐赛生物技术公司设计合成。
1.2.2 细胞中CUGBP1 mRNA的检测 Trizol总RNA提取试剂盒购自美国Invitrogen公司,反转录及荧光定量PCR试剂盒购自大连宝生物工程公司,PCR仪购自美国Bio-Rad公司,CUGBP1和内参GAPDH引物由上海生工生物工程公司设计合成。转染48 h后收集细胞,加入细胞裂解液,提取总RNA,反转录合成cDNA,以cDNA为模板进行PCR扩增。CUGBP1上游引物序列:5’-GATCAGTGCAGCGTCTGTGT-3’,下游:5’-GTGTTGAGGTTCCCAGAGGA-3’;GAPDH上游引物序列:5’-TCACCACCATGGAGAAGGC-3’,下游:5’-GCTAAGCAGTTGGTGGTGCA-3’。PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,60 ℃ 30 s,74 ℃ 30 s,连续循环40次。每组设3个平行孔。用2-ΔΔCt法计算CUGBP1 mRNA的相对表达量。
1.2.3 细胞增殖能力的检测 MTT细胞增殖检测试剂盒购自上海威奥生物科技公司。取转染48 h后的各组细胞,胰蛋白酶消化,接种于96孔板,密度1×104个/孔,在含体积分数5%CO2、37 ℃恒温培养箱中培养,分别于12、24、48、72和96 h时,将10 μL的MTT液加入各孔,培养4 h后加入100 μL的二甲基亚砜,充分振荡,用酶标仪于490 nm波长处检测吸光度(A)值。实验重复3次。
1.2.4 细胞迁移和侵袭能力的检测 ①划痕实验:在6孔板背面划横线,每孔5条平行线。取各组转染48 h后的细胞,常规胰蛋白酶消化后接种于6孔板,每组6个复孔。待细胞长满孔底时,用200 μL枪头垂直于孔板底部从上而下划线,枪头要垂直,不能倾斜,尽量保证各个划痕宽度一致,去除旧培养液,PBS冲洗3次,加入无血清培养液继续培养。显微镜下观察,分别于培养0、24和48 h时拍照,利用Image-Pro Plus软件测量划痕宽度。划痕修复率=(0 h时划痕宽度-24 h或48 h时划痕宽度)/0 h时划痕宽度×100%。②Transwell实验:Transwell小室和Matrigel胶购自美国Falcon公司。取各组转染48 h后的细胞,胰蛋白酶消化,室温条件下离心后留取细胞沉淀,用含体积分数1%胎牛血清的无血清培养液制备单细胞悬液,密度为1×105mL-1。取100 μL细胞悬液加入Transwell小室上室,将600 μL含体积分数10%胎牛血清的DMEM培养液加入下室,在含体积分数5% CO2、37 ℃恒温培养箱中培养24 h。用甲醛固定细胞,结晶紫染色,用棉签轻轻除去散落细胞,拍照,取5个高倍视野计数穿膜细胞数,即为迁移细胞数。实验重复3次。将Matrigel胶平铺于Transwell小室,4 ℃风干备用,其余步骤同前,检测侵袭细胞数。
1.3统计学处理使用SPSS 21.0完成数据分析。癌及癌旁正常组织中CUGBP1蛋白阳性表达率的比较采用配对χ2检验;不同临床病理特征胃癌组织中CUGBP1蛋白阳性表达率的比较采用成组资料的χ2检验;3组细胞A值、划痕修复率、迁移细胞数和侵袭细胞数的比较采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
2 结果
2.1胃癌组织中CUGBP1蛋白的表达胃癌及癌旁正常组织中CUGBP1蛋白的表达见图1、表1。
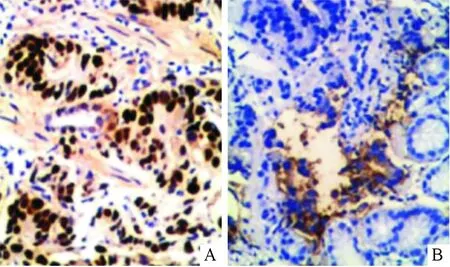
图1 胃癌(A)和癌旁正常组织(B)中CUGBP1蛋白的表达(EnVision,×400)
表1胃癌和癌旁正常组织中CUGBP1蛋白表达的比较例
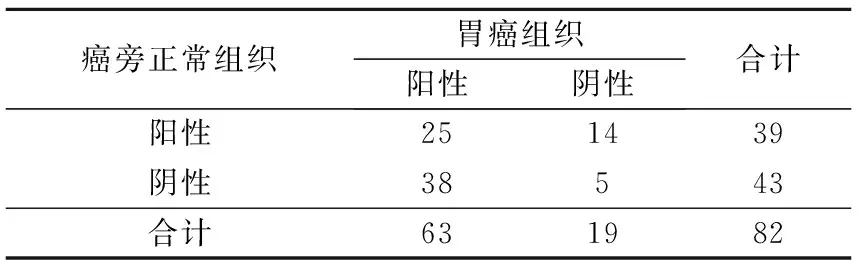
癌旁正常组织胃癌组织阳性阴性合计阳性251439阴性38543合计631982
χ2=11.077,P=0.001
胃癌组织中CUGBP1蛋白阳性表达率达76.8%,高于癌旁正常组织(47.6%)。不同临床病
理特征胃癌组织中CUGBP1蛋白表达的比较见表2。低分化、TNM分期为Ⅲ和Ⅳ期、浸润深度为T2和T3、有淋巴结转移的胃癌组织中CUGBP1蛋白阳性表达率更高(P<0.05)。

表2 不同临床病理特征胃癌组织中CUGBP1蛋白表达的比较 例(%)
2.2沉默CUGBP1基因后SGC7901细胞生物学特性的变化
2.2.1 3组细胞中CUGBP1 mRNA表达的比较 CUGBP1 siRNA组、对照siRNA组和空白对照组细胞中CUGBP1 mRNA的相对表达量分别为(1.19±0.16)、(2.14±0.11)和(2.22±0.14),差异有统计学意义(F=104.472,P<0.001),CUGBP1 siRNA组细胞中CUGBP1 mRNA相对表达量低于两个对照组(P<0.05)。
2.2.2 3组细胞增殖能力的比较 见表3。CUGBP1 siRNA组细胞24、48、72和96 h时A值低于两个对照组(P<0.05)。

表3 3组细胞不同时间点A值比较(n=6)
*:与CUGBP1 siRNA组比较,P<0.05
2.2.3 3组细胞迁移和侵袭能力的比较 见表4、5。CUGBP1 siRNA组24和48 h时细胞划痕修复率均低于对照siRNA组和空白对照组(P<0.05),迁移细胞数和侵袭细胞数亦低于对照siRNA组和空白对照组(P<0.05)。

表4 3组细胞划痕修复率的比较(n=6) %
*:与CUGBP1 siRNA组比较,P<0.05

表5 3组迁移细胞数和侵袭细胞数的比较
*:与CUGBP1 siRNA组比较,P<0.05
3 讨论
有研究[9-10]指出,肿瘤转移、复发依然是胃癌患者死亡风险增加的主要因素,如何有效减少胃癌早期转移及术后复发已成为目前研究的热点和难点。CUGBP1位于人染色体11p11,与mRNA代谢密切相关[11]。杨昌俊等[12]发现,膀胱癌组织中CUGBP1蛋白呈高表达,并在肿瘤细胞的增殖、凋亡中发挥重要作用。Wang等[13]发现,CUGBP1是影响非小细胞肺癌脑转移的重要因素。本研究结果显示,胃癌组织中CUGBP1蛋白阳性表达率高于癌旁正常组织,低分化、TNM分期Ⅲ和Ⅳ期、浸润深度T2和T3及发生淋巴结转移的胃癌组织中CUGBP1蛋白阳性表达率明显升高,说明CUGBP1可能参与了胃癌的发生、进展过程,可能与不良预后有关。
有研究[14]指出,CUGBP1在调节细胞生长和凋亡中起着关键作用。本研究结果显示,CUGBP1 siRNA组细胞24、48、72和96 h时A值均低于对照siRNA组和空白对照组,迁移细胞数和侵袭细胞数亦低于两对照组,说明CUGBP1基因与胃癌细胞的增殖、迁移能力关系密切,与Zhao等[15]和Liu等[16]的研究结论相同。
综上所述,胃癌组织中CUGBP1蛋白呈高表达,且参与了胃癌细胞增殖、侵袭过程的调节,有望成为胃癌基因靶向治疗的新靶位。
