鲤科鱼类HIF-1的研究进展
2018-09-12韩青青曹诣斌
韩青青,王 华,李 鑫,曹诣斌
(浙江师范大学化学与生命科学学院,浙江 金华 321004)
在鱼类的生存及生长发育中,水中的溶解氧起着很重要的作用。与空气中氧含量相比,水中溶解氧含量只有同体积空气氧含量的3%,所以,与陆生生物相比,水生生物对氧气的利用率更为重要[1]。由于水体本身溶氧量的特点及外界环境的影响,使得水体低氧成为自然现象。鱼类为适应水环境中溶解氧浓度的波动,已形成了不同的应对策略[2]。而作为低氧相关基因调控的核心转录因子的低氧诱导因子HIF-1在鱼类低氧应答中起着重要的作用。
鲤科鱼类是鲤形目中分布最广、种类也最多的一群,为鱼类中最大的一科,约有200多属2 000多种,都是淡水鱼类,分布很广。我国鲤科鱼类中的主要经济鱼类有“四大家鱼”(青鱼Mylopharyngodon piceus、草鱼 Ctenopharyngodon idellus、鲢 Hypophthalmichthys molitrix、 鳙 Aristichthys nobilis)、鲤Cyprinus carpio、鲫 Carassius auratus、鳊 Megalobrama terminalis、团头鲂Parabramis pekinensis等,是池塘养鱼的主要对象。其中,作为重要的模式生物,人们广泛采用斑马鱼来研究低氧对胚胎发育、免疫应答和代谢调节等的影响。同时,鲫鱼和金鱼是低氧耐受能力最强的淡水鱼类之一,是迄今唯一一种能在室内不依赖气泵而长期生存的鱼类,拥有一系列独特的低氧适应生理机制,例如,可通过乙醇脱氢酶(Acetaldehyde Dehydrogenase,ADH)将无氧呼吸产生的乳酸转化为乙醇,然后从鳃部排出,避免了长期无氧呼吸可能导致的酸中毒[3];金鱼鳃部组织也具有常氧和低氧状态下进行结构可塑性转化的能力[4-5]。鉴于HIF-1在动物低氧应答中所发挥的重要作用,有必要对目前鲤科鱼类HIF-1的研究背景与进展进行阐述。
1 低氧诱导因子(HIF-1)的发现、调节及其在鲤科鱼类中的克隆
在肝癌细胞株Hep3B细胞低氧处理后的核提取物中,WANG等[6]发现了一种能与红细胞生成素基因增强子特异性地结合的蛋白质,由于它广泛存在于缺氧细胞内,命名为低氧诱导因子(HIFs)。HIFs能特异性地与其靶基因调控区的低氧应答元件结合,从而激活靶基因的转录,促进机体和细胞对低氧环境的适应。
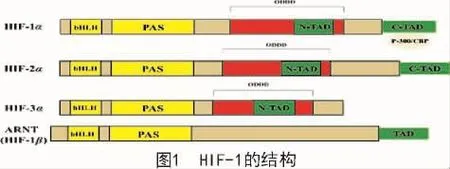
低氧诱导因子1(HIF-1)是HIF-1α和HIF-1β 2种亚基组成的具有转录活性的异二聚体,HIF-1α的分子量为120kD,HIF-1β的分子量为91~94 ku。其中,α亚基受到氧浓度的调控,是低氧诱导因子的调节亚基。而β亚基则持续性表达,不受氧浓度的影响,2种亚基的N端均含有bHLH/PAS同源区,对于二聚化和与靶基因表达调控区的结合是必需的[7]。在HIF-1α亚基中部存在一个氧依赖性降解结构域(Oxygen-Dependent Degradation Domain,ODDD);C-末端包括2个反式激活结构域(TAD),即TAD-N和TAD-C[8]。目前,针对HIFs的研究主要在HIF-α上,哺乳动物体内一共发现3种HIF-α亚基,HIF-1α,HIF-2α以及HIF-3α[9](图1),HIF-1α和HIF-2α具有48%的氨基酸序列一致性,并且可以识别相同的DNA结合区域,但是又具有各自独特的生物学效应。研究表明,HIF-2α参与长期慢性缺氧,而HIF-1α与急性缺氧有关[10],HIF-3α只在高血管组织如眼角膜中表达。
在常氧的情况下,HIF-α亚基的半衰期很短,细胞不断合成和降解蛋白质。氧浓度对α亚基降解的调控是通过ODDD域中2个脯酰胺残基(Pro402和Pro564)的羟基化实现的。羟基化反应由脯酰胺羟化酶(prolyl hydroxylase,PHDs)催化,活性取决于氧、2-酮戊二酸和辅因子Fe2+的水平。脯氨酸的羟基化使HIF-α亚基与肿瘤抑制基因蛋白(von Hippel-Lindau tumor suppressor,pVHL)相互作用,并通过泛素蛋白酶体通路被降解[11]。在氧浓度下降时,脯氨酰基羟基化受到抑制,稳定的HIF-1α向细胞核内转移并与HIF-1β形成HIF-1二聚体,然后与目的基因表达调控区域的低氧应答元件结合,调节靶基因的表达[12-13]。Pro402和Pro564在鱼类HIF-1α中保守,推测这种调节机制也同样存在于鲤科鱼类中。
关于HIF的研究目前在哺乳动物中比较深入,同时在鱼类包括在一些鲤科鱼类中也展开了初步研究,如鱼类HIF-1α序列特征最早在草鱼[14]、斑马鱼(Barchydanio rerio var)[15]、青海裸鲤(Gymnocypris przewalskii)[16]、团头鲂(Megalobrama amblycephala)[17]等鱼中相继报道。而HIF-2α基因在斑马鱼、草鱼等鱼中也有一定的研究[18]。
2 低氧对鲤科鱼类HIF-1及其靶基因的影响
斑马鱼作为鲤科鱼类的模式动物,人们对低氧诱导斑马鱼胚胎HIF-1的表达,HIF-1及其靶基因启动子的鉴定等展开了研究。常氧环境中,在斑马鱼胚胎的不同发育阶段均可检测到HIF-1α蛋白,但各阶段之间没有显著差异,而HIF-2α和HIF-3α在孵化后期水平比前期显著上升;低氧处理使HIF-1α蛋白水平明显上升,而HIF-2α和HIF-3α蛋白不受影响,表明HIF-2α和HIF-3α在早期发育中更为重要,而HIF-1主要参与低氧应答[19]。在斑马鱼胚胎发育中进行低氧或完全缺氧处理会激活HIF-1途径,并在幼鱼期表现出较高的低氧耐受能力,同时导致在鱼群中雄鱼占较高比例[20]。WANG等[21]研究发现,TET1蛋白作为TET(teneleventranslocation)家族的甲基胞嘧啶双加氧酶的一员,对于斑马鱼和小鼠的低氧耐受不可或缺。Tet1缺陷型斑马鱼和小鼠与野生型相比,对低氧更为敏感。Tet1采用不同的方式促进HIF-α的稳定性并增强其转录激活活性,Tet1竞争性地抑制PHD2与HIF-2α的结合,降低HIF-2α的羟化水平;相反,Tet1并不影响HIF-1α的羟化,而是通过对HIF-1α C-末端赖氨酸的修饰提高其稳定性。
低氧还通过HIF-1影响斑马鱼对铜污染,以及巨噬细胞与内皮细胞的相互作用。在斑马鱼早期胚胎发育中,常氧下采用HIF羟化酶的抑制剂DMOG处理,HIF的稳定性显著提高并降低了铜毒性[22]。巨噬细胞在发育和病理性血管生成中与内皮细胞相互作用,但其分子机制并不清楚。斑马鱼中HIF-1α突变导致血管生成和血管修复缺陷,使得巨噬细胞从主动脉-性腺-中肾(AGM)的动员被削弱[23]。转录组分析低氧处理的斑马鱼VHL突变胚胎,检测到许多在人类低氧细胞模型中被激活的关键低氧应答基因,但同时抑制许多脂类代谢相关基因的表达[24]。脂多糖(lipopolysaccharide,LPS)处理显著增高斑马鱼HIF-1α的mRNA水平,并在处理8 h后达到峰值,推测LPS与低氧协同调节斑马鱼HIF-1α的转录水平[25]。
除了斑马鱼以外,在其他鲤科鱼类如鲫鱼、草鱼、武昌鱼和裸鲤等中,人们也对HIF-1及其靶基因在低氧环境中表达展开了研究。在鲫鱼鳃组织中,HIF-1α蛋白在常氧环境也保持一定水平,而低氧导致HIF-1α更加稳定,但HIF-1靶基因iNOS mRNA水平没有显著差异[26]。Northern blot分析显示,低氧诱导草鱼肾脏HIF-1α mRNA水平的上升,并在眼睛、鳃、心脏、肾和肝组织中诱导HIF-4α mRNA水平的上升。Western blot分析表明,内源HIF-1α和HIF-4α蛋白水平均同样受低氧诱导,推测草鱼HIF-1α和HIF-4α在转录水平和翻译水平受到不同方式的调节[27]。低氧诱导草鱼肝脏和肾脏CITED1,CITED3a和CITED3b mRNA水平显著上升,荧光素酶报告基因表明,HIF-1激活这3个基因的启动子。CHIP分析显示,常氧与低氧中肝脏与肾脏组织这3个基因启动子与HIF-1的结合存在显著差异。同时CITED1,CITED3a和CITED3b对HIF-1的转录激活活性具有负反馈抑制作用[28-29]。在武昌鱼中,低氧处理使HIF-2α mRNA水平在肝脏和肾脏中分别上升了910%和320%,同时HIF-1α mRNA水平在相应组织中没有明显变化[17]。在青海湖裸鲤不同组织中,HIF-1α的靶基因Glut-1 mRNA水平与低氧处理时间具有相关性[16]。在普通鲤鱼中,肌红蛋白基因启动子中存在HRE元件,这一特征解释了低氧在非肌肉组织中诱导mb-1基因表达的现象。但在mb-2基因中,有一段10 bp序列插入到上游激活因子(upstreamstimulatoryfactor,USF)结合位点中。由于USF是HIF的一个辅助转录因子,从而可能导致mb-2对低氧不产生应答反应[30]。
3 温度和重金属对鲤科鱼类HIF-1的影响
3.1 温度
在鲫鱼中,为了研究HIF-1的功能是否参与了与温度适应相关的基因表达变化以及在低温适应中的作用,RISSANEN 等[31]在 8,18,26 ℃研究了常氧和低氧(0.7 mg/L)条件下HIF-1 DNA结合活性和HIF-1α表达,结果表明,HIF-1活性随着温度的下降而增加,甚至比对氧浓度的降低更加敏感,显示体温和缺氧之间的相互作用调节鲫鱼HIF-1的功能。
3.2 重金属
ZIZZA等[32]将鲫鱼暴露在亚致死浓度(1.45mg/L)和较低浓度(0.3 mg/L)的CuCl2中,对HSP90及HIF-1α的转录水平进行了检测,结果表明,铜诱导HSP90的下调和HIF-1α的上调,这可能与鱼类中金属诱导损伤的修复有关。KWONG等[33]研究证明,在斑马鱼中,低氧会抑制斑马鱼对Ca2+的吸收,是通过HIF-1介导的上皮钙离子通道表达的影响。FITZGERALD等[22]发现低氧和常氧条件下铜对于斑马鱼的影响存在显著差异。在常氧条件下,暴露于0.07 mg/L Cu导致斑马鱼死亡率为75.5%,而在低氧条件下,没有发生铜诱导的致死效应。在20 μmol/LDMOG存在下,在常氧下0.07mg/LCu处理的死亡率为0,这说明HIF通路的激活使铜金属的毒性显著降低。KHATIB等[34]在斑马鱼鱼鳍再生期间将鱼暴露于CoCl2后,观察到再生鱼鳍非常脆弱并且容易裂缝,导致鱼在水中活动时容易发生鱼鳍部分或全部损失,这是由于正常的鱼鳍再生需要软骨内骨化,也就是软骨停止增殖,而氯化钴处理导致HIF水平上升,而HIF促进软骨继续增殖,使得软骨不会内骨化,导致再生鳍脆弱。
