分光光度法测定叶绿素含量的提取液的适宜浓度
2018-09-06胡秉芬黄华梨季元祖赵晓芳戚建莉张露荷张广忠
胡秉芬,黄华梨,季元祖,赵晓芳,戚建莉,张露荷,张广忠
(甘肃省林业科学研究院经济林研究所,甘肃 兰州 730020)
叶绿素含量是反映植物光合组织生理状况的一个基本指标,植物生理研究中经常涉及叶绿素含量的测定。叶绿素含量的测定方法主要有分光光度法、荧光分析法、活体叶绿素仪法、光声光谱法和高效液相色谱法等[1]。其中,应用最广泛的是分光光度法,即根据叶绿素对可见光的吸收光谱,在某一特定波长下,测定其吸光度(A),然后利用公式计算叶绿素含量。吸光度是光线通过溶液后用来衡量光被溶质吸收程度的一个物理量。光的吸收程度与叶绿素提取液的浓度、液层的厚度以及入射及反射光的强度等因素有关。实际上,在进行比色分析时,因采用同样质料、相同规格的比色皿,反射光的强度相同,它们的影响可以相抵消。Beer定律是比色分析的理论基础,它适用于低浓度溶液,一般采用每升含溶质1 g的浓度(1 mg·mL-1),液层厚度为1 cm。许大全[2]认为用于比色测定的叶绿素提取液的浓度过高,会导致叶绿素a/b比值的明显降低。舒展等[3]也认为叶绿素a/b比值的高低与用于比色的叶绿素提取液浓度有密切关系;当叶绿素提取液浓度在3.50~6.00 cm2·mL-1时,a/b比值变化不大,而在这个范围之外时,a/b比值随提取液浓度的降低而升高。笔者在以往试验中,使用分光光度法测定小麦(Triticumaestivum)叶片叶绿素含量时发现,取同一叶片对等部位厚度相同的两份等面积材料,用不同容积乙醇-丙酮混合液(1∶1)浸提叶片叶绿素,结果是材料相同、浓度不同的叶绿素提取液所测得的叶绿素含量不同。此外,在比色读数时吸光度经常波动不稳定,特别在665和663 nm长波点,表现尤为明显。因此,运用适宜浓度的叶绿素提取液对准确测定其叶绿素含量至关重要。鉴于此,本研究采用枣树(Ziziphusjujuba)“金昌一号”叶片为材料,分别以乙醇和乙醇-丙酮混合液(1∶1)浸提枣树叶片叶绿素,将浸提液稀释成一定浓度梯度后,用紫外可见分光光度计比色读取吸光度,然后测定计算叶绿素a、叶绿素b、叶绿素a/b的比值和叶绿素总量(a+b),并观察吸光度的稳定情况,进而探讨叶绿素含量稳定时浸提液的浓度问题,以期为分光光度法有效测定叶绿素含量提供科学依据。
1 材料与方法
1.1 试验材料
供试材料为4年生枣树“金昌一号”的叶片,于2016年5月12日采自甘肃省林业科学研究院靖远县双龙乡新建枣树示范园。其他仪器试剂:紫外可见分光光度计(UV-1600PC型,上海美谱达仪器有限公司)、80%丙酮、95%乙醇及乙醇-丙酮混合液(按体积比配制的提取液1∶1)等。
1.2 试验方法
在枣树树冠中部外围东、西、南、北4个方位选取两年生二次枝,于其上4~6节着生的枣吊中部各采2片叶,擦净叶片表面污物,在8片重叠的枣树叶片主脉两侧对应部位各取2 cm×1 cm叶样,称重后剪成细丝,无损地放入具塞三角瓶中,加入乙醇-丙酮混合液(1∶1)定容至20 mL,封口后室温、暗处浸泡提取。采用同样的方法,用95%酒精作提取液再浸提一份。待材料完全变白后,取清液用紫外可见分光光度计比色测定吸光度。
由于丙酮溶液中的叶绿素a、b在长波光方面的最大吸收峰位于663和645 nm处,而乙醇溶液中的叶绿素a、b在长波光方面的最大吸收峰位于665和649 nm处[4]。因此试验设计3个方案:方案1,乙醇叶绿素提取液在665和649 nm波长点比色,测得的叶绿素a、b及吸光度分别用a1、b1、1A665、1A649表示;方案2,乙醇-丙酮叶绿素提取液在665和649 nm波长点比色,测得的叶绿素a、b及吸光度分别用a2、b2、2A665、2A649表示;方案3,乙醇-丙酮叶绿素提取液在663和645 nm波长点比色,测得的叶绿素a、b及吸光度分别用a3、b3、A663、A645表示。方案1和方案2的提取液不同,比色波长点及叶绿素含量的计算公式均相同;方案1和方案3提取液、比色波长点及叶绿素含量的计算公式均不同,方案1是乙醇叶绿素提取液在A665和A649波长下读取吸光度后用Arnon的修正公式[5]计算叶绿素含量;方案3则是乙醇-丙酮叶绿素提取液在A663和A645波长下读取吸光度,由于其叶绿素提取液的吸收光谱和丙酮叶绿素提取液的吸收光谱相同[4],故用Arnon公式计算叶绿素含量。
每一次比色后将比色皿中叶绿素提取液倒回原三角瓶,加5 mL相应提取液稀释后取清液再次测定吸光度。以此类推,共稀释成19个浓度梯度(1.600、1.280、1.067、0.914、0.800、0.711、0.681、0.653、0.627、0.604、0.582、0.533、0.492、0.457、0.427、0.400、0.376、0.337、0.305 cm2·mL-1),全部比色并记录数据。枣树“金昌一号”叶片约重18.33 mg·cm-2,所以cm2·mL-1与 mg·mL-1之间可以互算。
1.3 数据分析
分别以提取液作空白,用紫外可见分光光度计在663和645 nm波长下测定吸光度,并依据Arnon公式[6]计算叶绿素含量(mg·dm-2)。
叶绿素a含量=(12.7A663-2.69A645)×[V/(1 000×W)];
叶绿素b含量=(22.9A645-4.68A663)×[V/(1 000×W)];
叶绿素总量=叶绿素a含量+叶绿素b含量=(20.21 A645+8.02 A663)×[V/(1 000×W)]。
在665和649 nm波长下测定吸光度,并用以下修正的Arnon公式[5]计算叶绿素含量(mg·dm-2)。
叶绿素a含量=(13.7A665-5.76A649)×[V/(1 000×W)];
叶绿素b含量=(25.8A649-7.6A665)×[V/(1 000×W)];
叶绿素总量=叶绿素a含量+叶绿素b含量=(6.10A665+20.04A649)×[V/(1 000×W)]。
式中:A663、A645、A665、A649分别为663、645、665和649 nm波长下的吸光度,V为提取液的体积(mL),W为叶片鲜重(g)或叶面积(cm2)。
采用Excel 2003处理数据,制作图表,曲线拟合分析;采用SPSS 19.0软件进行单因素方差分析和Duncan法多重比较,比较显著性水平设定为P=0.05。
2 结果与分析
2.1 叶绿素a含量随叶绿素提取液浓度的变化
两种不同提取液浸提的叶绿素溶液中,叶绿素a含量均随叶绿素提取液浓度的降低呈现先升高后逐渐平稳的变化趋势(图1,表1、2、3)。当溶液浓度高于0.80 cm2·mL-1,a1,a2和a3均随溶液浓度的降低而升高;而当浓度低于0.80 cm2·mL-1,三者均表现出基本一致的平稳曲线,a3>a2>a1。
方差分析和多重比较(表4)表明,a3显著高于a1和a2(P<0.05),说明乙醇-丙酮叶绿素提取液在663和645 nm波长下测得的叶绿素a含量与在665和649 nm波长下测得的叶绿素a含量差异显著,其与乙醇叶绿素提取液在665和649 nm波长下测得的叶绿素a含量差异也显著;a2与 a1差异不显著(P>0.05),这说明两种叶绿素提取液在相同波长点665和649 nm处测得的叶绿素a含量基本相同。表明,测定叶绿素a含量的叶绿素提取液适宜浓度应低于0.80 cm2·mL-1。
对a1、a2和a3这3条曲线进行二次曲线拟合(表5),相关系数分别为0.996 1、0.997 2和0.996 2,这表明所做的曲线拟合是合理的。由于叶绿素提取液浓度低于0.80 cm2·mL-1,3条叶绿素a变化曲线均处于平稳状态,取该浓度叶绿素提取液所测得的叶绿素a含量为y值,根据相应的拟合公式,对应的x值分别为0.75、0.78和0.77,这进一步说明测定叶绿素a含量的叶绿素提取液浓度应低于0.80 cm2·mL-1。

图1 叶绿素a含量随叶绿素提取液浓度的变化Fig. 1 The changes of chlorophyll a content with the concentration of chlorophyll extracts
a1、a2和a3分别表示3个方案中不同浓度梯度叶绿素提取液中的叶绿素a含量。
a1,a2and a3respectively represent the chlorophyll a contents in chlorophyll extracts from three different programmes.
2.2 叶绿素b含量随叶绿素提取液浓度的变化
两种不同提取液浸提的叶绿素溶液中,叶绿素b含量均随叶绿素提取液浓度的降低呈现先降低后逐渐平稳的变化趋势(图2,表1、2、3)。当溶液浓度高于0.80 cm2·mL-1,b1,b2和b3均随溶液浓度降低而快速降低;而当浓度低于0.80 cm2·mL-1,三者均表现出基本一致的平稳曲线,b2>b3>b1。
方差分析和多重比较(表4)表明,b1、b2和b3彼此间差异显著 (P<0.05),说明乙醇-丙酮叶绿素提取液在665和649 nm波长下测得的叶绿素b含量与在663和645 nm波长下测得的叶绿素b含量不同,两种叶绿素提取液在相同波长点665和649 nm处测得的叶绿素b含量也完全不同。表明,测定叶绿素b含量的叶绿素提取液适宜浓度应低于0.80 cm2·mL-1。
对b1、b2和b3这3条曲线进行二次曲线拟合(表5),相关系数分别为0.996、0.990和0.992,这表明所做的曲线拟合是合理的。由于叶绿素提取液浓度低于0.80 cm2·mL-1,3条叶绿素b变化曲线均处于平稳状态,取该浓度叶绿素提取液所测得的叶绿素b含量为y值,根据相应的拟合公式,对应的x值分别为0.80、0.80和0.81,进一步说明测定叶绿素b含量的叶绿素提取液浓度应低于0.80 cm2·mL-1。

表1 乙醇提取液提取枣树叶绿素含量(665/649 nm)Table 1 The extraction of chlorophyll content from jujube tree by ethanol extraction(665/649 nm)

表2 乙醇-丙酮提取液提取枣树叶绿素含量(665/649 nm)Table 2 The extraction of chlorophyll content from jujube tree by ethanol and acetone extraction(665/649 nm)

表3 乙醇-丙酮提取液提取枣树叶绿素含量(663/645 nm)Table 3 The extraction of chlorophyll content from jujube tree by ethanol and acetone extraction(663/645 nm)

表4 枣树叶绿素含量方差分析结果Table 4 The results of variance analysis of chlorophyll content in jujube tree leaves
同列不同小写字母者表示不同方案叶绿素含量间差异显著(P<0.05)。
Different lowercase letters within the same column indicate significant differences between different programmes at the 0.05 level.
2.3 叶绿素a/b比值随叶绿素提取液浓度的变化
两种不同提取液浸提的叶绿素溶液中,叶绿素a/b比值均随叶绿素提取液浓度的降低呈现先升高后逐渐平稳的变化趋势(图3,表1、2、3)。当溶液浓度高于0.80 cm2·mL-1,a1/b1,a2/b2及a3/b3比值均随溶液浓度降低而升高;而当浓度低于0.80 cm2·mL-1,三者均表现出基本一致的平稳曲线。
在方案1和方案3中虽然叶绿素提取液、比色波长点及叶绿素含量的计算公式均不同,但a1/b1和a3/b3比值的曲线几乎完全吻合。SPSS方差分析和Duncan多重比较(表4)表明,a1/b1和a3/b3间差异不显著(P>0.05)。这说明乙醇叶绿素提取液在长波光最大吸收峰665和649 nm波长下测得的a/b比值与乙醇-丙酮叶绿素提取液在长波光最大吸收峰A663和A645波长下测得的a/b比值完全相同。此外,a3/b3比值显著高于a2/b2比值(P<0.05),说明乙醇-丙酮叶绿素提取液在663和645 nm波长下测得的叶绿素a/b比值高于在665和649 nm波长下测得的。这表明测定叶绿素a/b比值的叶绿素提取液适宜浓度应低于0.80 cm2·mL-1。
对a1/b1,a2/b2及a3/b3比值的3条曲线进行二次曲线拟合(表5),相关系数分别为0.986、0.983和0.983,这表明所做的曲线拟合是合理的。由于叶绿素提取液浓度低于0.80 cm2·mL-1,3条叶绿素a/b比值变化曲线均处于平稳状态,取该浓度叶绿素提取液所测得的叶绿素a/b比值为y值,根据相应的拟合公式,对应的x值分别为0.77、0.78和0.78,进一步说明测定叶绿素a/b比值的叶绿素提取液浓度应低于0.80 cm2·mL-1。

表5 Excel曲线拟合分析结果Table 5 Excel curve fitting analysis results
y是叶绿素变化曲线稳定时的叶绿素浓度,*表示a/b比值;x是根据相应二次多项曲线拟合方程,与y对应的x值。
yis the chlorophyll concentration when the chlorophyll change curve is stable,* is a/b ratio;xis thexvalue corresponding toyaccording to the two multinomial curve fitting equation.

图2 叶绿素b含量随叶绿素提取液浓度的变化Fig. 2 The changes of chlorophyll b content with the concentration of chlorophyll extracts
b1、b2和b3分别表示3个方案中不同浓度梯度叶绿素提取液中的叶绿素b含量。
b1,b2and b3respectively represent the chlorophyll b contents in chlorophyll extracts from three different programmes.
在低于0.80 cm2·mL-1的浓度范围内,乙醇叶绿素提取液的a1/b1比值均在3.379左右(表1);乙醇-丙酮叶绿素提取液的a2/b2和a3/b3比值均分别在2.517和3.396左右(表2、3)。这个结果与C3植物a/b理论值约为3[7]的结论基本一致。而当溶液浓度高于0.80 cm2·mL-1时,a1/b1、a2/b2及a3/b3比值均随着浓度的降低迅速降低,这也说明测定叶绿素a/b比值的叶绿素提取液适宜浓度应低于0.80 cm2·mL-1。

图3 叶绿素a/b比值随叶绿素提取液浓度的变化Fig. 3 The changes of the ratio of chlorophyll a and b with the concentration of chlorophyll extracts
a1/b1、a2/b2和a3/b3分别表示3个方案中不同浓度梯度叶绿素提取液中的叶绿素a/b。
a1/b1,a2/b2和a3/b3respectively represent the chlorophyll a/b in chlorophyll extracts from three different programmes.
2.4 叶绿素总含量(a+b)随叶绿素提取液浓度的变化
两种不同提取液浸提的叶绿素溶液中,叶绿素总量均随叶绿素提取液浓度的降低呈现先升高后逐渐平稳的变化趋势(图4,表1、2、3)。当溶液浓度高于0.80 cm2·mL-1,a1+b1,a2+b2和a3+b3均随溶液浓度降低而升高;而当浓度低于0.80 cm2·mL-1,三者均表现出基本一致的平稳曲线。此外,a2+b2和a3+b3的曲线基本相吻合,这说明乙醇-丙酮叶绿素提取液在665和649 nm波长下测得的叶绿素总量与663和645 nm波长下测得的总量完全相同。乙醇提取液浸提的叶绿素总量相对前两者较低,差异明显,这可能与不同叶片厚度的差异,甚至同一叶片不同部位厚度的差异以及人为操作产生的误差有关,这些因素均会导致单位叶面积叶绿素含量的不同。这表明,测定叶绿素总量的叶绿素提取液适宜浓度应低于0.80 cm2·mL-1。
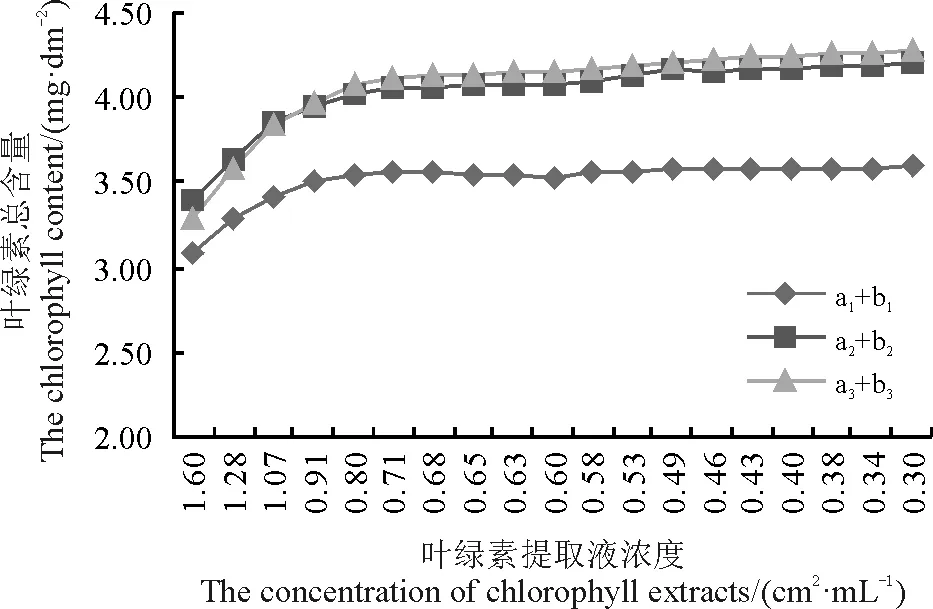
图4 叶绿素总量随叶绿素提取液浓度的变化Fig. 4 The changes of total chlorophyll content with the concentration of chlorophyll extracts
a1+b1、a2+b2和a3+b3分别表示3个方案中不同浓度梯度叶绿素提取液中的叶绿素总量。
a1+b1,a2+b2and a3+ b3respectively represent the chlorophyll (a+b) contents in chlorophyll extracts from three different programmes.
对a1+b1,a2+b2和a3+b3这3条曲线进行二次曲线拟合(表5),相关系数分别为0.986、0.995和0.995,这表明所做的曲线拟合是合理的。由于叶绿素提取液浓度低于0.80 cm2·mL-1,3条叶绿素总量变化曲线均处于平稳状态,取该浓度叶绿素提取液所测得的叶绿素总量为y值,根据相应的拟合公式,对应的x值分别为0.70、0.77和0.76,进一步说明测定叶绿素总量的叶绿素提取液浓度应低于0.80 cm2·mL-1。
2.5 吸光度及其比值随叶绿素提取液浓度的变化
两种不同提取液浸提的叶绿素溶液中,吸光度均随叶绿素提取液浓度的降低而降低(图5,表1、2、3)。其中,A665与A663的变化趋势一致,A649与A645的变化趋势一致。此外,A665/A649和A663/A645比值均随叶绿素提取液浓度的降低呈现先升高后逐渐平稳的变化趋势。当溶液浓度高于0.80 cm2·mL-1时,A665/A649和A663/A645比值均随溶液浓度降低而升高;而当浓度低于0.80 cm2·mL-1后,其与叶绿素a、叶绿素b、叶绿素a/b及叶绿素a总量呈现出完全一致的平稳曲线。结果表明,A665/A649和A663/A645比值达到稳定时的提取液浓度范围与测定叶绿素含量的适宜浓度范围完全一致;也就是说,吸光度比值是否平稳与能否准确测定叶绿素含量密切相关,通过吸光度比值的稳定状况可直接了解测得的叶绿素含量的可靠性。
2.6 吸光度的稳定性
通过多次比色观察表明,本研究中不同浓度梯度的叶绿素提取液在649与645 nm波长下的吸光度读数稳定;在665、663 nm波长下比色读数时,高浓度溶液的吸光度读数波动不稳定,但随着溶液浓度的降低吸光度读数逐步趋于稳定。此外,当乙醇叶绿素提取液稀释到0.71 cm2·mL-1时,在665 nm波长下的吸光度读数较稳定;当进一步稀释到0.681 cm2·mL-1(相当于48 mg·mL-1)以后,两种叶绿素提取液在665和649、663和645 nm波长下的吸光度读数均不再变化。
3 讨论与结论
本研究中的叶绿素含量测定结果表明,不论是乙醇叶绿素提取液还是乙醇-丙酮叶绿素提取液,当浓度低于0.80 cm2·mL-1(或14.67 mg·mL-1)时,叶绿素a含量、叶绿素b含量、叶绿素a/b比值及叶绿素总量均处于稳定水平,说明测定叶绿素含量的提取液适宜浓度应低于0.80 cm2·mL-1(或14.67 mg·mL-1)。对整个浓度范围(0.304~1.6 cm2·mL-1)内测定的结果进行二次曲线拟合,叶绿素a、b、a/b比值及叶绿素a+b总量的拟合方程相关系数均高于0.98,这充分说明所做的曲线拟合是合理的,依据这些拟合方程求得的值可以采用。以浓度为0.80 cm2·mL-1的叶绿素提取液所测得的叶绿素a、b、a/b比值及叶绿素a+b总量,根据拟合公式,求得的x值均等于或接近0.8(表5),这进一步说明测定叶绿素含量的叶绿素提取液浓度应低于0.80 cm2·mL-1。
比色分析的基本原理是Beer定律,它适用于低浓度溶液。枣树“金昌一号”叶片浸提液0.80 cm2·mL-1相当于14.67 mg·mL-1,这个浓度是比较低的,符合Beer定律的要求。本研究中叶绿素a/b比值的测定结果与许大全[2]的研究结果一致,他认为用于比色测定的叶绿素提取液的浓度过高,会导致叶绿素a/b比值的明显降低。舒展等[3]也认为叶绿素a/b比值的高低与用于比色的叶绿素提取液浓度有密切关系;当叶绿素提取液浓度在3.50~6.00 cm2·mL-1之间时,a/b比值变化不大,而在这个范围之外,a/b比值随提取液浓度的降低而升高,这与本研究结果不完全一致。许大全[2]认为除了氮肥缺乏、缺少叶绿素的突变体、患失绿症或叶片衰老等特殊情况外,绝大多数叶片的叶绿素含量均在400~600 mg·cm-2范围内。本研究发现,在低于0.80 cm2·mL-1的浓度范围内,乙醇叶绿素提取液的叶绿素a1+b1含量均在356.7 mg·cm-2左右,乙醇-丙酮叶绿素提取液的a2+b2和a3+b3含量均分别在413和420 mg·cm-2左右。而当溶液浓度高于0.80 cm2·mL-1,a1+b1、a2+b2和a3+b3含量均迅速降低,这也说明测定叶绿素总量的提取液适宜浓度应低于0.80 cm2·mL-1。那么,叶绿素提取液的最低浓度是多少时才能测出准确的叶绿素含量?陈守建[8]采用分光光度法对低浓度区域的测定值进行了分析,认为,当被测物含量很低时,分析数据是否具有意义是数据质量的一个重要方面,任何一个分析过程,不论使用何种精确的方法或高级仪器,都不能产生无限低的有意义的数据,根据统计学的概念,他把低浓度范围的检出划分为定性和定量两种,以银的分光光度法为例,定性检出限约为0.08 μg·mL-1,定量检测限为0.12 μg·mL-1。

图5 吸光度(A)及其比值随叶绿素提取液浓度的变化Fig. 5 The changes of absorbance (A) and their ratio with the concentration of chlorophyll extracts
1A665、1A649和1A665/1A649分别表示方案1中不同浓度梯度叶绿素提取液在665和649 nm波长点的吸光度及其比值;2A665、2A649和2A665/2A649分别表示方案2中不同浓度梯度叶绿素提取液在665和649 nm波长点的吸光度及其比值;A663、A645和A663/A645分别表示方案3中不同浓度梯度叶绿素提取液在663和645 nm波长点的吸光度及其比值。
1A665,1A649and 1A665/1A649respectively represent the absorbances and their ratios of different concentration chlorophyll extracts at 665 nm and 649 nm in programme 1;2A665,2A649and 2A665/2A649respectively represent the absorbances and their ratios of different concentration chlorophyll extracts at 665 and 649 nm in programme 2;A663,A645and A663/A645respectively represent the absorbances and their ratios of different concentration chlorophyll extracts at 663 and 645 nm in programme 3.
大量资料显示,浸提法测定植物叶绿素含量多采用乙醇与丙酮混合液(不同体积比混合)作提取液[9-12],也有单纯采用乙醇溶液[13-15]或丙酮溶液[16-17]作浸提液的。杨振德[18]认为,采用分光光度法测定的植物材料叶绿素含量根据提取液的不同而呈现不同的结果。刘彩云[19]则认为叶绿素提取时,待测植物材料本身对提取试剂并无特异性,好的提取方法、试剂对不同植物材料均适用。本研究结果表明,以枣树“金昌一号”叶片为试材,乙醇和乙醇-丙酮两种浸提液在相同的最大吸收峰665和649 nm处测得的叶绿素a基本相同,两种浸提液分别在不同的最大吸收峰665和649 nm处和663和645 nm处测得的叶绿素a/b比值(a1/b1与a3/b3间差异不显著,P>0.05) 也相同,乙醇-丙酮浸提液在不同的最大吸收峰665和649 nm处和663和645 nm处测得的叶绿素a+b总量(a2+b2与a3+b3间差异不显著,P>0.05)几乎完全相同;在同等条件下,两种浸提液测得的叶绿素b(b1、b2和b3彼此间差异显著,P<0.05)均不相同,乙醇-丙酮浸提液在663和645 nm处测得的a3分别与在665和649 nm处测得的a2和乙醇浸提液在665和649 nm处测得的a1间、乙醇-丙酮浸提液在665和649 nm处测得a2/b2分别与在663和645 nm处测得的a3/b3和乙醇浸提液在665和649 nm处测得的a1/b1间、乙醇浸提液在665和649 nm处测得的a1+b1分别与乙醇-丙酮浸提液在两大吸收峰处测得的a2/b2和a3/b3间均差异显著(P<0.05)。因此,本研究结果与杨振德的试材相同,提取液不同,测定结果就不同的研究结果不完全一致。
本研究结果还表明,用紫外分光光度计比色时,叶绿素提取液浓度越低,吸光度读数越稳定;当浓度低于0.681 cm2·mL-1(或12.48 mg·mL-1)时,在665、649 nm波长下的吸光度读数与663、645 nm波长下的读数均趋于稳定。当叶绿素提取液浓度低于0.80 cm2·mL-1时,A665/A649和A663/A645比值与叶绿素a、叶绿素b、叶绿素a/b比值及叶绿素a+b总量均表现出完全相似的平稳特征,说明A665/A649和A663/A645比值的稳定与准确测定叶绿素含量密切相关。
长期以来,人们测定植物叶片叶绿素含量时,通常以质量单位(g)或面积单位(cm2)所含叶绿素多少(mg)来表示叶片叶绿素含量,由于不同物种叶片叶绿素含量不同,或相同物种不同叶片厚度不同,甚至同一叶片不同部位厚度不同,都会产生试验误差。以质量单位测定叶绿素含量,试验操作繁琐人为误差较大,以面积单位测定叶绿素含量,在叶片主脉两侧对应部位以面积单位取材,操作简便人为误差相对较小。采用面积单位测定不同枣树品种叶片叶绿素含量在枣树整个生长期具有一致的变化规律[20],尤其用不同溶剂提取相同枣树品种叶片的叶绿素含量完全相同[21]。
