红麻HcWRKY20基因的克隆与表达特征分析
2018-08-29潘根赵立宁陈安国李建军黄思齐唐慧娟常丽邓勇李德芳
潘根,赵立宁,陈安国,李建军,黄思齐,唐慧娟,常丽,邓勇,李德芳
(中国农业科学院麻类研究所,长沙410205)
WRKY转录因子是植物特有的一类转录因子,它包含一段高度保守的、约60个氨基酸残基组成的WRKY结构域,其保守的WRKYGQK氨基酸序列位于N端,而C端通常有锌指结构(Zincfinger motif)。其功能的行使主要是通过与目标基因启动子区域的W-box结合来调节下游基因的表达[1]。根据WRKY结构的数目以及锌指结构的类型,WRKY转录因子被划分成3类(Ⅰ、Ⅱ和Ⅲ)。Ⅰ类WRKY转录因子包含两个WRKY结构域,其锌指结构类型为C2H2;Ⅱ、Ⅲ类WRKY转录因子只含有1个WRKY结构域,但锌指结构域的类型不同,Ⅱ类的锌指结构类型为C2H2,Ⅲ类为 C2HC[1]。
WRKY转录因子被大量报道参与植物的生长发育进程、生物胁迫及非生物胁迫响应的调控[2-5]。在水稻中过表达OsWRKY53后,株高变高,对水稻褐飞虱的抗性提高,但同时增加了水稻对二化螟的感虫性[6-8]。在短日照条件下,拟南芥中AtWRKY12和AtWRKY13参与调控拟南芥开花的途径[9]。在烟草中异位表达棉花转录因子GhWRKY17能够提高烟草对盐和干旱胁迫的耐性[10]。作为植物中重要的转录因子,WRKY转录因子家族在大量物种如水稻、拟南芥等作物中被鉴定出来[10-13]。通过分析本实验室镉胁迫下红麻的转录组数据,克隆了一个红麻转录因子Hc-WRKY20序列,本研究进一步对该基因进行克隆并进行生物信息学分析及不同外界胁迫下的表达特性研究,旨在为进一步解析该基因生物学功能奠定基础。
1 材料与方法
1.1 试验材料及处理
中红麻16号为本课题组提供。挑选籽粒饱满的种子,待种子发芽后,移入1/2Hoag-land营养液中继续培养,间隔3 d更换营养液。
待红麻长至4叶1心时进行如下处理:外源激素处理:分别对红麻叶片进行外源10 mmol/L水杨酸(SA)和1 mol/L油菜素内酯(BR)喷施,不含上述激素的水溶液为空白对照,待喷施6 h后,分别对其叶片取样用于RNA提取,每个处理重复3次,每个重复3棵幼苗,SA和BR分别溶于纯酒精中,然后稀释成相应浓度的工作液;盐胁迫处理:4叶1心的红麻幼苗种植于50 mmol/L NaCl的1/2Hoag-land营养液中,处理2 d后,取红麻根部用于RNA提取;镉胁迫处理:4叶1心的红麻幼苗种植于25 mmol/L CdCl2的1/2Hoag-land营养液中,处理2 d后,取红麻根部用于RNA提取。
1.2 引物设计
参考红麻转录组序列信息,利用Primer5.0进行引物设计,序列由擎科生物技术公司合成。基因克隆的引物序列:Primer-F(5’-3’):ATGCTGTGCCAAGTAACTTG;Primer-R(5’-3’):TTATGGACCTGTTAGTACTCT。
1.3 RNA提取
参照植物总RNA提取试剂盒(DP432,天根生化有限公司)的说明书提取总RNA,其完整性和纯度用1.0%的琼脂糖凝胶电泳检测。
1.4 HcWRKY20的克隆
提取红麻幼苗总RNA,反转录合成cDNA,以1μL反转录产物为模板进行PCR扩增,PCR反应体系:10×LAPCR Buffer(Mg2+plus)2.5μL,LA Taq(TaKaRa)0.25μL,dNTP(2.5 mmol/mL)1μL,F-primer(10 mol/mL)0.25μL,R-Primer(10 mol/mL)0.25μL,cDNA 1μL,dH2O补足至25μL。反应程序:94℃2 min;98℃30 s,55℃30 s,68℃60 s,30个循环;68℃10 min,反应终止于10℃,反应结束后,取20μL PCR产物进行1%琼脂糖凝胶电泳,对目标片段进行割胶回收,其PCR产物连接到pMD18-T载体上,转化至DH5α感受态细胞,送擎科生物技术公司进行测序。
1.5 HcWRKY20的生物信息学分析
对红麻镉胁迫下转录组数据(未发表)中Unigene的注释进行“WRKY”关键词搜索,利用BioEdit获得HcWRKY20转录组序列信息。进一步通过BioXM 2.0(黄骥,南京农业大学)寻找该基因的最大开放阅读框,并利用该软件预测其氨基酸序列。在NCBI(https://blast.ncbi.nlm.nih.gov/Blast.cgi)中对HcWRKY20进行氨基酸序列比对(BlastP),利用MEGA7.0构建进化树,分析该基因的进化关系。利用PSORT Prediction(https://psort.hgc.jp/)预测其蛋白亚细胞定位情况,同时用ExPASy(www.expasy.ch/tools/pi_tool.html1)分析其蛋白质的分子量及等电点。
1.6 HcWRKY20在不同胁迫及外源激素处理下表达量分析
采用实时荧光定量PCR(qRT-PCR)研究HcWRKY20在不同处理下的表达特征。通过Primer 5.0设计目的基因引物,F(5’-3’):CTGCTGCGTGTTCTAATGCT;Primer-R(5’-3’):GGCGTCTCATGATCCGAAAG;内参引物为 actin,引物序列为:F(5’-3’):ATCCTCCGTCTTGACCTTG;Primer-R(5’-3’):TGTCCGTCAGGCAACTCAT。qRT-PCR反应体系为(20μL):2×SYBR qPCR Mix 10μL,正向和反向引物各1μL,cDNA为2μL,ddH2O为6μL,反应程序为:94℃2 min,94℃10 s,60℃34 s,40个循环,根据CT值,采用2-△△CT分别计算出目标基因的表达量。
2 结果与分析
2.1 样品RNA的提取与质量检测
利用天根植物总RNA试剂盒提取红麻幼苗总RNA,然后用1%琼脂糖检测RNA质量。如图1所示,核糖体28S、18SRNA条带清晰,且28S条带亮度约为18S的两倍,表明RNA结构完整,无污染和降解,可用于后续试验。
2.2 HcWRKY20的克隆
以红麻镉胁迫下转录组获得HcWRKY20的序列为基础,利用Primer 5.0设计的特异性引物,以红麻cDNA为模板进行PCR扩增,产物用1%琼脂糖进行检测,其结果如图2所示。对目标片段进行割胶回收,回收产物连接到pMD18-T载体,转化至DH5α感受态细胞,经培养后,挑选阳性单克隆送湖南擎科生物技术有限公司进行测序。获得的序列在NCBI网站通过Blast比对发现与其他物种中WRKY20基因高度同源,所以该基因命名为HcWRKY20。
图1 1%琼脂糖检测RNA质量Fig.1 Detection of RNA quality by 1%agarose gel electrophoresis

图2 HcWRKY20 CDS全长片段Fig.2 The CDSfull length fragment of HcWRKY20
2.3 HcWRKY20的生物信息学分析
利用BioXM 2.7对测序所获得的cDNA序列进行开放阅读框(ORF)预测,由图3可知,其全长为1512 bp,推测其编码503个氨基酸,等电点为7.33,分子量为55.77 KD。蛋白保守结构预测结果表明,HcWRKY20分别在162-168位和282-294位氨基酸包含一段高度保守的WRKYGQK七肽序列,同时含有C2H2锌指结构(见图3)。上述结果表明,HcWRKY20属于Ⅰ类WRKY转录因子家族成员。蛋白亚细胞定位预测表明,HcWRKY20在326-332含有一段核定位信号基序(DDPFSKRRKMDGW),主要定位在细胞核内,可能在细胞核中行使转录激活/抑制功能。

图3 HcWRKY20全长ORF序列及氨基酸序列Fig.3 Full-length ORF sequence and amino acid sequence of HcWRKY20
将该基因编码的氨基酸在NCBI网站进行BlastP比对发现,该基因氨基酸序列与雷蒙德氏棉、陆地棉、二倍体棉、可可、榴莲以及哥伦比亚锦葵中WRKY20序列具有较高的相似性,其同源性高达70%以上。进一步利用MEGA 7.0软件构建了HcWRKY20系统进化树(见图4),结果表明红麻HcWRKY20与雷蒙德氏棉、陆地棉、二倍体棉亲缘关系较近,与可可、哥伦比亚锦葵亲缘关系较远。

图4 红麻HcWRKY20基因系统进化树分析Fig.4 Phylogenetic tree analysis of HcWRKY20 gene in kenaf
2.4 HcWRKY20表达特征分析
2.4.1 HcWRKY20在不同的组织表达特异性分析
为了更好的了解HcWRKY20的生理功能,对HcWRKY20在苗期的不同组织(根、茎、叶)中进行了表达水平的分析。如图5A所示,HcWRKY20在不同组织中表达量存在差异,在根和叶中表达量较高,而在茎中表达量较低,暗示该基因可能主要在根和叶中发挥功能。
2.4.2 NaCl等非生物胁迫下HcWRKY20基因表达分析
如图5B所示,外源NaCl及重金属镉胁迫处理两天后,HcWRKY20的表达水平均显著高于对照处理。尤其在NaCl胁迫处理2 d时,HcWRKY20的表达量水平约为对照处理的8倍。上述结果表明,非生物胁迫(Cd和NaCl)能够诱导HcWRKY20基因的表达。
2.4.3 外源油菜素内酯(BR)、水杨酸(SA)处理后表达分析
前人研究[5,14]表明,WRKY类转录因子受到BR和SA诱导表达。如图5C所示,外源SA处理6 h后,HcWRKY20受到显著的诱导表达,而外源BR喷施6 h后,HcWRKY20的表达水平受到显著的抑制。
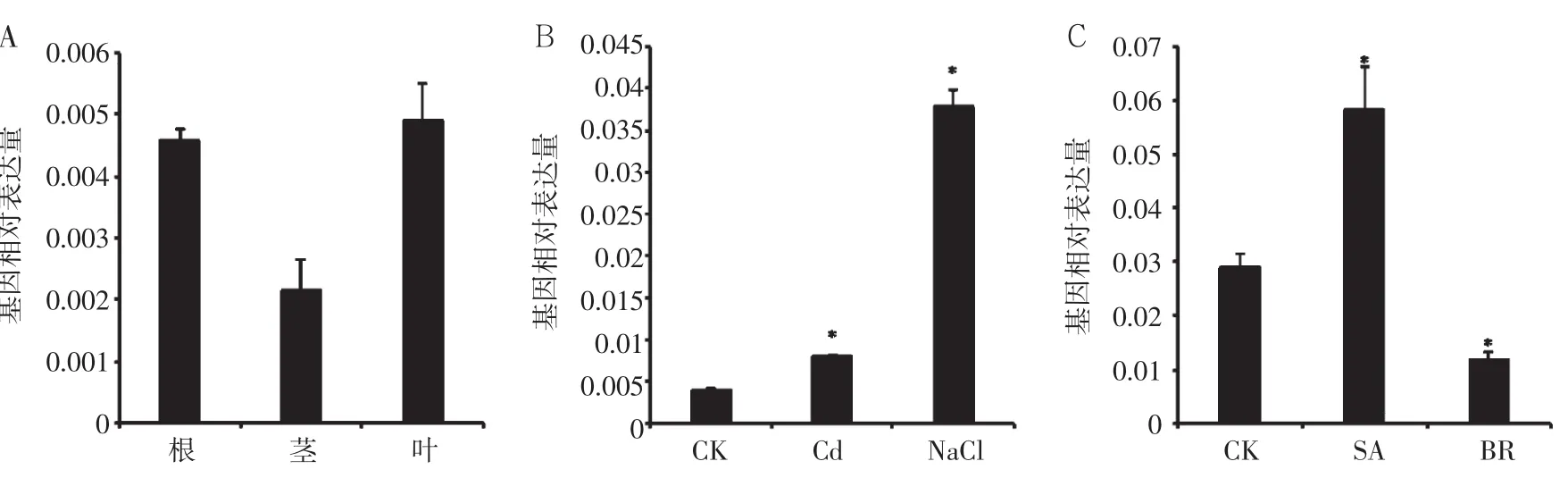
图5 HcWRKY20基因不同组织及外源处理下表达水平分析Fig.5 Expression level analysis of HcWRKY20 in different tissues under different exogenous treatment in kenaf
3 讨论
红麻(Hibcus cɑnnɑbinus L.)是锦葵科木槿属一年生速生纤维作物,适应性广,被广泛地用于造纸、墙布、麻地膜、饲料等方面。关于红麻基因的分离、鉴定和克隆报道较少。通过RACE技术从红麻质核互作雄性不育系中克隆了红麻atp1基因[14]。基于本实验室镉胁迫下红麻转录组数据信息,本研究从高产多抗红麻品种“中红麻16号”中克隆HcWRKY20基因。该基因全长为1512 bp,推测其编码503个氨基酸,包含两个保守的WRKYGQK七肽序列,属于Ⅰ类WRKY转录因子家族成员。HcWRKY20为红麻第一个被克隆的WRKY转录因子家族成员,其在红麻生长、发育及外界胁迫中的作用需进一步研究。
为了探究HcWRKY20潜在的生物学功能,本研究分析该基因在外源激素和不同生物胁迫下表达情况。外源SA处理能够诱导HcWRKY20的表达,而BR抑制该基因的表达,暗示SA与BR以拮抗方式调控HcWRKY20表达,该研究结果与前人[15]在水稻中的研究结果类似。本研究同时也发现外源Cd和NaCl处理能够显著诱导HcWRKY20的表达。前人研究[16]表明,大豆GmWRKY20基因受到盐、冷害及干旱诱导,且在拟南芥中异位表达该基因能够显著提高拟南芥对干旱的耐性;在苜蓿中过表达野生大豆GsWRKY20能够显著提高苜蓿对干旱和盐胁迫的耐受性[17],HcWRKY20是否参与调控植物干旱胁迫还待进一步研究。本研究发现HcWRKY20受外源逆境相关激素SA和胁迫(Cd、NaCl)诱导表达,暗示该基因可能参与调控植物逆境胁迫反应。后期研究中需通过转基因实验验证HcWRKY20在红麻逆境胁迫中的生物学功能。
