抑制Notch信号通路减少大鼠膝骨关节炎关节软骨内MMP-13的上调和Col Ⅱ的降低
2018-08-21薛太阳曾娟刘士嘉田野
薛太阳,曾娟 ,刘士嘉,田野
(中国医科大学附属盛京医院脊柱关节骨科,沈阳110004)
骨性关节炎(osteoarthritis , OA)是最常见的慢性关节疾病[1],以关节软骨退变、滑膜增生、骨赘形成以及软骨下骨硬化为特征,临床上主要表现为关节疼痛、畸形、活动受限等症状,严重影响生活质量[2]。在所有的骨性关节炎中,膝关节骨性关节炎发生的几率最高[3]。虽然目前对于膝关节骨性关节炎发生的病理生理因素没有明确,但公认的是膝关节骨性关节炎的发病是多因素的。目前对于膝关节OA的治疗停留在早期通过应用非甾体抗炎药物、关节腔注射透明质酸等、减少运动量等方法来控制症状、延缓病情,晚期则建议进行手术治疗以改善患肢功能、提高生活质量、矫正畸形等[4,5]。由于膝关节OA发病率的增高以及该疾病的高致残疾率,使得对于OA病因及治疗的研究越来越受到重视。目前,对于OA的发病机制尚不明确,但是多数学者认为信号通路在OA疾病发生及进展中起关键作用。在OA的发生与进展过程中,存在多条信号通路的参与,包括Notch、 Wnt、OPG-RANK-RANKL、SDF-1/CXCR4及p38-MAPK等[6],其中Notch信号通路已经被证实在软骨细胞增殖、分化的调控[7]、细胞外基质的形成[8]以及维持软骨基质代谢平衡等方面起着十分重要的作用。
本研究通过建立大鼠膝骨关节炎模型并对其中部分采用γ-分泌酶(γ-secretase)抑制剂(2S)-N-[N-(3,5-二氟苯乙酰基)-L-丙氨酰]-2-苯基甘氨酸叔 丁 酯{(2S)-N-[N-(3,5-Difluorophenacetyl)-L-alanyl]-2-phenylglycine tert-butyl ester,DAPT}[9]进行膝关节腔注射以抑制Notch信号通路[10], HE染色观察骨关节炎关节软骨的组织病理学变化,利用免疫组织化学染色检测关节软骨内基质金属蛋白酶13(matrix metalloproteinases-13, MMP-13)、Ⅱ型胶原蛋白( type Ⅱ collagen, Col Ⅱ)免疫反应性变化,以分析抑制Notch信号通路对骨关节炎进展的影响。
材料和方法
1 实验动物
6周龄雄性SD大鼠60只,体重180~200g,由本溪长生公司提供 [许可证号:SCXK(辽)2015.0001]。分笼适应性饲养2周(22℃,充足食水)后随机分为6周空白组、6周手术组、6周抑制组、8周空白组、8周手术组和8周抑制组。
2 主要试剂
兔抗鼠 MMP-13多克隆抗体(武汉博士德,BA2204),兔抗鼠Ⅱ型胶原蛋白多克隆抗体(武汉博士德,BA0533),DAPT(Selleckchem,S2215),10%中性福尔马林(Solarbio,G2161),EDTA脱钙液(Solarbio,E1171),HE显色试剂盒(Solarbio,G1120),抗原修复液I(武汉博士德,AR0026),免疫组织化学试剂盒(包含内源性过氧化物酶阻断剂,动物非免疫血清,生物素标记的羊抗鼠/兔IgG,链霉菌抗生物素蛋白-过氧化酶;迈新试剂,KIT-9720),DAB显色液(武汉博士德,AR1002)。
3 主要仪器及应用软件
组织包埋机(Leica EG1150H),石蜡切片机(Thermo Microm HM340E,切片机刀片Leica 819),全自动过缸染色机(Leica Autostainer XL),恒温箱(天津泰斯特 DH4000),显微镜(Nikon E800),图像采集软件 (NIS-Elements F3.0,Nikon),图像分析软件(NIS-Elements Br3.0,Nikon)。
4 膝骨关节炎动物模型建立与干预
将大鼠腹腔注射10%水合氯醛[11]进行麻醉,右后肢膝关节进行手术切断前交叉韧带,行前抽屉试验确定前交叉韧带完全切断,清理残端,股骨端切断内侧副韧带并摘除内侧半月板[12],手术过程中注意保护关节软骨,生理盐水棉球止血,缝合,消毒。术后光照2h保持体温待大鼠苏醒后单独放置于笼中,允许正常活动,常规饲食水。于术后2周,大鼠右后肢着地可用力后,6周抑制组及8周抑制组大鼠右后肢膝关节腔注射DAPT(100ng/kg),6周手术组及8周手术组右后肢膝关节注射等体积生理盐水,每周两次。空白组不进行干预。
5 标本采集与石蜡包埋
术后6周和8周分别处死相应组别大鼠,截取右后肢膝关节股骨内侧髁,入10%中性福尔马林固定72h,PBS液冲洗,EDTA脱钙液浸泡1个月,其间1周更换一次脱钙液,脱钙后流水冲洗10min,顺序置入50%乙醇2h、75%乙醇2h、95%乙醇2h、无水乙醇I 2h、无水乙醇II 2h、二甲苯I 30min、二甲苯II 30min、65℃石蜡液I 1h、65℃石蜡液II 1h,石蜡包埋机包埋。
6 HE染色
包埋后的标本用切片机切4μm标本切片,捞片、烤片、65℃恒温箱过夜,脱蜡、脱苯、至水。滴加苏木素5min染色后甩去,滴加分化液30s,自来水返蓝10min,滴加伊红液2min,自来水冲洗10min。脱水、透明、中性树胶及盖玻片封片。
7 基质金属蛋白酶13(MMP-13)免疫组织化学实验
包埋后的标本以切片机切4μm标本切片,捞片、烤片、65℃恒温箱过夜,脱蜡、脱苯、至水。抗原修复液进行抗原修复(37℃,30min),PBS液冲洗3次,滴加内源性过氧化物酶阻断剂(室温30min),PBS液冲洗3次,滴加非免疫血清室温孵育30min,甩去,滴加 MMP-13(1∶150)或 ColⅡ(1∶20),4℃过夜,PBS液冲洗3次,滴加生物素标记的二抗(室温30min),PBS液冲洗3次,滴加链霉菌抗生物素蛋白-过氧化酶(室温30min),PBS冲洗3次,滴加DAB显色液至镜下开始显色,水洗,苏木素染色5min,流水返蓝10min。脱水、透明、中性树胶及盖玻片封片。以40倍物镜下拍照,通过图像分析软件NIS-Elements Br 3.0进行图像分析,以光密度值(optical density,OD)作为MMP-13或Col Ⅱ免疫反应性强弱指标。
8 统计学分析
采用GraphPad Prism 5.0统计软件进行统计学分析。全部数据以均数 ± 标准差表示,组间比较采用t检验,P < 0.05为组间差异有统计学意义。
结 果
1 DAPT 抑制骨关节炎关节软骨组织学损害
HE染色检测显示(图1),正常(空白组)大鼠膝关节软骨面平整,四层软骨结构及潮线清晰,软骨细胞排列整齐;6周手术组膝关节软骨面不规则,有小裂纹及破溃,潮线识别度较差,四层软骨结构欠清晰,软骨细胞中度增生;6周抑制组膝关节软骨面略粗糙,可见裂纹及破溃,4层软骨结构可辨别,潮线可识别,软骨细胞轻度增生,排列尚可;8周手术组软骨面严重不规则,裂纹及破溃可达深层,潮线及四层软骨结构无法辨别,软骨细胞大量减少,出现局部增生,排列紊乱;8周抑制组软骨面不规则,有较大裂纹及破溃,潮线识别度差,4层软骨细胞结构不清晰,软骨细胞弥漫增生,细胞排列紊乱。8周手术组大鼠膝关节软骨破坏较6周手术组大鼠膝关节软骨破坏程度严重,6周抑制组大鼠膝关节软骨破坏较6周抑制组大鼠膝关节软骨破坏严重程度减轻,8周抑制组大鼠膝关节软骨破坏较8周手术组大鼠膝关节软骨破坏程度减轻。
2 DAPT抑制骨关节炎关节软骨内MMP-13免疫反应性增强
应用免疫组织化学检测对各组软骨内MMP-3免疫反应性进行比较显示(图2,图3): 8周空白组与6周空白组比较无明显差异,8周手术组较6周手术组明显增强,6周手术组较6周空白组明显增强,8周手术组较8周空白组明显增强,6周抑制组和8周抑制组分别较6周手术组和8周手术组减弱,说明骨关节炎关节软骨中MMP-13免疫反应性与骨关节炎严重程度呈正相关,抑制Notch信号通路可显著抑制骨关节炎关节软骨中MMP-13免疫反应性的增强。
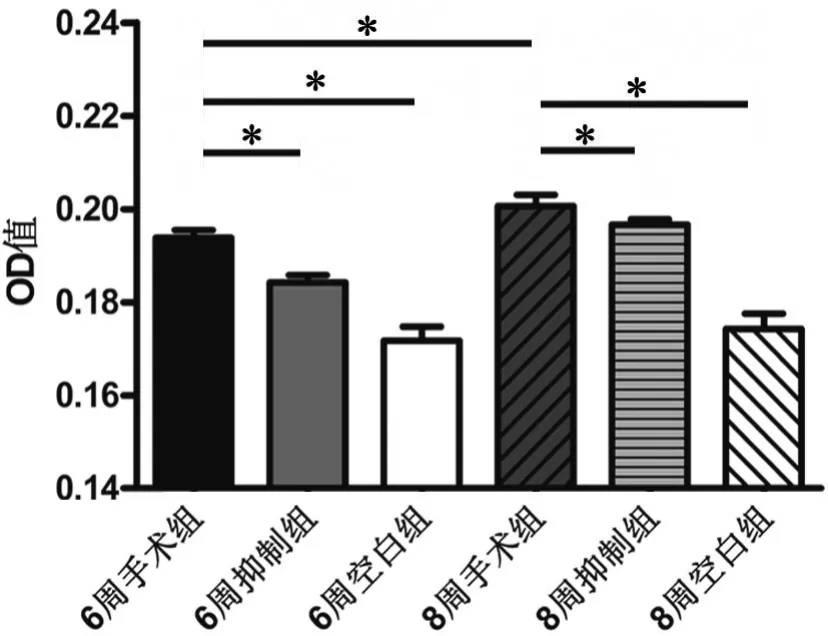
图3 DAPT处理对骨关节炎关节软骨内MMP-3免疫反应性影响的统计学分析。*,P<0.01Fig. 3 Statistical analysis of the MMP-13 levels in articular cartilage of rat knee osteoarthritis among different treatment groups. *, P<0.01
3 DAPT 抑制骨关节炎关节软骨内Ⅱ型胶原蛋白减少
应用免疫组织化学检测对各组软骨内Ⅱ型胶原蛋白免疫反应性进行比较显示(图4,图5): 8周空白组与6周空白组比较无明显差异,8周手术组较6周手术组明显降低,6周手术组较6周空白组明显降低,8周手术组较8周空白组明显降低,6周抑制组和8周抑制组分别较6周手术组和8周手术组增强,说明骨关节炎关节软骨中Ⅱ型胶原蛋白免疫反应性与骨关节炎严重程度呈负相关,抑制Notch信号通路可显著抑制骨关节炎关节软骨中Ⅱ型胶原蛋白免疫反应性的降低。
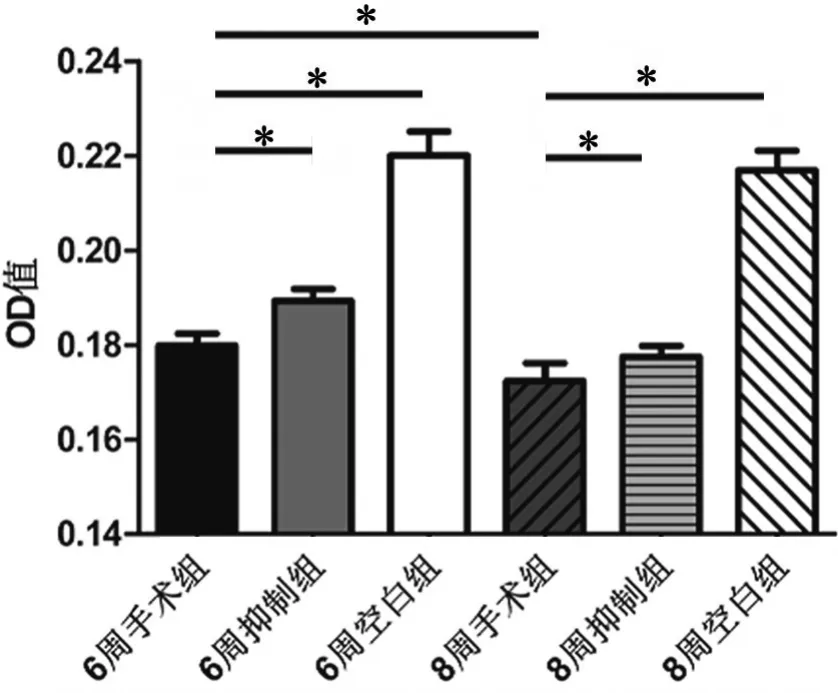
图5 DAPT处理对骨关节炎关节软骨内Col Ⅱ免疫反应性影响的统计学分析。*,P<0.01Fig. 5 Statistical analysis of the Col II levels in the articular cartilage of rat knee osteoarthritis among different treatment groups. *, P<0.01
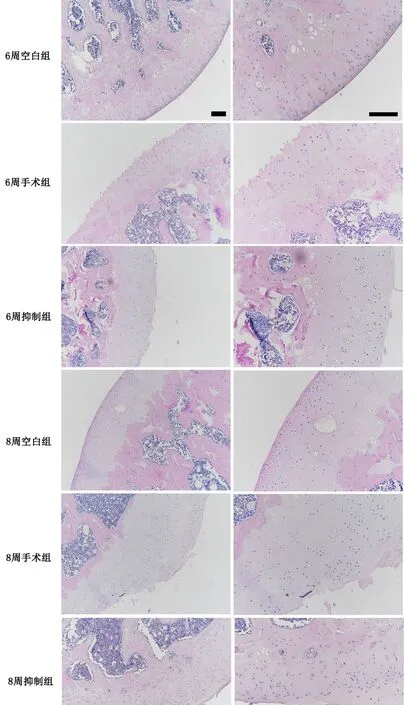
图1 DAPT处理对骨关节炎关节软骨组织病理学影响的HE染色检测。比例尺,200μmFig. 1 The effect of DAPT on the histopathology of articular cartilage was evaluated by HE staining in rat knee osteoarthritis. Scale bar, 200μm
讨 论
与正常人相比,OA患者关节滑膜中Notch受体表达的类型差异明显[13]。Notch信号通路在OA软骨中特异性表达,通过对于基因转录的调控,使OA呈现出不同的表型[14];VEGF信号通路以及Notch信号通路进行联合调控对PMSCs的软骨修复有协同作用[15]。可见Notch信号通路在软骨细胞分化调控方面起到的作用十分复杂[16],其作用可能是双向的[17]。目前文献报道Notch信号通路作用的在体研究较少,本实验通过建立大鼠模型并使用DAPT进行大鼠膝关节腔注射来抑制Notch通路以探究Notch信号通路抑制后大鼠膝骨关节炎进展情况。
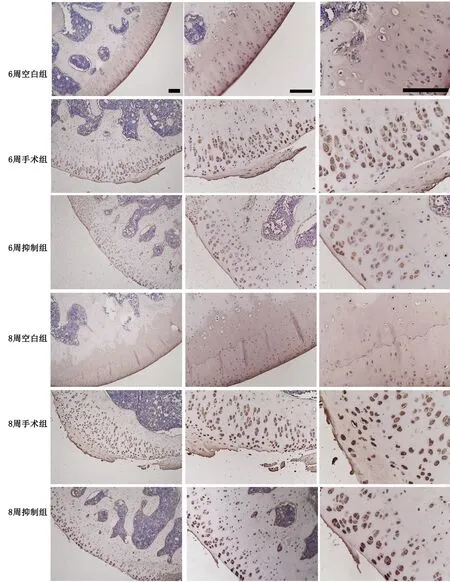
图2 DAPT处理对骨关节炎关节软骨内MMP-13水平影响的免疫组织化学检测。比例尺,200μmFig. 2 The effect of DAPT on MMP-13 level in the articular cartilage of rat knee osteoarthritis was assessed using immunohistochemistry. Scale bar,200μm
由于伦理原则等原因,对于骨关节炎及防治方法的在体研究主要依赖于动物OA模型。鼠类关节组织的结构以及在患OA时关节形态学方面、实验室指标等与人类患者较为相似[18],所以多选用鼠类建立OA模型。本实验选用SD大鼠进行膝骨关节炎造模,选用了半改良Hulth法,即在改良Hulth法切断前交叉韧带并摘除内侧半月板的基础上,切断内侧副韧带,并保留了Hulth法切断的后交叉韧带[19],使骨关节炎模型建立速度控制在需求范围内。
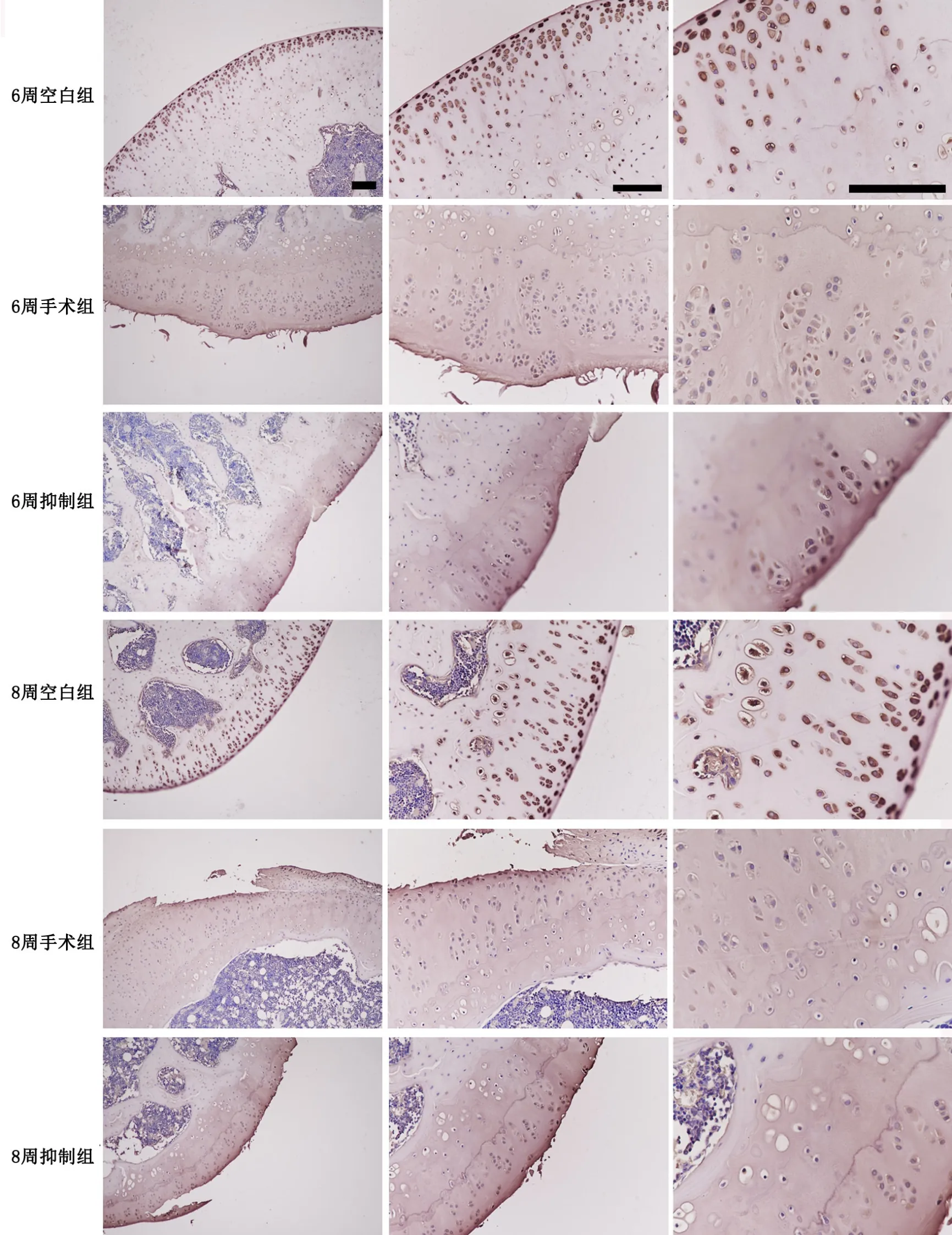
图4 DAPT处理对骨关节炎关节软骨内Ⅱ型胶原蛋白水平影响的免疫组织化学检测。比例尺,200μmFig. 4 The effect of DAPT treatment on Col Ⅱ level in the articular cartilage of rat knee osteoarthritis was evaluated by immunohistochemistry. Scale bar, 200μm
目前研究认为基质金属蛋白酶家族(MMPs),尤其是MMP-13在骨关节炎发展过程中起重要作用[20]。软骨细胞合成Ⅱ型胶原蛋白、蛋白多糖等并分泌到细胞外基质,形成纤维网架结构对软骨细胞进行保护。在骨关节炎发展过程中,MMP-13表达增加使得Ⅱ型胶原蛋白降解增多,Ⅱ型胶原蛋白降解与分泌失衡[21],细胞外基质纤维网架结果遭到破坏,损伤软骨细胞。在骨关节炎软骨细胞中,MMP-13表达与骨关节炎严重程度呈正相关,而Ⅱ型胶原蛋白表达程度与骨关节炎严重程度呈负相关。本实验对各组软骨细胞MMP-13及Ⅱ型胶原蛋白表达情况进行分析表明,随着骨关节炎的发生发展,MMP-13的表达及Ⅱ型胶原蛋白破坏的增加得到了验证;抑制Notch信号通路后,MMP-13表达降低,Ⅱ型胶原蛋白破坏减少,骨关节炎减轻。由此可见,抑制Notch信号通路可能通过抑制骨关节炎关节软骨内MMP-13表达的上调而减少Ⅱ型胶原蛋白降解,从而减轻骨关节炎。
