全反式维甲酸诱导P19细胞系长非编码RNA Neat1基因表达
2018-07-16范学哲张艳君
范学哲,王 静,张艳君, 张 业
(中国医学科学院基础医学研究所 北京协和医学院基础学院, 北京 100005)
神经细胞形成是复杂的调控过程,在神经分化模型中研究其调控机制简化了神经分化调控网络的研究复杂度,atRA诱导P19细胞分化模型是目前研究神经分化的成熟模型之一[1-2]。组蛋白转录后修饰维持正常神经分化过程,研究组蛋白修饰是研究表观遗传在神经分化过程中的功能最主要的方式之一[3-4]。曲古抑菌素(trichostatin A,TSA)是特异的Ⅰ类和Ⅱ类组蛋白去乙酰化酶抑制剂[5],但它无法抑制第Ⅲ类组蛋白的去乙酰化酶活性,烟酰胺(nicotinamide,NAM)可抑制Ⅲ类组蛋白去乙酰基酶活性[6]。腺苷二醛(adenosine dialdehyde,AdOx)是甲基转移酶抑制剂[7]。利用组蛋白修饰抑制剂研究组蛋白修饰对基因表达调控的影响已成为研究表观遗传机制的高效手段。LncRNA Neat1在神经兴奋中起重要作用,其表达量依赖于神经兴奋性[8]。但LncRNA Neat1在神经分化过程中的调节机制尚不清楚,本实验通过研究LncRNA Neat1表达量在atRA诱导P19分化的过程中变化,进而发现组蛋白修饰对于Neat1表达的影响。
1 材料与方法
1.1 材料
1.1.1试剂:α-MEM(Gibco公司);胎牛血清(中国医学科学院血液研究所);Trizol(Invitrogen公司);RNAVzol(Vigofect公司);M-MLV反转录酶和RNase-free DNase Ⅰ(Promega公司);SYBR Premix Ex Taq、Ribonuclease Inhibitor、dNTP(TaKaRa公司)。
1.1.2药物:全反式维全酸(atRA)、腺苷二醛(AdOx)、古柳抑菌素(TSA)、烟酰胺(NAM)(Sigma-Aldrich公司)。
1.1.3细胞:小鼠畸胎瘤细胞P19细胞系(中国医学科学院基础医学研究所细胞资源中心)。
1.2 方法
1.2.1P19细胞培养及atRA诱导分化:在含10%胎牛血清的α-MEM完全培养基,5% CO2、37 ℃条件下贴壁培养小鼠畸胎瘤细胞系P19,将培养的P19细胞用胰蛋白酶消化后,以1×105个/mL细胞接种于细胞培养皿中,24 h后,利用含终浓度0.5 μmol/L atRA的α-MEM培养基培养细胞。4 d后,将成团的细胞用胰蛋白酶消化,重新吹散,接种于培养皿中培养,明场观察并拍照记录。
1.2.2RNA提取和反转录:利用预冷PBS清洗细胞2次,加入1 mL Trizol吹打至不再黏稠,转移至1.5 mL离心管中,室温放置5 min,随后利用酚/氯仿抽提的方法提取RNA,利用30 μL无RNase ddH2O溶解RNA,并利用Nanodrop检测RNA纯度,随后取2 μg RNA进行反转录反应,反转录反应按照Promega试剂盒说明进行操作。
1.2.3实时定量PCR检测基因表达:以反转录产物为模板,利用优化后的引物(表1)在qPCR仪器上进行qPCR检测,反应程序为95 ℃ 1 min; 95 ℃ 5 s, 60 ℃ 15 s, 72 ℃ 20 s; 40个循环,72 ℃ 10 min,每个样品设置3个重复。样品的相对表达量(内参为GAPDH)利用2-△△Ct方法进行计算。
1.2.4细胞的药物处理:将正常培养的P19细胞分别用含不同浓度TSA、NAM、AdOx的α-MEM培养基培养24 h,随后收取细胞,提取RNA,RT-qPCR检测Neat1的表达(引物序列见表1)。
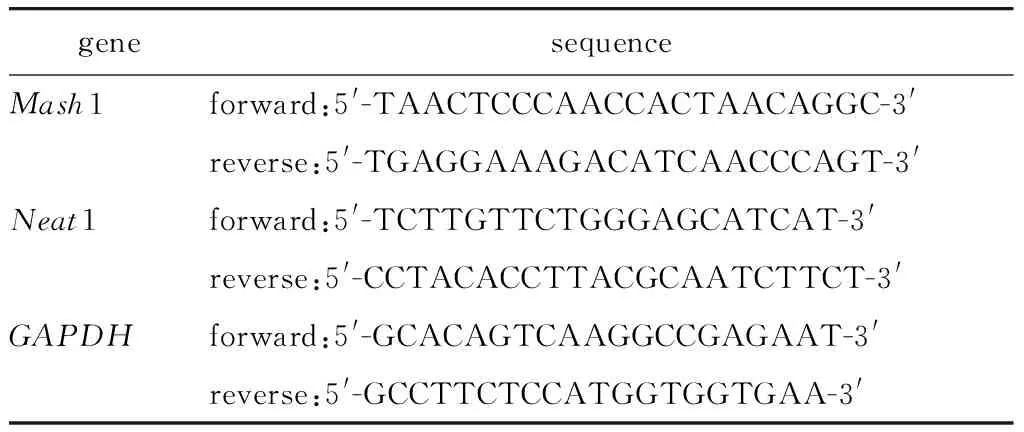
表1 引物序列Table 1 Sequence of primers
1.3 统计学分析
实验数据用GraphPad Prism6.0统计软件进行分析,利用t检验检测数据间差异性。
2 结果
2.1 atRA诱导P19神经分化模型的建立
利用atRA诱导P19细胞,4 d后,细胞形态发生明显变化,细胞明显成团聚集,细胞贴壁性降低,撤掉atRA(atRA-)继续培养4 d形成神经元样细胞(图1A)。神经细胞的分子标志物Mash1的mRNA随诱导时间增加而升高(图1B),表明神经分化模型成功建立。
2.2 atRA诱导的P19细胞分化引起LncRNA Neat1表达显著升高
LncRNA Neat1的表达随着atRA诱导P19细胞时间增加而升高,诱导4 d后,Neat1的表达量比未诱导组显著升高(图2)。
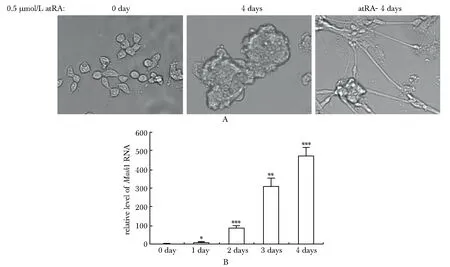
A.morphological changes of P19 cells during differentiation(×400); B.the expression ofMash1 mRNA detected with RT-qPCR assay;*P<0.01,**P<0.001,***P<0.0001 compared with control(0 day)

*P<0.01,**P<0.001 compared with control(0 day)图2 LncRNA Neat1在atRA诱导P19分化中的表达Fig 2 Expression of LncRNA Neat1 in atRA-induced
2.3 去乙酰化酶抑制剂TSA促进Neat1的表达
利用不同的组蛋白修饰酶的抑制剂处理P19细胞,发现TSA处理后P19细胞Neat1的表达随药物浓度的增加显著上调(图3A),而NAM和AdOx处理P19细胞,Neat1的表达并无显著变化(图3B,C)。
3 讨论
目前关于Neat1的研究局限于Neat1在神经兴奋以及癌中的作用,本研究首先发现在atRA诱导P19分化的过程中LncRNA Neat1的表达显著上调。已有研究表明Neat1在神经兴奋传导过程中十分重要。在神经分化的过程中,Neat1的上调是神经发育中必要的过程。其次,本研究利用组蛋白修饰相关表观遗传因子的抑制剂检测组蛋白修饰对Neat1表达的影响,结果显示组蛋白去乙酰化酶抑制剂TSA处理后,Neat1的表达上调,表明Ⅰ类和Ⅱ类组蛋白去乙酰化酶导致的组蛋白去乙酰化状态抑制Neat1表达。然而,NAM作为第Ⅲ类组蛋白去乙酰化酶抑制剂却没有显著影响Neat1的表达,表明第Ⅲ类组蛋白去乙酰化酶活性不参与Neat1的表达调控。同时甲基转移酶的抑制剂AdOx也没有影响Neat1的表达,表明组蛋白甲基化水平对于Neat1的调控没有明显的作用, 本研究首先建立了组蛋白修饰和Neat1表达之间的关系,为Neat1的进一步研究提供依据。
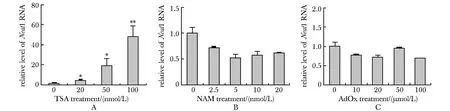
Expression of Neat1 in P19 cells treated with TSA (A), NAM(B) and AdOx(C);*P<0.05,**P<0.01 compared with control
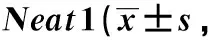
TSA对于Ⅰ类和Ⅱ类组蛋白组去乙酰化酶均有抑制作用,TSA处理细胞后,细胞整体的组蛋白乙酰化水平将上升。但是,Neat1的启动子区域的组蛋白乙酰化状态依然不清晰。研究Neat1在分化过程中启动子区的组蛋白修饰状态将为Neat1的调节机制提供根据。
组蛋白的多样化修饰参与基因表达的精准调控。如组蛋白磷酸化参与激活增殖相关的基因,组蛋白泛素化一般参与基因表达的抑制等,此研究利用组蛋白的乙酰化以及甲基化对Neat1表达的影响,对于其他类型的组蛋白修饰对Neat1表达的影响依然未知,本研究为进一步研究组蛋白修饰的类型对Neat1表达的影响打下基础。
已有研究发现P53可通过促进Neat1的表达从而促进乳腺癌细胞的增殖,并且Neat1的高表达能够导致皮肤癌,Neat1敲除的小鼠能够抵抗化学诱导的皮肤癌。该研究为Neat1的潜在表观调节机制提供依据,可通过筛选能够调节Neat1表达的组蛋白修饰相关的表观遗传因子抑制剂,为癌的治疗提供潜在的靶点。
