IFNα上调人肝癌细胞系胞苷单磷酸激酶2表达激活小鼠巨噬细胞系
2018-07-16成丽琴张祝琴陈厚早
成丽琴,张祝琴,陈厚早
(中国医学科学院基础医学研究所 北京协和医学院基础学院 医学分子生物学国家重点实验室, 北京 100005)
肝细胞癌(以下简称肝癌)是全球最常见的恶性肿瘤,也是中国死亡率最高的癌[1]。目前中国肝癌的治疗首选手术切除,而不能手术的患者则以化疗为主[2]。皮下注射干扰素α(interferon α, IFNα)作为一种简单、方便、价格相对便宜的方法,对提高肝癌患者远期生存率有明显的效果[3-4]。
IFNα 是干扰素家族的I型IFN,因其抗肿瘤效应而被熟知。一方面,它可以直接抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡;另一方面,它可以通过促进抗肿瘤免疫反应发挥作用[5]。用IFN α处理6 h后,肝癌细胞系Huh7的cDNA基因表达谱芯片显示,胞苷单磷酸激酶2(cytidine/uridine monopho-sphate kinase 2, CMPK2)的转录水平显著上调[6]。CMPK2是位于线粒体的参与核苷酸补救途径的酶。据报道,CMPK2在巨噬细胞的激活中发挥重要作用[7]。本研究拟对CMPK2在IFNα治疗肝癌中的抗肿瘤免疫反应作用进行探讨。
1 材料与方法
1.1 材料
1.1.1细胞系:人肝癌细胞系Huh7、人胚胎肾上皮细胞系293T和小鼠巨噬细胞系RAW264.7(本实验室保存)。
1.1.2主要试剂:DMEM培养基(中国医学科学院基础医学研究所细胞资源中心);胎牛血清(Gibco公司); CMPK2质粒和抗体Anti-CMPK2 (Origene公司); Aldrich RNA提取裂解液Trizol(Invitrogen公司); 脂多糖(lipopolysaccharide, LPS)和β-actin抗体(Sigma-Aldrich公司);注射用重组人IFNα(天津未名生物医药有限公司); 反转录试剂盒(TaKaRa公司); 实时定量PCR(RT-qPCR)试剂盒(Vazyme公司); BCA蛋白定量试剂盒(赛默飞公司); 信号传导转录激活因子1(signal transducers and activators of transcription 1, STAT1)的抗体和P-STAT1抗体(Cell Signaling Technology公司); 细胞裂解液RIPA和蛋白上样缓冲液(上海碧云天生物技术有限公司); PVDF膜(Millipore公司);ECL化学发光试剂(上海翊圣生物科技有限公司);CellTiter-Glo 2.0三磷酸腺苷(adenosinetriphosphate, ATP)荧光检测试剂盒(Promega公司)。
1.2 方法
1.2.1细胞培养: 37 ℃、5% CO2及饱和湿度条件下,将Huh7和293T细胞培养于含10%胎牛血清的DMEM完全培养基中,将RAW264.7细胞培养于含10%胎牛血清的1640完全培养基中。
1.2.2构建稳定过表达CMPK2的Huh7细胞: 分别用限制性内切酶EcoRI-HF和NotI-HF对pLV-EF1a-EGFP-N和pCMV6-ENTRY-CMPK2质粒进行双酶切后胶回收,用T4连接酶链接目的片段,构建过表达CMPK2的慢病毒质粒。将CMPK2的慢病毒质粒与 psPAX和pMD2.G质粒共同转染293T细胞,48 h后收集上清液,于4 ℃、4 000×g离心10 min,除去细胞碎片,用0.45 μm过滤器过滤上清液,加入超速离心管中,40 000×g离心4 h,去上清,用1 mL DMEM完全培养基溶解沉淀,得到过表达CMPK2的慢病毒(lenti-CMPK2)。将得到的lenti-CMPK2感染Huh7细胞,48 h后用嘌呤霉素筛选出成功感染了lenti-CMPK2的细胞,得到稳定过表达CMPK2的Huh7细胞。以过表达EGFP的慢病毒作为对照(lenti-GFP)。
1.2.3RNA反转录及RT-qPCR 检测CMPK2、白介素-1β (interleukin 1β, IL1β)、IL18、肿瘤坏死因子-α (tumor necrosis factor α, TNFα)、IL6、C-C模体趋化因子配体5 (C-C motif chemokine ligand 5, CCL5)和诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS) 的转录水平:用Trizol提取细胞总RNA,测定浓度及纯度后,用反转录试剂盒将RNA反转成cDNA,再用RT-qPCR试剂盒检测各基因的转录水平,以β-actin为内参,用2-△△CT法分析各基因的相对表达量。所使用引物见表1和表2。
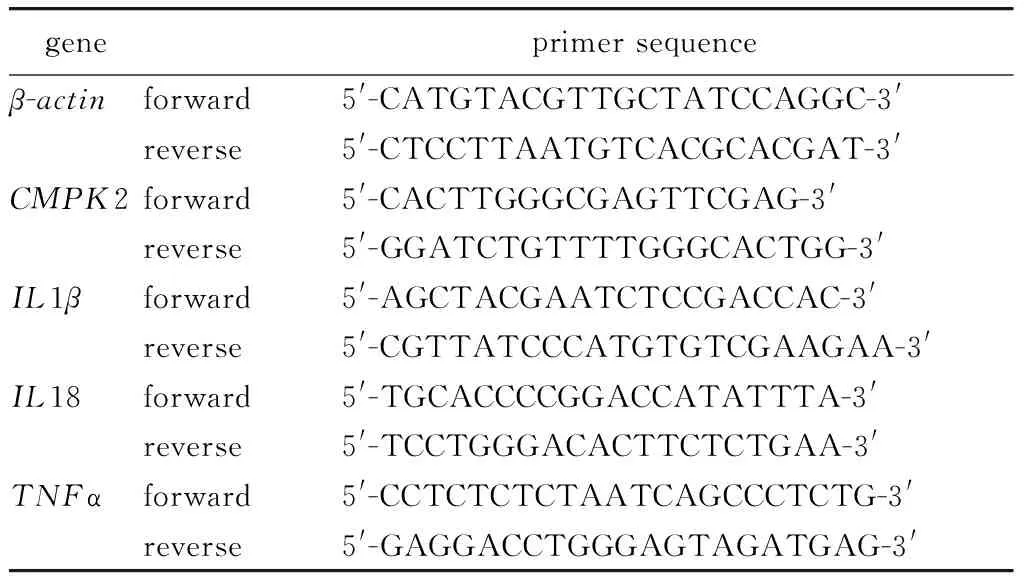
表1 Huh7细胞系RT-qPCR 引物序列

表2 RAW264.7细胞系RT-qPCR 引物序列
1.2.4Western blot检测CMPK2、P-STAT1和STAT1的蛋白水平:收集细胞,用蛋白裂解液(RIPA)裂解细胞,超声匀浆后离心提取总蛋白,BCA法测定蛋白浓度。取等量蛋白样品进行SDS-PAGE,转膜并封闭,分别用抗目的蛋白抗体(一抗)(1∶1 000)4 ℃孵育过夜。次日室温加相应的二抗(1∶5 000)孵育,洗膜后进行曝光、显影和定影。以β-actin为内参进行分析。
1.2.5CellTiter-Glo ATP荧光检测:将细胞计数后等量接种于24孔板中,用含10%胎牛血清的DMEM完全培养基培养6 h后,分离培养基与细胞,取50 μL培养基或PBS重悬的细胞于96孔板中,加入等体积的CellTiter-Glo试剂,震荡混匀5 min,室温孵育10 min,通过多功能酶标仪读出荧光信号。
1.3 统计学分析
2 结果
2.1 IFNα诱导Huh7细胞CMPK2高表达
IFNα处理Huh7细胞6 h后CMPK2的转录水平显著增加(95.44±4.26),而LPS处理组Huh7细胞 CMPK2水平与对照组无明显差别(图1A)。IFNα处理后,其他免疫细胞激活时高表达的细胞因子IL1β、IL18和TNFα中,仅有IL1β的转录水平有上调(1.54±0.11),但增加的水平远低于CMPK2(图1B~D)。
2.2 IFNα诱导Huh7细胞CMPK2表达的时间和浓度效应
浓度为1×105U/L的IFNα即可使Huh7细胞中CMPK2的转录水平显著上调(66.46±1.72),当IFNα浓度为(1~5)×106U/L时上调最为明显(图2A)。IFNα处理Huh7细胞1 h即可检测到CMPK2 转录水平的上调(6.16±0.60),6 hCMPK2转录水平到达高峰(102.10±1.03),12 h仍维持在较高水平(90.84±1.44),24 h出现明显的回落(21.34±1.23),并不断下降,但到96 hCMPK2的转录水平仍高于无IFNα处理的对照组(图2B)。1×106U/L IFNα 处理Huh7细胞6 h后,CMPK2的蛋白水平和STAT1的磷酸化水平也显著上调(图2C)。
2.3 通过感染慢病毒构建稳定过表达CMPK2的Huh7细胞
在感染稳定表达CMPK2慢病毒的Huh7细胞中,CMPK2的转录水平(20.76±0.94)和蛋白水平均显著高于过表达GFP的对照组(图3A, B)。

A.RT-qPCR detection of CMPK2 expression in Huh7 cells under the treatment of IFNα (1×106U/L), LPS(1mg/L) respectively; B,C,D.RT-qPCR detection of the expression of IL1β(B), IL18(C) and TNFα(D) in Huh7 cells after treatment with IFNα(1×106U/L)for 6 hours;*P<0.05,**P<0.0001 compared with the control group
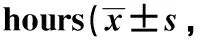
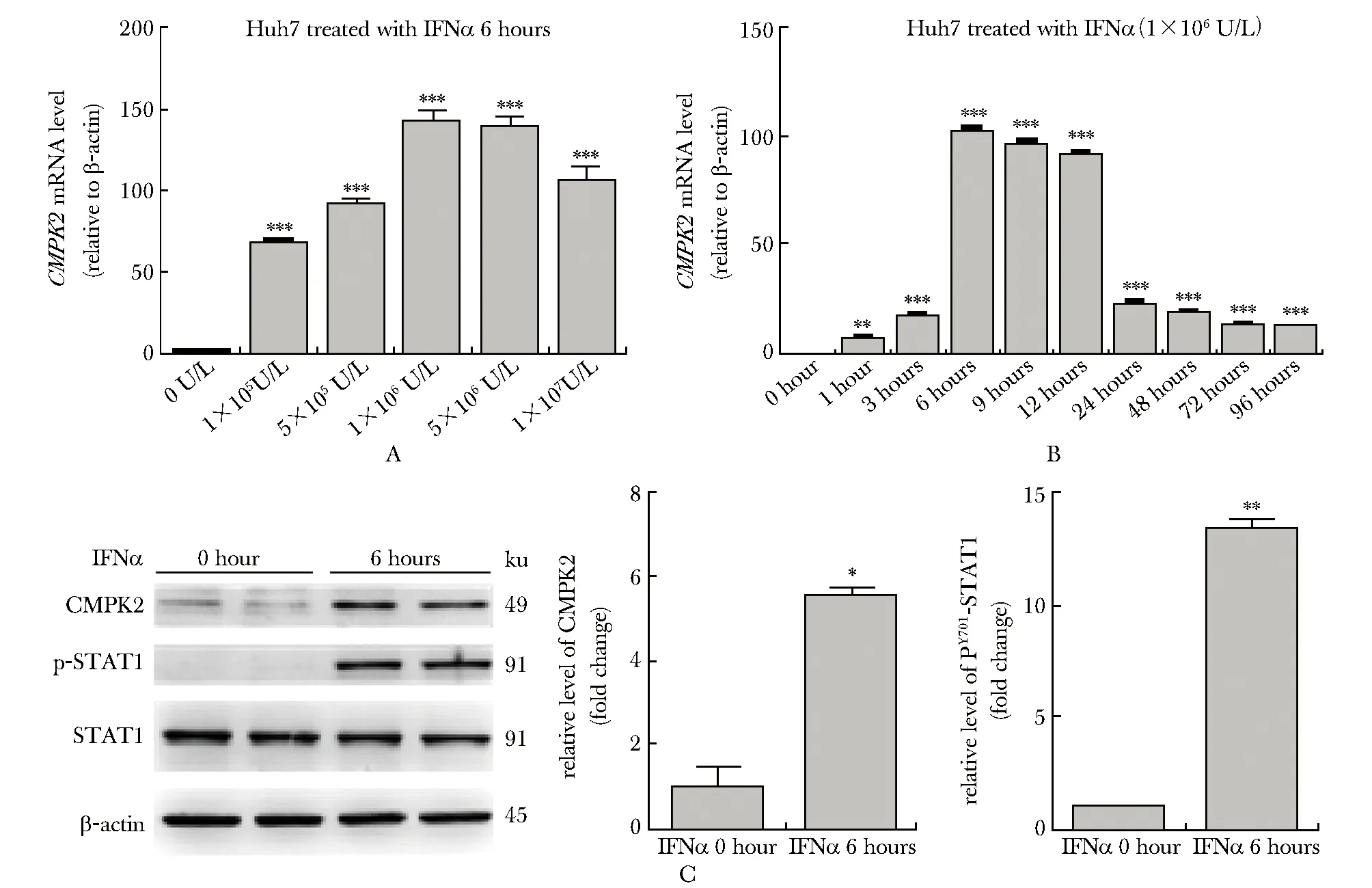
A.RT-qPCR detection ofCMPK2 expression in Huh7 cells 6 hours after the treatment of IFNα with the indicated concentration (n=3); B.RT-qPCR detection ofCMPK2 expression in Huh7 cells after the treatment of IFNα(1×106U/L) for the indicated time (n=3); C.Western blot analysis of CMPK2, PY701-STAT1 and STAT1 in Huh7 cells with and without the stimulation of IFNα(1×106U/L) for 6 hours(n=4);*P<0.01,**P<0.001,***P<0.0001 compared with the control group
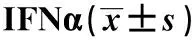
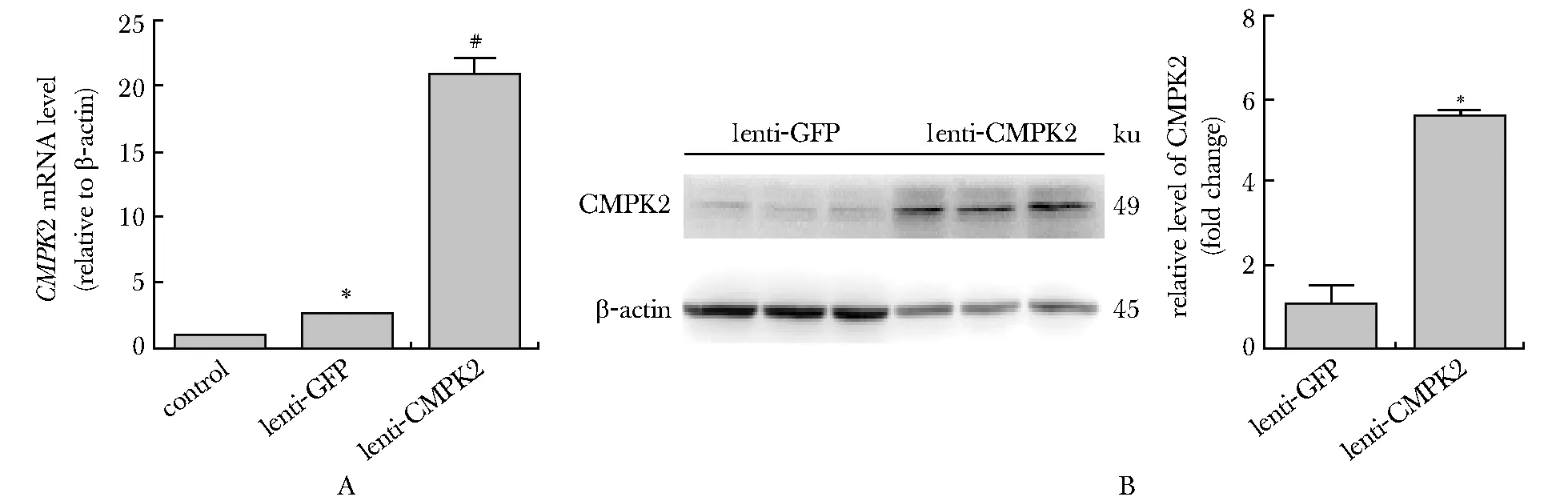
A.RT-qPCR detection ofCMPK2 expression in Huh7 cells, lenti-GFP treated Huh7 cells and lenti-CMPK2 treated Huh7 cells; B.Western blot analysis of CMPK2 in lenti-GFP treated Huh7 cells and lenti-CMPK2 treated Huh7 cells;*P<0.01 compared with the control group;#P<0.01 compared with lenti-GFP treated Huh7 cells
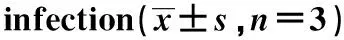
2.4 CMPK2上调Huh7细胞及其上清中ATP水平
IFNα处理6 h后,Huh7细胞及其上清中ATP水平显著上调(图4A~B)。稳定过表达CMPK2的Huh7细胞及其上清中的ATP水平也显著高于对照组(图4C~D)。
2.5 CMPK2上调巨噬细胞中炎性因子的表达
稳定过表达CMPK2的Huh7细胞的上清处理巨噬细胞6 h后,巨噬细胞中IL1β(1.70±0.08)、IL6(4.32±0.15)和CCL5(1.42±0.07)的转录水平明显高于对照组(图5A~D)。
3 讨论
巨噬细胞在LPS和IFNα等刺激下激活向M1型巨噬细胞极化过程中,CMPK2和炎性因子的表达水平显著上调[7-8]。本研究发现,IFNα处理后肝癌细胞系Huh7中CMPK2的转录水平和蛋白水平显著上调,巨噬细胞激活过程中高表达的炎性因子在Huh7细胞中增加的水平远低于CMPK2,而LPS处理后Huh7细胞中 CMPK2水平无明显改变。
STAT1Y701的磷酸化在干扰素刺激基因的表达中发挥重要作用,STAT1Y701的磷酸化水平在IFNα处理0.5 h后显著上调,到24 h下降至较低水平[9]。本研究中IFNα处理6 h后Huh7细胞中STAT1Y701的磷酸化水平显著上调,IFNα处理Huh7细胞1 h即可检测到CMPK2 转录水平的上调,6 h CMPK2的转录水平到达高峰,到24 h CMPK2 的转录水平出现明显的回落,提示 STAT1Y701的磷酸化可能促进CMPK2的转录激活。
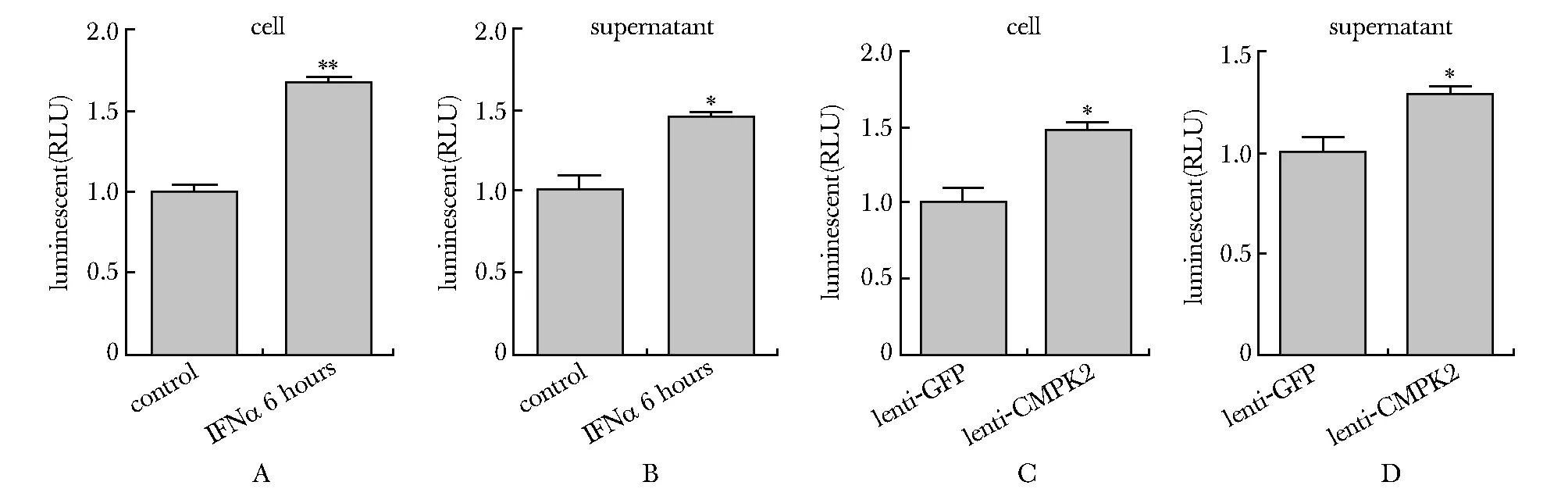
CellTiter-Glo 2.0 Assay detects the ATP level in the cells(A) and supernatant(B) of Huh7 cells with or without the treatment of IFNα (1×106U/L) for 6 hours, and the cells(C) and supernatant(D) of CMPK2 overexpressing Huh7 cells; the ATP level is displayed by rLuciferase(RLU) luminescent signal;*P<0.01,**P<0.0001 compared with the control group
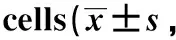
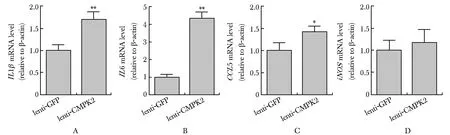
RT-qPCR detection ofIL1β(A),IL6(B),CCL5(C) andiNOS(D) in RAW264.7 cells 6 hours after the treatment of the supernatant of CMPK2 overexpressing Huh7 cells;*P<0.01,**P<0.0001 compared with the control group
图5过表达CMPK2的Huh7细胞上清激活巨噬细胞中炎性因子的表达
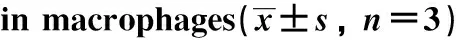
CMPK2催化单磷酸核苷变成相应二磷酸核苷,可进而促进三磷酸核苷的合成[7]。现有报道,ATP等三磷酸核苷可以作用于巨噬细胞表面的嘌呤受体(purinergic receptor),进而激活巨噬细胞,诱导IL1β等细胞因子的表达[10]。本研究发现CMPK2显著上调Huh7细胞及其上清中ATP的水平,稳定过表达CMPK2的Huh7细胞上清处理巨噬细胞6 h后,巨噬细胞中IL1β、IL6和CCL5的转录水平明显高于对照组。提示IFNα上调肝细胞中的CMPK2,增加ATP的水平,通过肝脏中枯否细胞的旁分泌,促进抗肿瘤免疫反应。其具体机制还需进一步的实验来进行验证。本研究为进一步阐明IFNα治疗肝癌中的抗肿瘤免疫作用提供了基础,对提高干扰素治疗效率,实现个体化治疗具有重要意义。
