二甲双胍对肥胖症患者胰岛素敏感性和胰岛β细胞分泌的影响
2018-07-16朱惠娟王林杰阳洪波赵宇星
张 昱,朱惠娟,王林杰,阳洪波,陈 适,赵宇星,潘 慧
(中国医学科学院 北京协和医学院 北京协和医院 内分泌科 卫计委内分泌重点实验室 协和转化医学中心,北京 100730)
二甲双胍(metformin)作为广泛应用临床的胰岛素增敏剂,能够通过改善外周组织胰岛素敏感性显著降低血糖,主要是针对胰岛素靶向组织,如肝脏、肌肉和脂肪组织。目前明确的作用机制是通过AMPK途径抑制肝脏糖异生作用,抑制线粒体复合物,并增加AMP/ATP的比率,降低细胞内ATP含量[1];抑制脂肪组织脂解作用,减少循环游离脂肪酸水平,减少形成晚期糖基化终产物的速度,改善胰岛素敏感性。在过去的几十年中, 美国糖尿病协会(ADA)欧洲糖尿病研究协会和美国临床内分泌学家协会(AACE)指南和中华医学会糖尿病学分会(CDS)指南广泛推荐二甲双胍作为胰岛素增敏剂,是治疗2型糖尿病的一线药物[2]。
本研究在临床中发现肥胖症合并胰岛素抵抗患者口服二甲双胍治疗后,空腹胰岛素水平在治疗早期反而升高,而并非如一贯之推测会随胰岛素敏感性的改善单纯呈现下降趋势。二甲双胍可以通过直接和间接途径促进β细胞分泌胰岛素,其对于胰岛β细胞的作用及其机制尚未完全阐明,目前国内尚无相关临床研究,为此,本研究进行肥胖症合并胰岛素抵抗患者二甲双胍治疗后胰岛素敏感性和胰岛β细胞分泌功能变化的临床研究。
1 材料与方法
1.1 研究对象
选取北京协和医院内分泌科肥胖门诊2012年9月至2016年5月诊断肥胖症合并胰岛素抵抗且严格随诊的患者共42例,年龄为(23.6±6.5)岁,其中男性11例,女性31例。根据OGTT分为正常糖耐量(NGT组)19例和糖调节受损(IGR组)23例,后者包括空腹血糖调节受损(IFG)15例和糖耐量低减(IGT)8例。经中国医学科学院北京协和医院伦理委员会审查批准,本项目研究对象均知情同意。
本研究中的疾病诊断标准以及排除标准如下:1)肥胖症诊断标准:根据2011年中国成人肥胖症防治专家共识[3]肥胖症诊断标准:BMI≥28.0 kg/m2,男性腰围>90 cm,女性腰围>80 cm。2) 胰岛素抵抗诊断标准:根据HOMA-IR≥3.0[4]为诊断胰岛素抵抗的标准;3) 糖尿病前期诊断标准:按照美国ADA糖尿病前期诊断标准[5]。4) 排除标准:排除糖尿病以及严重肝肾功能不全、甲状腺功能异常者。
1.2 方法
1.2.1治疗方法:42例患者均采用生活方式干预并盐酸二甲双胍(商品名:格华止,每片含盐酸二甲双胍500 mg,上海施贵宝公司生产)每次1片,4次/d,口服治疗。
1.2.2观察指标和方法:分别于治疗前、治疗3个月、6个月检查体质量、腰围(WS),计算体质指数(BMI)=体质量(kg)/身高2(m2),氧化酶法测定空腹血糖(fasting plasma glucose, FPG),化学发光法(ADVIA Centaur胰岛素测定试剂盒)测定空腹胰岛素(fasting insulin, FINS),美国贝克曼库尔特全自动生化分析仪AU5821测定血脂谱和肝肾功能、稳态模型(homeostasis model assessment, HOMA)公式计算胰岛素抵抗指数(HOMA-IR)=空腹血糖 (FPG)×空腹胰岛素(FINS)/22.5; 胰岛素分泌指数(HOMA-β)=20×FINS(μIU/mL)/[FPG(mmol/L)-3.53]。
1.3 统计学分析
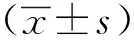
2 结果
2.1 治疗前后临床和化验资料分析
42例患者的体质量、空腹血糖(FPG)、 总胆固醇(total cholesterol, TC)、尿酸(uric acid, UA)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)分别在治疗前、治疗3个月、治疗6个月逐渐减低,治疗6个月达最低值,高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)逐渐增高,治疗6个月达最高值(P<0.05)(表1)。空腹胰岛素(FINS)在治疗3个月最高,治疗6个月达最低值(P<0.05)(表2)。

表1 患者治疗前的一般资料Table 1 General characteristics of overall patients at baseline (before treatment) M(QR)]

表2 患者治疗前、治疗3个月和治疗6个月之后临床和生化检测资料以及胰岛素敏感性和胰岛素分泌的变化
*P<0.05 compared with before treatment;△P<0.05 compared with 3 months after treatment; BMI.body mass index; Cr.creatinine; FBG.fasting plasma glucose; FINS.fasting insulin; TG.triglyceride; TC.total cholesterol; HDL-C.high density lipoprotein cholesterol; LDL-C.low density lipoprotein cholesterol; UA.uric acid; ALT.alanine aminotransferase; AST.aspartate aminotransferase; GGT.gamma glutamyl transaminopeptidase.
2.2 治疗前后胰岛素敏感性以及β细胞分泌功能的比较
2.2.1FINS变化:42例患者,治疗3个月FINS较治疗前升高(P<0.05),治疗6个月FINS较治疗前降低(P<0.05)(表2)。NGT组,治疗3个月FINS较治疗前升高(P<0.05), 两组中治疗6个月FINS较治疗前和治疗3个月均降低(P<0.05)(表3)。
2.2.2HOMA-IR变化:42例患者,HOMA-IR均在治疗6个月降至最低(P<0.001)(表2)。两组中HOMA-IR均在治疗6个月降至最低(P<0.05)(表3)。
2.2.3HOMA-β变化:42例患者,HOMA-β治疗3个月较治疗前差异无统计学意义,治疗6个月较治疗3个月降低(P<0.001)(表2)。NGT组和IGR组HOMA-β治疗3个月较治疗前差异均无统计意意义,治疗6个月均较治疗3个月降低(P<0.05)(表3)。
2.2.4IGR组与NGT组比较:IGR组治疗前HOMA-β低于NGT组治疗前HOMA-β(P<0.05)(表3)。
3 讨论
42例肥胖症患者口服盐酸二甲双胍治疗6个月FINS水平和HOMA-IR降至最低,提示胰岛素敏感性得到改善;治疗3个月FINS和HOMA-β均较治疗前升高,提示二甲双胍促进β细胞胰岛素分泌的作用较改善外周组织胰岛素敏感性的作用更早出现。二甲双胍通过直接和间接途径促进β细胞分泌胰岛素。2005年糖尿病预防计划(DPP)在糖尿病前期人群研究中,二甲双胍干预1年后胰岛素分泌量在绝对值上呈下降趋势,但是其下降幅度较预期胰岛素敏感性改善导致的胰岛素分泌量下降要小,研究者认为二甲双胍发挥了促进β细胞胰岛素分泌的作用[6]。在葡萄糖的参与下,二甲双胍培养鼠胰岛细胞48 h,胰岛素分泌率高于培养24 h组,治疗组较对照组的胰岛素基因表达增加[7]。二甲双胍通过减少氧化应激[8],恢复暴露于高脂或高糖的人体胰岛分泌功能;通过对AMPK-PI3激酶-JNK信号通路的调控,抑制内质网应激诱导的NIT- 1细胞凋亡[9];高糖条件下,人胰岛细胞胰岛素分泌减少与ATP水平降低有关,二甲双胍抑制线粒体复合物I的活性[10],使之逆转;而且增加血浆GLP- 1水平加强肠促胰岛素作用[11]。
与NGT组不同,IGR组治疗3个月FINS与治疗前相比无显著差异,2组治疗前HOMA-β比较,IGR组明显低于NGT组,提示在治疗前IGR组β细胞分泌功能较NGT组差。
综上所述,二甲双胍治疗肥胖症合并胰岛素抵抗患者,其促进β细胞胰岛素分泌的作用较改善外周组织胰岛素敏感性的作用更早出现;二甲双胍治疗3个月内,与糖调节受损患者相比,在糖耐量正常的肥胖症患者中其促进β细胞分泌胰岛素的作用更明显。本研究存在的局限性:1)研究对象为肥胖症合并胰岛素抵抗患者,因此结论可能不适用糖尿病患者;2)病例数少,纳入的临床和通过化检测指标有限,需要更完善的前瞻性研究加以验证。

表3 不同糖耐量患者在治疗前、治疗3个月和治疗6个月胰岛素敏感性以及胰岛素分泌的变化
*P<0.05 compared with before treatment;△P<0.05 compared with 3 months after treatment;#P<0.05 HOMA-β at baseline (before treatment) compared with group-NGT.
