新型在线净化前处理HPLC-MS/MS测定香精香料中的麦角甾醇和麦角甾酮
2018-06-26倪朝敏陈建华米其利孔维松王晓辉杨光宇李雪梅杨叶昆
李 晶,倪朝敏,陈建华,米其利,孔维松,王晓辉,杨光宇,李雪梅,杨叶昆*
(云南中烟工业有限责任公司技术中心,云南 昆明 650106)
香精香料是重要的添加剂,与食品安全休戚相关,因此对香精香料进行霉变监控与预防具有重要的现实意义[1-3]。麦角甾醇和麦角甾酮是真菌细胞膜中的主要甾体类化合物,主要存在于绝大多数的真菌细胞膜中[4],维系着真菌细胞的正常代谢[5-8],据报道麦角甾醇的量与真菌的生物量存在着相关关系(麦角甾醇可作为评价粮食质量安全的敏感指标之一);因其在大部分植物中不含有或含量很小,其良好的特异性和稳定性使其可作为霉菌污染的标记物[9],作为质量安全指标在世界范围内得到了广泛的研究与应用[10-13]。
目前,对麦角甾酮与麦角甾醇的定性与定量分析研究已经很多,主要报道的方法有毛细管电泳法[14]、高效液相色谱法[15-20]、液相色谱-质谱法[21-22]和气相色谱-质谱法[23-27]等。由于香精香料基质复杂,有些样品具有高水分高糖分的特点,单纯利用液相色谱紫外检测存在着定性困难的问题,而利用气相色谱方法存在着前处理复杂的问题,高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)在定性和定量方面都具有其优点,目前香精香料中麦角甾酮和麦角甾醇同时测定的方法还鲜见报道。
基质固相分散前处理是近年来一种新的固相提取技术[28],可以将提取净化集于一体,已经被广泛应用于基质复杂样品的前处理,可以有效避免HPLC-MS/MS由于基体效应造成的信号影响[29]。本研究基于基质固相分散处理的原理,设计开发出一种新型的在线净化前处理装置,用于基质复杂的香精香料的前处理净化,方法操作简单,净化萃取浓缩为一体,经过提取净化后的样品利用HPLC-MS/MS进行测定,可以应用于香精香料中麦角甾醇和麦角甾酮的监控分析。
1 材料与方法
1.1 材料与试剂
麦角甾醇、麦角甾酮(纯度≥99%) 加拿大Chromadex公司;胆甾烷醇酮-6-酮(纯度>99.0%) 百灵威科技有限公司;甲醇、乙腈、二氯甲烷(均为色谱纯)美国Merk公司;球形硅胶(40~60 µm) 德国默克公司;硫酸钠(分析纯) 西陇化工有限公司;硫酸钠于200 ℃烘烤6 h后,冷却放入磨口塞玻璃瓶内,置于干燥器内备用;所有实验用水均为去离子水(18.2 MΩ·cm),由Milli-Q超纯水纯化系统制得。
香精香料样品为某香精香料生产企业提供,模拟霉变样品为实验室自制样品,采用增加水分后在空气相对湿度80%,温度37 ℃条件下高温高湿培养加速霉变,直至得到感官明显能感觉到霉变的样品。
1.2 仪器与设备
ACQUITY超高效液相色谱仪 美国Waters公司;API4000QTRAP质谱仪 美国应用生物系统公司;Milli-Q50超纯水仪 美国Millipore公司;BT224S电子天平(感量0.1 mg) 德国Sartorius公司;SK5200型超声波振荡器 上海科导超声仪器有限公司;0.45 μm有机针式过滤器 上海安谱科学仪器有限公司。
1.3 方法
1.3.1 溶液配制
标准溶液:分别准确称取5.0 mg(精确至0.1 mg)的麦角甾醇和麦角甾酮于10 mL容量瓶中,用甲醇溶解并定容至刻度,配制成质量浓度均为0.5 mg/mL的标准储备液,使用时用甲醇稀释成所需质量浓度的标准工作液。
内标溶液:称取5.0 mg的胆甾烷醇酮-6-酮至10 mL棕色容量瓶中,用甲醇溶解并定容至刻度,配制成质量浓度为0.5 mg/mL的内标储备液;使用时稀释成50 µg/mL的内标工作液。
1.3.2 HPLC-MS/MS条件
色谱条件:色谱柱:ACQUITY UPLCTMBEH C18(2.1 mm×100 mm,1.7 μm);流速0.4 mL/min;柱温40 ℃;进样量5 μL;流动相:A为水,B为HPLC级甲醇;流动相梯度洗脱程序:0.0~6.0 min,95% B递增至100% B;6.0~7.5 min保持100% B;8.0 min还原为初始状态95% B。
质谱条件:电离方式:大气压化学电离源;正离子模式扫描;多反应监测模式;电喷雾电压5 500 V;离子源温度650 ℃;离子对的驻留监测时间100 ms;辅助气Gas1压力60 psi;辅助气Gas2压力70 psi;各分析物的质谱检测参数见表1。
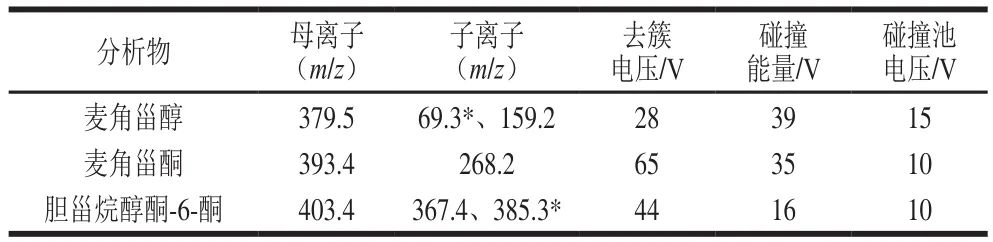
表1 化合物质谱检测参数Table1 MS parameters of the analytes
1.3.3 样品前处理
本研究设计了一个基于固相分散萃取和硅胶柱层析的新型在线净化装置,如图1所示。装置以索式提取装置为基础,进行了提取净化固相试剂的装填,以及方便进行溶剂回收的三通阀和用于定量浓缩的有刻度的尾管设计。
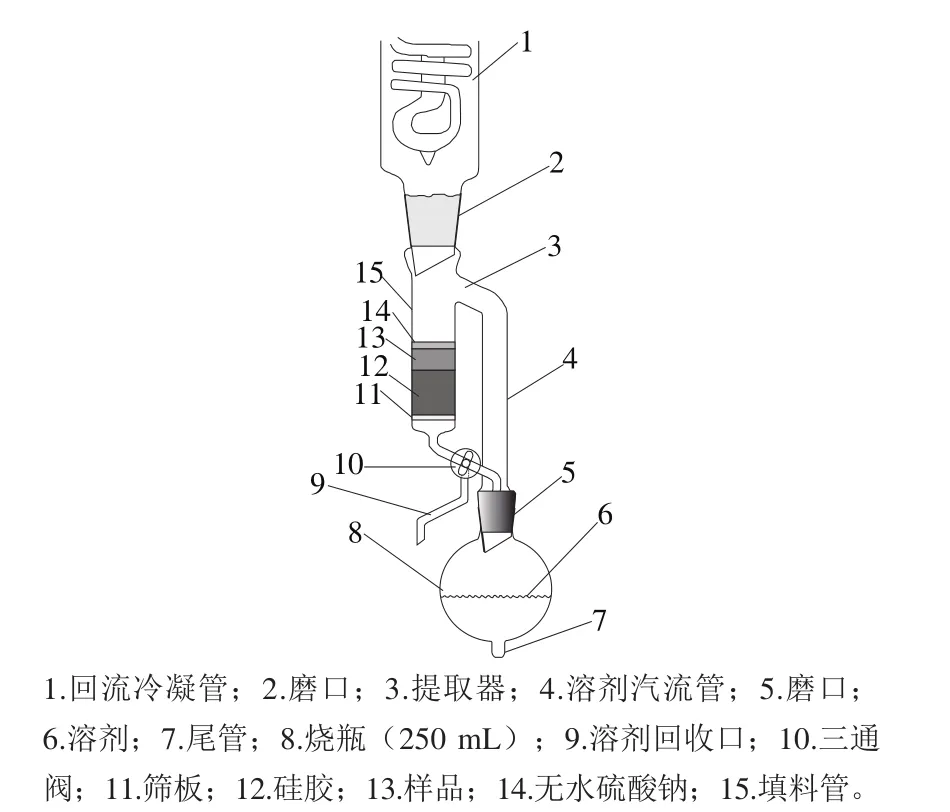
图1 样品前处理装置的结构图Fig.1 Schematic of the sample preparation apparatus
处理步骤如下:1)准确称取香精或料液样品1.0 g,加入质量浓度为50 µg/mL的内标工作液200 µL,然后加入2.0 g的硅胶和样品充分研磨均匀;2)在样品前处理装置中的填料管中加入一个筛板以防止硅胶滑落,先加入10 g硅胶,微微振动,使硅胶在筛板上形成一层,然后将样品硅胶加入填料管,稍微振动,使之填充严实,形成样品硅胶层;之后再在样品硅胶层铺2.5 g无水硫酸钠,同样振动,使之装填严实平整。3)将装填好的填料管连接上索式提取器,在烧瓶中加入60 mL二氯甲烷,三通阀调整为填料管连接烧瓶状态,水浴60 ℃条件下加热回流提取样品45 min。4)样品提取完后,三通阀调整为提取管与溶剂回收口相通状态,使溶剂从回收口流出,回收溶剂并浓缩样品直至烧瓶尾管中的样品溶液浓缩尽干;5)向尾管中加入1 mL乙腈溶解残余物,溶液用0.45 µm滤膜过滤后,按选定仪器条件测定麦角甾醇和麦角甾酮含量。
2 结果与分析
2.1 样品前处理条件
2.1.1 样品前处理装置
对于麦角甾醇和麦角甾酮的测定,样品前处理一般分为样品提取、固相萃取(或柱层析)净化、浓缩三步;采用的方法多为样品用溶剂提取,然后用硅胶固相萃取柱(或反相固相萃取)净化,再供仪器分析用。为简化操作,本研究设计了一个带柱层析功能的索氏提取装置(图1),装置由普通索式提取装置改装而来(球形烧瓶500 mL,抽出筒直径40 mm,抽出筒长190 mm),对抽出筒下端进行改装,加入了1 个三通阀进行溶剂的冷凝或者回收。样品利用硅胶进行基质分散,装填好筛板、硅胶层、样品硅胶层和无水硫酸钠层,将三通阀调整到提取管与圆底烧瓶相通的状态,启动水浴锅加热,溶剂蒸发后再经冷凝管回流冷凝到填料管中;溶剂把样品中的麦角甾醇和麦角甾酮洗脱下来,通过硅胶层进行净化,部分极性杂质被净化;回流后的样品溶液经无水硫酸钠层干燥,以便于溶剂回流和冷凝,经过一段时间的回流提取,样品中的麦角甾醇和麦角甾酮被完全提取并转移到圆底烧瓶内;然后转换三通阀,让溶剂从溶剂回收出口流出,这样圆底烧瓶中的溶液不断被浓缩,当溶剂浓缩到干后,换成反相色谱分析常用溶剂乙腈进行残余样品的溶解,即可供液相色谱分析用。
2.1.2 前处理溶剂选择
本研究中样品前处理的关键步骤是硅胶固相萃取净化,溶剂的选择非常重要,溶剂对硅胶柱的洗脱强度适当才能让麦角甾醇和麦角甾酮从硅胶柱上洗脱,并让杂质更多地保留在柱上,从而达到样品净化的目的。硅胶为极性固定相,选择适当的溶剂洗脱可让麦角甾醇和麦角甾酮与样品中的共存组分分离而达到样品净化。由于麦角甾醇和麦角甾酮均为小极性化合物,用溶剂强度相对弱的溶剂洗脱可把待测成分完全洗脱下来,而香精香料中的糖类、有机酸、酯类、醇类、醛、酮等中大极性的干扰成分大部分保留在硅胶柱,这样可达到样品净化的效果。通过实验石油醚、环己烷、正己烷、二氯甲烷、三氯甲烷对样品的净化效果,结果表明石油醚、环己烷、正己烷溶剂洗脱强度较弱,麦角甾醇和麦角甾酮不能被完全洗脱,回收率低于50%;二氯甲烷和三氯甲烷具有较强的洗脱能力,麦角甾醇和麦角甾酮回收率均在90%以上;实验发现,如果换成极性更大的乙酸乙酯或丙酮作为洗脱溶剂,麦角甾醇和麦角甾酮也能被完全洗脱,但由于洗脱下来的杂质成分也相应增加,样品浓缩时容易出现沉淀或变浑浊,影响样品的净化效果。考虑到二氯甲烷毒性比三氯甲烷低,而且沸点低,容易实现回流,因此,本实验中选择二氯甲烷作为前处理中的溶剂。
2.1.3 前处理溶剂体积优化
在提取实验中,需在提取装置中加入足够量的溶剂,以保持溶剂在前处理过程中能回流循环;本实验中采用体积为50 mL的提取管,实验表明,当提取装置中的溶剂量达40 mL时能保持正常回流循环,溶剂加入量在50~80 mL之间待测组分的回收率均稳定,均在90%以上,继续增加溶剂量对待测组分的回收率没有影响,但会导致样品前处理的溶剂消耗增加。考虑到在样品前处理过程中溶剂因蒸发而有少量损失,因此选择在提取器中加入60 mL的二氯甲烷溶剂。
2.1.4 前处理温度优化
本实验进行不同前处理温度回收率的优化实验发现,二氯甲烷沸点仅为39.8 ℃,当水浴温度超过45 ℃时,尾管烧瓶中的溶剂开始沸腾,随温度升高,溶剂蒸发速度迅速加快,当温度达到55~65 ℃时溶剂蒸发速率能达到5 mL/min左右(稍大于提取管内柱层析上的流下速度)。如果温度低于55 ℃,溶剂蒸发慢,需延长样品处理时间。由于洗脱流速受硅胶柱的控制,进一步升高温度虽然会增加溶剂的蒸发速率,但过量的溶剂会从导气管分流出,不能加快洗脱速率;而且温度过高会增加提取过程中的溶剂损失,增加样品前处理过程中的溶剂消耗并污染实验室环境;因此,实验优化选择水浴温度为60 ℃。
2.1.5 前处理提取时间优化
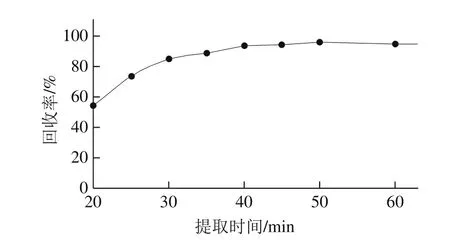
图2 提取时间对回收率的影响Fig.2 Effect of extraction time on the recovery
选取经硅胶基质分散的样品,在60 ℃的水浴中进行回流提取,考察提取时间对麦角甾醇和麦角甾酮测定结果的影响。比较了提取时间分别为20、25、30、35、40、45、50、60 min的测定结果,如图2所示。结果表明:提取时间在40 min以后麦角甾醇和麦角甾酮萃取效率达到一个稳定值,测定结果趋于稳定,进一步延长提取时间则会导致更多的杂质洗脱下来而影响样品的净化效果;为节约时间并避免引入更多的干扰成分,本实验选择45 min作为样品提取的最佳时间。
2.2 HPLC-MS/MS分析条件优化
通过查阅文献,胆甾烷醇酮-6-酮可用作HPLC-MS/MS测定甾醇的内标物[30],由于它们的化学性质基本相同,可以最大限度地减少因为样品损失造成的分析误差,提高结果的准确性;而且胆甾烷醇酮-6-酮不是香精香料中的固有成分,其保留时间和待测组分不重叠,故本实验中选择胆甾烷醇酮-6-酮作为内标物质。
在固定其他条件不变,本研究中优化选用大气压化学电离源为离子源,[M+H]+是信号比较强的离子碎片,其子离子扫描图见图3。因此本实验选择正离子扫描模式。
由于在大气压化学电离模式下,乙酸铵、乙酸等电喷雾要求较低的挥发性缓冲盐会抑制麦角甾醇等甾体类化合物的有效电离,使其响应信号降低,故优选甲醇-水体系作为流动相,选择5 µL进样量,色谱柱温度为40 ℃。
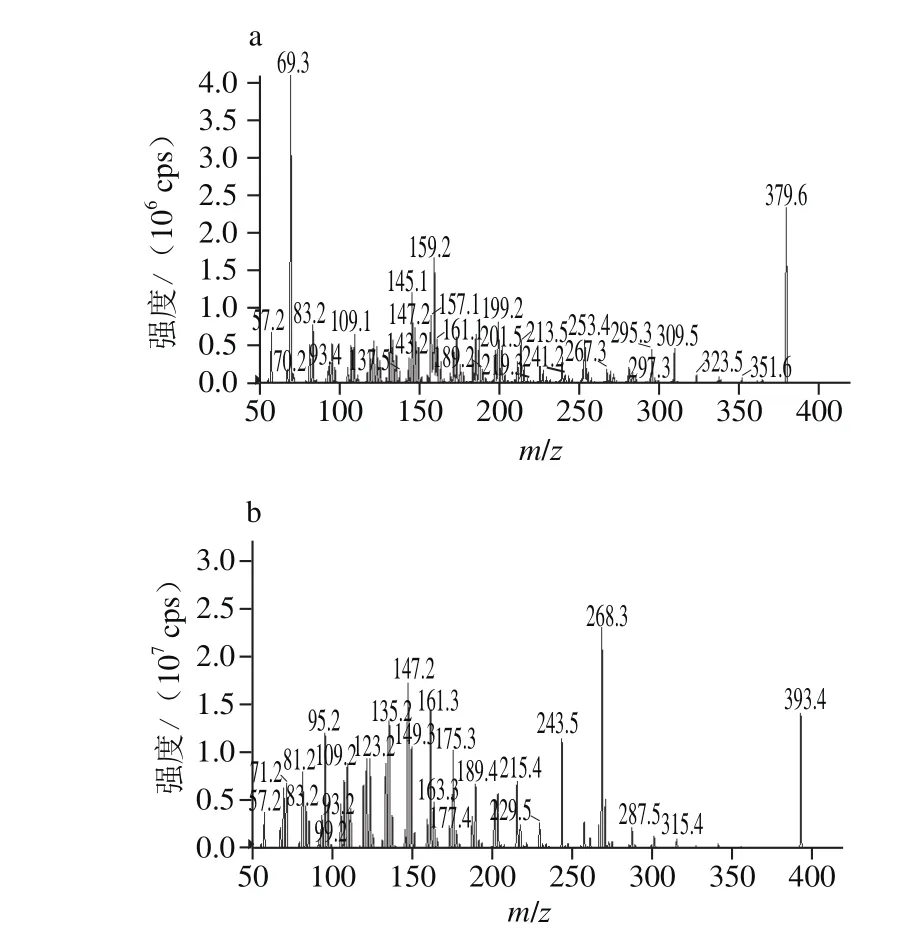
图3 麦角甾醇(a)和麦角甾酮的二级质谱图(b)Fig.3 Tandem mass spectra of the analytes
2.3 方法评价
2.3.1 方法线性关系、检出限和定量限结果
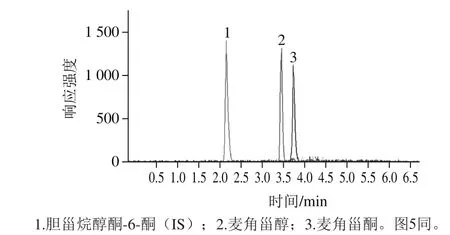
图4 标准溶液色谱图Fig.4 MRM chromatograms of standards
以甲醇作为溶剂,配制一系列标准溶液,采用实验优化的方法进行分析检测,待测物质能在5 min内进行有效分离,标准样品色谱图如图4所示。采用内标法得到的麦角甾醇和麦角甾酮的线性关系,检出限和定量限见表2。其中检出限和定量限分别取最低质量浓度标准溶液连续10 次进样,计算测定结果的标准偏差,由3 倍和10 倍的标准偏差得到。

表2 麦角甾醇、麦角甾酮的线性关系、检出限和定量限Table2 Linear regression equations, correlation coeff i cients, limits of detection and quantif i cation for the analytes
以目标物质的色谱峰面积Y对其质量浓度X(μg/mL)进行线性回归。从表2可以看出,目标检测物质在1.5~250 μg/mL范围内线性关系良好,相关系数大于0.999,麦角甾醇定量限为0.98 μg/mL,麦角甾酮定量限为1.16 μg/mL。
2.3.2 重复性考察结果
为考察方法的精密度,对5 种不同类型的模拟霉变香精香料进行7 次日内重复测定,结果表明,麦角甾醇的相对标准偏差在2.8%~3.2%之间,麦角甾酮的相对标准偏差在2.9%~3.4%之间,日内测定结果方法的日内精密度较好。采用所建立的检测方法对5 种类型样品进行了7 d的重复实验,结果表明,麦角甾醇的相对标准偏差在3.1%~3.6%之间,麦角甾酮的相对标准偏差在3.3%~3.5%之间,方法的日间精密度较好。
2.3.3 方法的回收率结果
选取了5 种不同类型的模拟霉变香精香料,分别进行了高(20 µg)、中(10 µg)、低(5 µg)3 个水平的加标回收率实验,麦角甾醇的回收率在91%~96%之间,麦角甾酮的回收率在86%~93%之间,方法回收率较为理想,可以应用于实际样品的分析测定。
2.4 实际样品分析
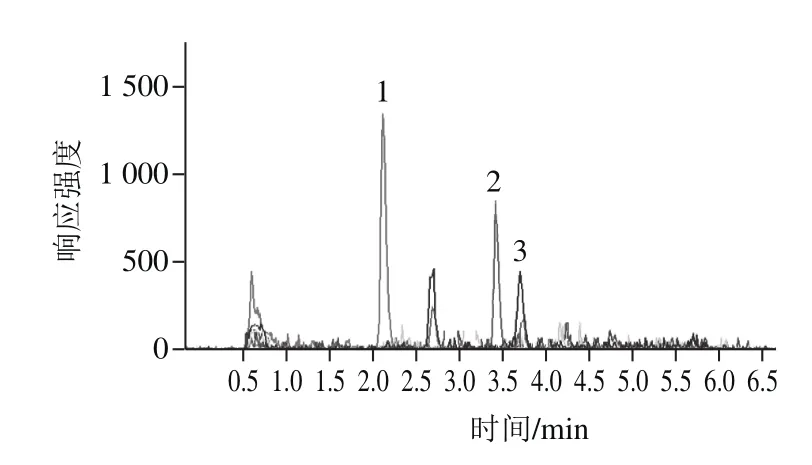
图5 实际样品色谱图Fig.5 MRM chromatograms of real sample
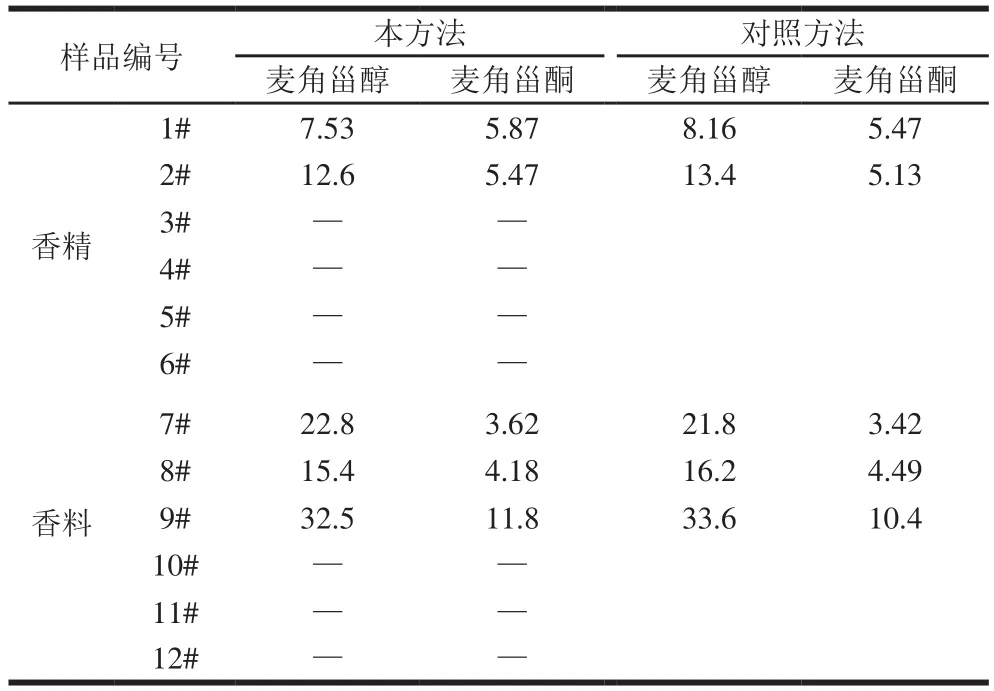
表3 12 种香精香料中目标物质含量的测定Table3 Contents of the target compounds in 12 real samples μg/g
用所建方法对12 种香精香料样品进行前处理,并用优化的方法测定样品中麦角甾醇和麦角甾酮含量,图5为某模拟霉变香料样品的MRM色谱,分析结果见表3。其中1、2、7~9为人工加速霉变的模拟样品(处理方法如2.1节),并用文献[21]的方法对测定结果进行验证,结果表明,本方法的分析结果和对照方法相符合,测定结果准确。
结果表明,除5 种人工模拟加速霉变的样品外,其他企业在用的香精香料样品中麦角甾醇和麦角甾酮含量均低于检测限,说明企业在用香精香料中暂时没有发现霉变风险,而本方法可以有效监控和检测到香精香料样品的霉变情况。
3 结 论
本实验以麦角甾醇和麦角甾酮为霉变标志物,建立了一种新型在线净化前处理HPLC-MS/MS测定香精香料中的麦角甾醇和麦角甾酮的方法,用于香精香料样品霉变情况监控的筛查。方法结合基质分散萃取,柱层析以及索式提取创新性的开发设计了一个在线净化前处理装置,集萃取、净化和浓缩为一体,具有前处理简便易操作,稳定性强,溶剂可回收等优点,方法优化了液相色谱和质谱的各个参数,采用内标法可以快速、有效地对香精香料中的麦角甾醇和麦角甾酮进行测定,该方法已经应用于实际样品的测定,可以对香精香料的安全风险进行有效防控,具有重要应用价值和现实意义。
[1] 左晶晶. 香精香料生产的安全性分析[J]. 安徽化工, 2015, 41(3): 62-64; 67. DOI:10.3969/j.issn.1008-553X.2015.03.022.
[2] 吕丽爽, 陶菲. 香精香料分析方法进展[J]. 食品科学, 2005, 26(8):478-482. DOI:10.3321/j.issn:1002-6630.2005.08.124.
[3] 徐杨斌, 王凯, 刘强, 等. 香精香料中芳香化合物的分析方法研究进展[J]. 化学与生物工程, 2015, 32(6): 6-10. DOI:10.3969/j.issn.1672-5425.2015.06.002.
[4] 邓玉清, 王纪, 虞龙. 微生物麦角甾醇的研究进展[J]. 微生物学杂志,2001, 21(3): 45-47. DOI:10.3969/j.issn.1005-7021.2001.03.017.
[5] MAERTENS J A. History of the development of azole derivatives[J].Clinical Microbiology & Infection, 2004, 10(1): 1-10. DOI:10.1111/j.1470-9465.2004.00841.x.
[6] REESLEV M, MILLER M, NIELSEN K F. Quantifying mold biomass on gypsum board: comparison of ergosterol and beta-N-acetylhexosaminidase as mold biomass parameters[J]. Applied &Environmental Microbiology, 2003, 69(7): 3996-4003. DOI:10.1128/AEM.69.7.3996-3998.2003.
[7] WEETE J D. Fungal lipid biochemistry: distribution and metabolism[M]. New York: Plenum Press, 1974: 160.
[8] NES W R. Role of sterols in membranes[J]. Lipids, 1974, 9(8): 596-612. DOI:10.1007/BF02532509.
[9] BARAJAS-ACEVES M, HASSAN M, TINOCO R, et al. Effect of pollutants on the ergosterol content as indicator of fungal biomass[J].Journal of Microbiological Methods, 2002, 50(12): 227-236.DOI:10.1016/S0167-7012(02)00031-3.
[10] ABRAMSON D, HULASARE R, YORK R K, et al. Mycotoxins,ergosterol, and odor volatiles in durum wheat during granary storage at 16% and 20% moisture content[J]. Journal of Stored Products Research, 2005, 41(1): 67-76. DOI:10.1016/j.jspr.2003.11.002.
[11] 国家标准化管理委员会. 粮油检验粮食中麦角甾醇的测定正相高效液相色谱法: GB/T 25221—2010[S]. 北京: 中国标准出版社, 2010.
[12] MARTIN F, DELARUELLE C, HILBERT J L. An improved ergosterol assay to estimate fungal biomass in ectomycorrhizas[J].Mycological Research, 1990, 94(8): 1059-1064. DOI:10.1016/S0953-7562(09)81333-6.
[13] DJAJAKIRANA G, JOERGENSEN R G, MEYER B. Ergosterol and microbial biomass relationship in soil[J]. Biology & Fertility of Soils,1996, 22(4): 299-304. DOI:10.1007/BF00334573.
[14] 胡月芳. 毛细管电泳-电化学检测法测定淮山中三种植物甾醇含量[J].北方园艺, 2016(12): 162-165. DOI:10.11937/bfyy.201612040.
[15] LI S P, LAI C M, GONG Y X, et al. Simultaneous determination of ergosterol, nucleosides and their bases from natural and cultured Cordyceps by pressurised liquid extraction and high-performance liquid chromatography[J]. Journal of Chromatography A, 2004,1306(2): 239-242. DOI:10.1016/j.chroma.2004.02.080.
[16] 李迎雪, 戴肖东, 詹亚光. HPLC法测定猴头菌菌丝体中麦角甾醇含量[J]. 食用菌, 2010(6): 63-64. DOI:10.3969/j.issn.1000-8357.2010.06.037.
[17] 相聪坤, 宿树兰, 关胜江, 等. HPLC法测定不同产地不同品种马勃药材中麦角甾醇[J]. 中草药, 2016, 47(8): 1397-1400. DOI:10.7501/j.issn.0253-2670.2016.08.025.
[18] 张薇薇, 龚韬, 韩东河, 等. RP-HPLC测定人工虫草和天然虫草中麦角甾醇含量[J]. 中国中医药信息杂志, 2014, 21(4): 67-69.DOI:10.3969/j.issn.1005-5304.2014.04.021.
[19] 易承学, 童珊珊, 徐希明, 等. HPLC法同时测定金针菇中麦角甾醇和22,23-二氢麦角甾醇的含量[J]. 江苏大学学报(医学版), 2014,24(2): 126-128. DOI:10.13312/j.issn.1671-7783.y130281.
[20] ZHAO Y Y, QIN X Y, CHENG X L, et al. Rapid resolution liquid chromatography-mass spectrometry and high-performance liquid chromatography-fluorescence detection for metabolism and pharmacokinetic studies of ergosta-4,6,8(14),22-tetraen-3-one[J].Analytica Chimica Acta, 2010, 675(2): 199-206. DOI:10.1016/j.aca.2010.07.029.
[21] ZHAO Y Y, ZHAO Y, ZHANG Y M, et al. Qualitative and quantitative analysis of the diuretic component ergone in Polyporus umbellatus by HPLC with fluorescence detection and HPLC-APCI-MS/MS[J]. Pharmazie, 2009, 64(6): 366-370.DOI:10.1691/ph.2009.8364.
[22] 李思明, 冯怡, 曾星. HPLC-APCI-MS/MS法同时测定猪苓颗粒中麦角甾酮与麦角甾醇的含量[J]. 药物分析杂志, 2014, 34(4): 649-653.
[23] 戚大伟, 林华清, 沙云菲, 等. 气相色谱-质谱联用法测定烟草及烟草制品中的麦角甾醇[J]. 烟草科技, 2013(5): 41-45. DOI:10.3969/j.issn.1002-0861.2013.05.011.
[24] 黄龙, 王进元, 罗诚浩, 等. 烟草中游离植物甾醇的GC/MS/SIM分析[J]. 烟草科技, 2006(10): 41-45. DOI:10.3969/j.issn.1002-0861.2006.10.011.
[25] LIU W H, DING B, RUAN X M, et al. Analysis of free and conjugated phytosterols in tobacco by an improved method using gas chromatography-f l ame ionization detection[J]. Journal of Chromatography A, 2007, 1163(1/2): 304-311. DOI:10.1016/j.chroma.2007.06.043.
[26] SHA Y F, DENG C H, LIU B Z. Development of C18-functionalized magnetic silica nanoparticles as sample preparation technique for the determination of ergosterol in cigarettes by microwave-assisted derivatization and gas chromatography/mass spectrometry[J]. Journal of Chromatography A, 2008, 1198/1199: 27-33. DOI:10.1016/j.chroma.2008.05.049.
[27] 唐艳斌, 段晓艳, 王丽娟, 等. 麦角甾醇含量检测分析柑橘真菌污染程度的方法研究[J]. 中国酿造, 2016, 35(6): 50-54. DOI:10.11882/j.issn.0254-5071.2016.06.011.
[28] 李蓉, 卢俊文, 杨芳, 等. 基质固相分散萃取-气相色谱-串联质谱法同时测定蔬菜中195 种农药残留[J]. 食品科学, 2014, 35(24): 301-307. DOI:10.7506/spkx1002-6630-201424058.
[29] 乌日娜, 李建科. 基质固相分散在食品安全分析中的应用[J]. 食品科学, 2005, 26(6): 266-268. DOI:10.3321/j.issn:1002-6630.2005.06.063.
[30] 罗自生, 冯思敏, 张炎冰, 等. 一种测定甘蔗中不同形式植物甾醇含量的方法: 201510244497.6[P]. 2015-09-16.
