负载紫杉醇CSNRDARRC-PCL-PGA/TPGS多肽纳米颗粒调控膀胱癌RT112细胞增生及促凋亡
2018-06-04刘百川何灵生张煦张涛邱晓拂李高远陈波特杨国胜
刘百川 何灵生 张煦 张涛 邱晓拂 李高远 陈波特 杨国胜
膀胱癌是泌尿系统常见的原发性恶性肿瘤之一,膀胱癌对紫杉醇等化疗药物敏感,但紫杉醇有难溶于水、半衰期短及毒性大等缺点,因此紫杉醇在临床上的应用受到了限制。目前国内外市面销售的紫杉醇注射液,是将紫杉醇溶解于吐温中,该制剂临床用药不便,安全性低;口服给药虽可提高患者的顺应性,但低的水溶解度和胃肠道的外排作用,使紫杉醇的口服生物利用度非常低。因此,开展对膀胱癌的生物特性的研究,确立防治靶点,寻求新的治疗方式对提高膀胱癌的疗效具有一定的重要性。
文献报道紫杉醇可通过不同的凋亡机制发挥作用,如下调Bcl-2和Bcl-xL表达,并导致细胞周期停滞在G2/M期[1]。有报道罗勒多糖联合紫杉醇可使A549细胞内钙离子浓度提高,造成线粒体膜电位下降,使细胞周期停滞在G2/M及S期,导致细胞凋亡的增加[2]。因此,紫杉醇可以以联合治疗方式来抑制癌细胞的生长。噬菌体肽库展示技术近几年来得到迅速发展,成为生物学研究和应用领域中有效而重要的工具。目前已知的有膀胱肿瘤导向多肽RGD序列、NVVRQ序列和CSNRDARRC序列(膀胱癌) 等[3-6]。这些多肽在膀胱肿瘤学的研究中具有重要意义。多肽在今后的临床诊断和治疗中都具有广阔的前景。已有研究表明,肽段CSNRDARRC与膀胱癌细胞T24能够特异性结合,在膀胱肿瘤细胞中是重要的配体肽段[4]。
聚乙二醇1000维生素E琥珀酸酯(D-α-tocopherol polyethylene glycol 1000 succinate, TPGS)是一个性能优良的乳化剂,TPGS能显著提高药物在PLGA纳米颗粒中的包封率。TPGS能通过阻断P-糖蛋白活性而增强药物的吸收和治疗效果,并且有效促进细胞凋亡、提高抗肿瘤活性,另外药物与TPGS合用后能明显增加胃肠道内的吸收,提高其生物利用度[7-13]。
随着纳米技术的开发研究,尤其是纳米药物制剂的发展,其在癌症治疗中显示出巨大的潜力和优越性,由于生物可降解聚合物纳米颗粒在口服给药后具有主动和被动的靶向治疗作用,因此,本实验拟采用双靶向多肽CSNRDARRC-PCL-PGA/TPGS载药纳米颗粒来治疗膀胱癌,通过CSNRDARRC-PCL-PGA与TPGS形成共混胶束,利用TPGS能抑制P-糖蛋白的外排作用来提高药物吸收的效率,增加靶器官药物浓度,为膀胱癌的治疗开辟新途径。
材料与方法
一、实验材料
TPGS[C33O5H54(CH2CH2O)23]及聚己内酯(分子量=41 000 Da)和辛酸亚锡[Sn(OOCC7CH15)2][购于西格玛-奥尔德里奇(圣刘易斯)];TPGS-b-(PCL-ran-PGA)嵌段共聚物(分子量=25 000 Da)和纯度为99.9%的紫杉醇[购于Nano Med生物技术有限公司(中国深圳)];配体肽段CSNRDARRC,由半胱氨酸-丝氨酸-天冬酰胺-精氨酸-天冬氨酸-丙氨酸-精氨酸-精氨酸-半胱氨酸组成的氨基酸序列(上海肽仕生物公司合成);胎牛血清[购于Gibco(瑞典生物技术公司)];甲醇和乙腈[购于EM Science (马林克罗贝克)];去离子水(由密理博公司的纯水系统制备);RT112、T24及SV-HUC-1细胞[购于American Type Culture Collection (Manassas, VA)]。
二、载有紫杉醇的多肽配体-PCL-PGA/TPGS共聚物的纳米颗粒的制备
应用溶剂萃取/蒸发法制备纳米颗粒[14]。取11 mg 的紫杉醇粉末和100 mg的TPGS-b-(PCL-ran-PGA)嵌段共聚物,溶解于二氯甲烷中。随后倒入TPGS(0.03% w/v)溶液中并温和搅拌。在常温条件,静置水油乳浊液过夜。80 000×g离心收集纳米颗粒,将收集到的纳米颗粒悬浮于去离子水中,冻干。之后TPGS-b-(PCL-ran-PGA)纳米颗粒按照文献报道的方法与多肽配体修饰。先将多肽配体配制成0.5 mg/ml的去离子水溶液,然后纳米颗粒以9.5 mg/ml的浓度悬浮于多肽配体水溶液中,在冰浴条件下超声波处理溶液,最后80 000×g离心20 min 收集纳米颗粒,即为多肽紫杉醇NP。
三、纳米颗粒的表征
1.纳米颗粒的大小和表面电动势测定:通过动态光散射测定纳米颗粒的平均直径和颗粒大小分布范围,所用的仪器是Malvern Zeta sizer Nano-ZS90(马尔文仪器有限公司)。纳米颗粒表面的电荷利用激光多普勒风速测量,所用的仪器是Zeta sizer Nano Series instrument (马尔文仪器有限公司)。所有的测量均进行3次验证。
2.纳米颗粒的形态表征:将纳米颗粒溶液放置于400目碳包埋的铜网上,随后通过发射扫描电子显微镜(FE-SEM; Zeiss 77 SUPRA 40VP)检测其纳米颗粒的形态。
3.药物装载和包埋效率测试:采用高效液相色谱(HPLC)法检测取出的释放药物介质中紫杉醇的含量。取干燥的5 mg纳米颗粒溶解于二氯甲烷中,然后转移到流动相中(乙腈/去离子水,v/v=50∶50),将上述样品进行HPLC分析。随后于紫外可见光探测器下监测,纳米颗粒摄取药物的能力定义为最终产物中药物装载的百分比。所有的实验均重复3次。
4.体外药物释放实验:取15 mg装载有药物的纳米颗粒,将其悬浮在5 ml的释放介质中(PBS 7.4 含有 0.1% w/v Tween80)。将纳米颗粒悬浮物转移到透析袋,浸润在释放介质的离心管中。将离心管放置37 °C水浴锅,并以130 rpm速度旋转。每10 min取出样品,经由HPLC分析。后续的分析测试方法与测定药物摄取效率的方法相同。
四、细胞培养
将RT112、T24及SV-HUC-1细胞培养于37 °C,5% CO2的组织培养液中。所用的培养液(DMEM)添加了100g/ml链霉素和20%胎牛血清,平均每2 d更换一次培养液。待细胞生长到70%~90%左右,用0.25%的胰蛋白酶-乙烯基联氨四乙酸溶液(Invitrogen)消化细胞,进行细胞传代。
五、药物毒性试验
将RT112、T24及SV-HUC-1细胞以每孔5 000个细胞的密度铺板在96孔细胞培养板上过夜。选定紫杉醇作为测试的转载抗肿瘤模式化合物。RT112细胞在同等浓度(10 mg/L)紫杉醇下分别与多肽紫杉醇-PCL-PGA/TPGS纳米颗粒悬浮物(多肽紫杉醇NP)、装载紫杉醇的TPGS-b-(PCL-ran-PGA)纳米颗粒悬浮物(紫杉醇NP)、PCL-PGA/TPGS纳米颗粒悬浮物(NP)以及未装载紫杉醇的多肽TPGS-b-(PCL-ran-PGA)纳米颗粒悬浮物(多肽NP)培养液共培育12、24和48 h。在达到设定共培育时间之后,用新鲜的含有MTT(5 mg/ml)DMEM培养液替代含有纳米颗粒的细胞培养液继续培养4 h。之后吸走含有MTT的培养液,并加入150 ml DMSO溶解三苯基甲酯形成的晶体,用酶标仪(model 680, Bio-Rad Laboratories, United Kingdom)测定每一个孔在570 nm的吸收。未处理组(Control组)的吸收光强度作为细胞100%活性的标准,无添加MTT的细胞孔作为Blank用来计算荧光分光亮度计在0的吸收值。上述实验结果用平行实验结果的平均值±资料的标准偏差来表示,每次实验重复3次。
六、细胞周期分析
将RT112细胞以每孔1×105个细胞的密度铺板在6孔细胞培养板上过夜, 隔天加入RT112细胞,在同等浓度(10 mg/L)紫杉醇下分别与多肽载药NP、载药NP以及多肽空NP,于培养液共培育12 h。在达到24 h后,利用0.25%胰酶消化后分别进行PI染剂(0.3% TRIPTON X-100, 25 mg/ml PI, 0.1 mmol/L EDTA 及 10 mg/ml RNase 溶于 PBS))染色30 min,随后利用流式细胞仪进行分析(Becton Dickinson, BD)。
七、细胞凋亡分析
1.DAPI细胞核染色:将细胞经由4%多聚甲醛固定10 min,随后DAPI染色10 min,在荧光显微镜上观察。
2.Annexin V/PI染色:用胰酶将细胞消化后分别进行Annexin V 及 PI染色 (Dead Cell Apoptosis Kit, Invitrogen, V13241),随后利用流式细胞仪进行分析(Becton Dickinson, BD)。
3.腺粒体膜电位分析:将细胞经过胰酶消化后,利用JC-1染色15 min (Dead Cell Apoptosis Kit, Invitrogen, V13241),在荧光显微镜上观察。
以上实验的细胞铺板及纳米颗粒处理参考细胞周期分析方法。
八、统计学方法
实验数据以平均值±标准偏差表示,所有数据采用GraphPad Prism 5进行统计学处理,用T检验法及方差分析来验证变数平均值的可信性。实验数据在P<0.05情况下才被视为有可信性。
结 果
一、负载紫杉醇胶束的表征
1.大小及电势:通过场发射扫描电子显微镜发现多肽紫杉醇NP呈窄单分散,平均流体力学直径在255.3 nm左右(图1A)。而透射电镜的结果显示多肽紫杉醇NP是分布均一的球形颗粒,粒径在240~260 nm (图1B)。Z电势测试结果印证了通过多肽修饰的紫杉醇NP能够减少纳米颗粒表面的负电荷(表1)。没有修饰的纳米颗粒表面电荷为-20.2 mV,修饰了多肽后,纳米颗粒表面电荷为-11.2 mV。负电荷减少,可以较TPGS-b-(PCL-ran-PGA)更容易进入细胞。

表1 负载紫杉醇纳米颗粒特征
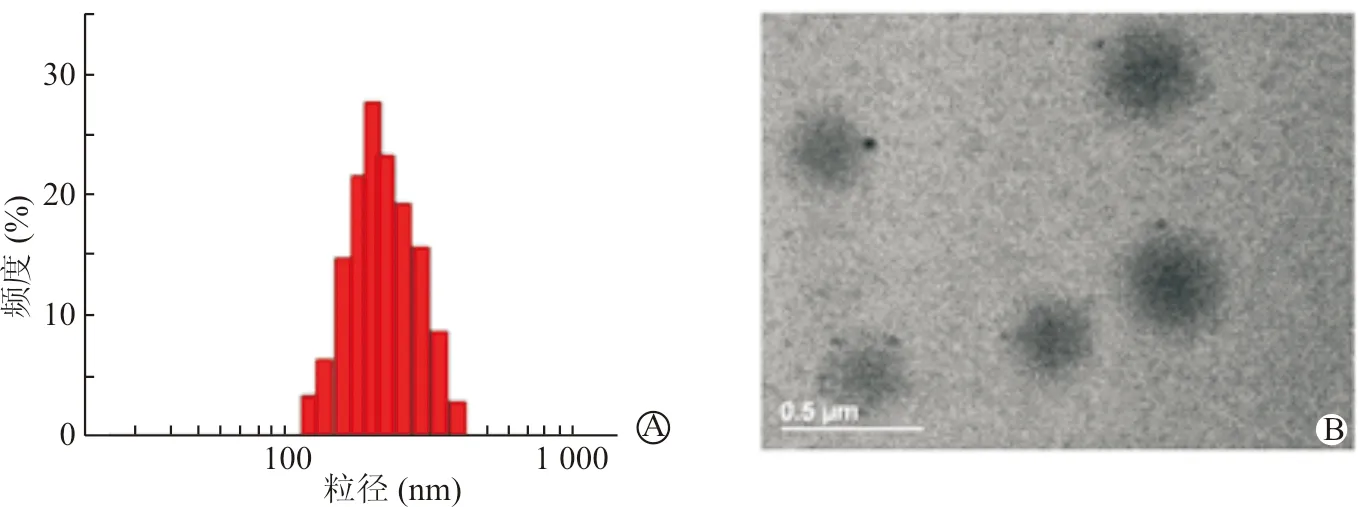
A:粒径分布;B:透射电镜图
图1 多肽紫杉醇NP粒径大小及电势
2.药物释放行为:通过HPLC测得多肽紫杉醇NP的载药量为(8.36±0.05)%(表1)。紫杉醇NP及多肽紫杉醇NP具有相似的紫杉醇释放模式,开始基本都是爆发式的释放(图2),之后释放紫杉醇的速度变缓直到接近于0。紫杉醇NP在40 h释放了28.87%的紫杉醇,在120 h释放了41.58%的紫杉醇。多肽紫杉醇NP在40 h释放了33.87%的紫杉醇,在120 h释放了45.48%的紫杉醇。
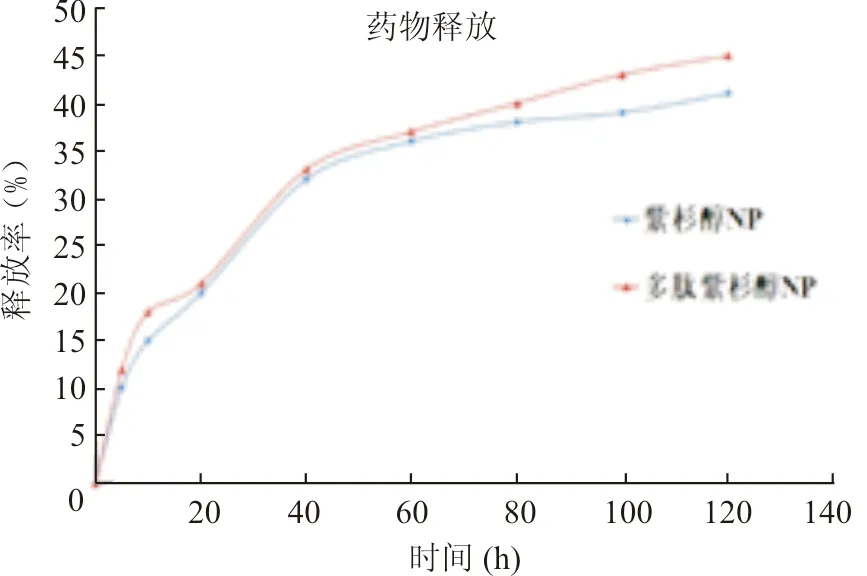
图2 负载紫杉醇钠米颗粒药物释放情况
二、多肽紫杉醇颗粒抑制膀胱癌细胞增殖
在同等浓度(10 mg/L)紫杉醇下RT112及T24分别与多肽紫杉醇NP、紫杉醇NP、多肽颗粒以及空NP于培养液共培育12、24和48 h。紫杉醇NP及多肽紫杉醇NP皆有时间依赖性,随着时间的增加, RT112及T24细胞存活率降低,而且多肽紫杉醇NP优于紫杉醇NP。而空NP以及多肽NP皆无毒性。细胞活性试验结果(多肽紫杉醇NP组>紫杉醇NP组)与培育时间相关。这可能是与纳米颗粒持续和可控的药物释放方式有关系。多肽NP对SV-HUC-1膀胱上皮细胞无毒性,多肽紫杉醇NP虽然对SV-HUC-1膀胱上皮细细有些许毒性,但相对于RT112膀胱癌细胞而言,多肽紫杉醇NP毒性还是相对大一点。多肽紫杉醇NP能够有效抑制膀胱癌细胞增殖。
三、多肽紫杉醇NP调控RT112膀胱癌细胞的细胞周期分析
经多肽紫杉醇NP、紫杉醇NP以及多肽NP处理后, PI染色显示,在10 mg/L浓度的紫杉醇下, RT112细胞经由紫杉醇NP处理后,G2/M期增加至28.02%;而多肽紫杉醇NP处理后,G2/M期增加至48.03%,结果证明多肽紫杉醇NP能使细胞停滞在细胞周期的G2期,与多肽紫杉醇NP影响细胞存活率结果一致。见图3。
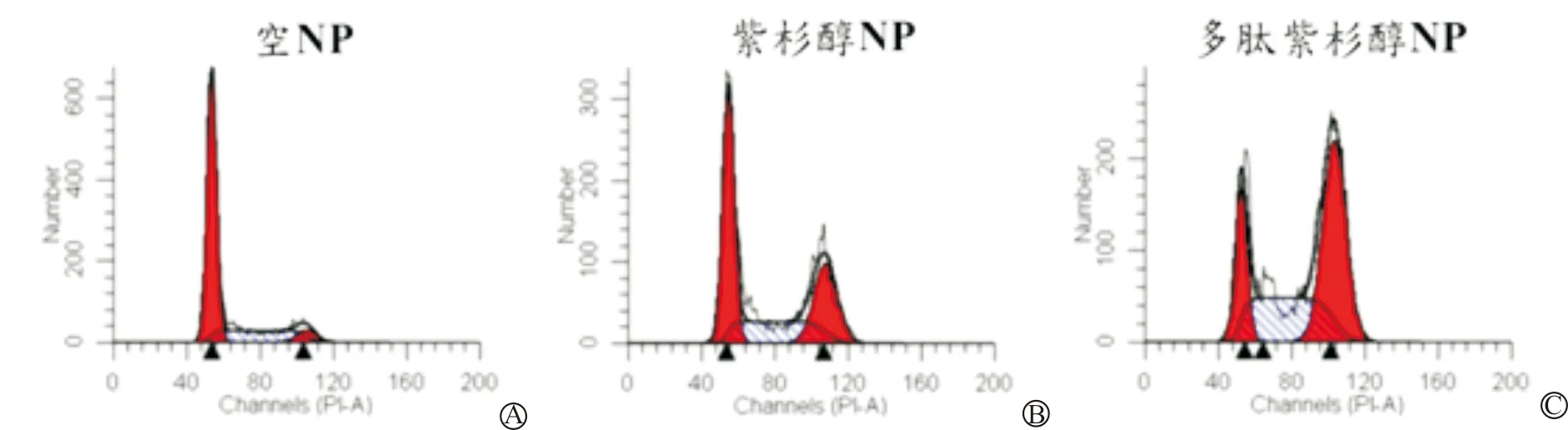
A:空NP;B:紫杉醇NP;C:多肽紫杉醇NP
图3 负载紫杉醇纳米颗粒对RT112细胞周期的影响
四、多肽紫杉醇NP造成膀胱癌细胞RT112细胞凋亡
从细胞存活结果发现紫杉醇NP会造成RT112细胞的存活率下降,因此我们推测紫杉醇NP可能引发细胞凋亡,我们使用Annex V/PI染色来观察紫杉醇NP对RT112细胞的影响。RT112细胞经由紫杉醇NP处理后有些细胞核浓缩片断化;而在多肽紫杉醇NP处理后细胞核浓缩片断化更明显,符合细胞凋亡的表观现象。见图4A。Annex V/PI染色显示,紫杉醇NP处理后细胞凋亡发生增加至37.5%,而在多肽紫杉醇NP处理后细胞凋亡增加至68.0%。见图4B。证明多肽紫杉醇NP引起的细胞凋亡较紫杉醇NP更有效,多肽紫杉醇NP较紫杉醇NP更能促进细胞凋亡。

A:DAPI染色;B:Annex V/PI 染色
图4 负载紫杉醇纳米颗粒对RT112细胞凋亡的影响
五、腺粒体膜电位下降引起细胞凋亡
利用JC-1染色分析紫杉醇NP是否可通过改变腺粒体膜电位而造成细胞凋亡。实验结果显示,RT112细胞经紫杉醇NP处理后,红色荧光减少,绿色荧光增多;而在多肽紫杉醇NP处理后,红色荧光急速下降,绿色荧光明显增加,细胞色素C释放到细胞质中,有凋亡发生。见图5。
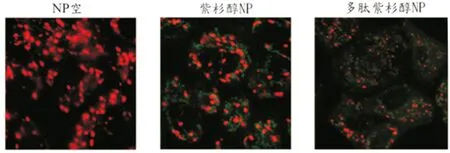
图5 负载紫杉醇纳米颗粒导致线粒体膜电位改变而造成凋亡
讨 论
膀胱癌是泌尿系统中最常见的原发性恶性肿瘤,大多膀胱癌患者使用紫杉醇等化疗药物进行治疗。但紫杉醇有难溶于水、半衰期短及副作用大等缺点。目前膀胱癌导向多肽在膀胱癌的研究中具有重要意义,如已知的膀胱癌导向多肽RGD序列、NVVRQ序列和CSNRDARRC序列[4-6],多肽在今后的临床诊断和治疗中都具有广阔的前景。已有研究表明,肽段CSNRDARRC可与T24膀胱癌细胞进行特异性结合,是膀胱肿瘤细胞研究中重要的配体肽段[4]。 为了改善紫杉醇的缺点,我们利用CSNRDARRC多肽负载紫杉醇来治疗膀胱癌。
多肽-PCL-PGA/TPGS的合成较困难,因PCL是疏水核,不易与多肽连结。为此我们使用多肽TPGS-b-(PCL-ran-PGA) (多肽NP)和紫杉醇复合,得到了负载紫杉醇多肽的胶束TPGS-b-(PCL-ran-PGA) (多肽紫杉醇NP)。从图1发现多肽紫杉醇NP呈窄单分散,平均流体力学直径在255.3 nm左右,粒径在240~260 nm。通过ICP-MS,我们测得多肽紫杉醇NP的载药量约为(8.36±0.05)%(表1),可能是由于多肽紫杉醇的亲水性更好并且分子量较紫杉醇NP小,导致共聚物膨大并且被降解的速度更快,从而加速了紫杉醇从载体中释放。
细胞毒性实验显示,多肽紫杉醇NP组>紫杉醇NP组且与培育时间呈依赖性,这可能是与纳米颗粒持续和可控的药物释放方式有关系。根据紫杉醇能导致细胞周期停滞在G2/M期的报道,结合细胞毒性实验结果,我们认为多肽紫杉醇NP可能会影响细胞周期,从图3发现多肽紫杉醇NP的确能够使细胞停滞在细胞周期的G2期,这也与多肽紫杉醇NP影响细胞存活率结果一致。经由细胞存活率的结果可以推测多肽紫杉醇NP可能会造成细胞凋亡。
由于早期凋亡细胞呈现核浓缩,经由DAPI染色加深后核染色质会呈现新月形并聚集于核膜一边,晚期凋亡时,细胞会出现核碎裂呈大小不等的圆形小体,并被细胞膜所包围,即凋亡小体,因此利用DAPI染色来观察细胞凋亡[15]。从图4发现,经由紫杉醇NP处理后有些细胞核浓缩片断化;而在多肽紫杉醇NP处理后细胞核浓缩片断化更明显,因此符合细胞凋亡的表观现象。利用Annex V/PI染色也验证紫杉醇NP能使细胞的凋亡情况增加,多肽紫杉醇NP引起的细胞凋亡较紫杉醇NP更有效。
细胞凋亡属于程序性死亡,不同的刺激会启动不同的信号通路而促发凋亡。目前较为经典的信号有两条:Fas-FasL及caspase启动的信号通路[16-17]。其中,caspase信号通路会破坏腺粒体膜的完整性,使细胞色素C从腺粒体内释放到细胞质中,启动下游的caspase通路,最终引起凋亡发生[18]。当腺粒体膜完整时,JC-1会被吸入进腺粒体中,形成JC-1聚合物,发射红色荧光;但腺粒体膜被破坏后,造成膜电位下降,此时JC-1会分散在细胞质中,而发出绿色荧光,因此可以从JC-1染色来验证细胞凋亡的通路[19]。从JC-1染色来验证多肽紫杉醇NP对细胞凋亡的通路。从图5结果发现,RT112细胞经多肽紫杉醇NP处理后,红色荧光急速下降,绿色荧光明显增加,细胞色素C释放到细胞质中,有凋亡发生的现象。
本研究成功合成了负载紫杉醇多肽-PCL-PGA/TPGS纳米颗粒,通过CSNRDARRC-PCL-PGA与聚乙二醇1000维生素E琥珀酸酯(TPGS)形成共混胶束,这种表面TPGS包覆的纳米载体具有很强的稳定性,并且多肽CSNRDARRC具有双靶向,能够通过纳米载体的方式来抑制RT112细胞生长,造成RT112膀胱癌细胞细胞周期停滞,并且通过腺粒体膜电位下降而引起细胞凋亡。综合以上结果我们发现,负载紫杉醇多肽-PCL-PGA/TPGS纳米颗粒载体为膀胱癌的治疗提供了一个新手段,可作为治疗膀胱癌的一种潜力药物。
[1] Yang CH, Horwitz SB. Taxol(R): The First Microtubule Stabilizing Agent[J]. Int J Mol Sci,2017,18(8). doi: 10.3390/ijms18081733.
[2] 李路,杨军,李兰,等. 罗勒多糖联合紫杉醇对 A549 细胞线粒体膜电位和细胞周期的影响[J]. 中南药学,2016,(5):471-475.
[3] Xiao M, Hong Z, Sun L, et al. TMTP1, a Novel Tumor-homing Peptide, Specifically Targets Hematological Malignancies and Their Metastases[J]. J Huazhong U Sci-Med,2011,31(5):608-613.
[4] Jia XY, Yu Q, Zhang ZH, et al. Targeting bladder tumor cells in voided urine of Chinese patients with FITC-CSNRDARRC peptide ligand[J]. Onco Targets Ther,2012,5:85-90.
[5] Yao VJ, D'Angelo S, Butler KS, et al. Ligand-targeted theranostic nanomedicines against cancer[J]. J Control Release,2016,240:267-286.
[6] Yang XF, Pang JZ, Liu JH, et al. Homing Peptide Guiding Optical Molecular Imaging for the Diagnosis of Bladder Cancer[J]. Proc Spie,2014,(96281):1-12.
[7] Dintaman JM, Silverman JA. Inhibition of P-glycoprotein by D-alpha-tocopheryl polyethylene glycol 1000 succinate (TPGS)[J]. Pharm Res,1999,16(10):1550-1556.
[8] Yang C, Wu T, Qi Y, et al. Recent Advances in the Application of Vitamin E TPGS for Drug Delivery[J]. Theranostics,2018,8(2):464-485.
[9] Sun Y, Yu B, Wang G, et al. Enhanced antitumor efficacy of vitamin E TPGS-emulsified PLGA nanoparticles for delivery of paclitaxel[J]. Colloids Surf B Biointerfaces,2014,123:716-723.
[10] Mu L, Feng SS. A novel controlled release formulation for the anticancer drug paclitaxel (Taxol): PLGA nanoparticles containing vitamin E TPGS[J]. J Control Release,2003,86(1):33-48.
[11] Watanabe T, Miyauchi S, Sawada Y, et al. Kinetic-Analysis of Hepatobiliary Transport of Vincristine in Perfused-Rat-Liver - Possible Roles of P-Glycoprotein in Biliary-Excretion of Vincristine[J]. J Hepatol,1992,16(1-2):77-88.
[12] Choudhury H, Gorain B, Pandey M, et al. Recent advances in TPGS-based nanoparticles of docetaxel for improved chemotherapy[J]. Int J Pharmaceut,2017,529(1-2):506-522.
[13] Duhem N, Rolland J, Riva R, et al. Tocol modified glycol chitosan for the oral delivery of poorly soluble drugs[J]. Int J Pharm,2012,423(2):452-460.
[14] Ma Y, Zheng Y, Zeng X, et al. Novel docetaxel-loaded nanoparticles based on PCL-Tween 80 copolymer for cancer treatment[J]. Int J Nanomedicine,2011,6:2679-2688.
[15] Huerta S, Goulet EJ, Huerta-Yepez S, et al. Screening and detection of apoptosis[J]. J Surg Res,2007,139(1):143-156.
[16] Elmore S. Apoptosis: A review of programmed cell death[J]. Toxicol Pathol,2007,35(4):495-516.
[17] Ouyang L, Shi Z., Zhao S, et al. Programmed cell death pathways in cancer: a review of apoptosis, autophagy and programmed necrosis[J]. Cell Prolif,2012,45(6):487-498.
[18] Jiang X, Wang X. Cytochrome C-mediated apoptosis[J]. Annu Rev Biochem,2004,73:87-106.
[19] Kroemer G, Reed JC. Mitochondrial control of cell death[J]. Nat Med,2000,6(5):513-519.
