促进桉树焦枯病菌大量产孢的方法
2018-05-30郭朦朦杨泽慧张清华冯丽贞
郭朦朦,丁 奕,杨泽慧,张清华,冯丽贞,宋 漳
(福建农林大学 林学院,福建 福州 350002)
丽赤壳属(Calonectria)为广谱寄生真菌,可致多种植物病害,引起木本植物根腐、茎腐、叶斑以及焦枯等症状[1-3]。桉树焦枯病菌(Cylindrocladium leaf blight)是热带及亚热带桉树种植区内危害最严重的病害之一,也是我国林业检疫性病害[4-8]。其主要症状为受害叶片顶端开始呈现焦枯状、在枯叶表面形成黑色小点,病健交接处有淡黄色晕圈,并使嫩枝梢枯,病害严重时可造成树冠光秃、枝干腐烂,个体生长势衰弱,林分蓄积量下降,严重阻碍桉树产业发展[4]。前期研究发现,引起福建省桉树焦枯病病害发生的主要病原主要有 Ca.kyotensis、Ca.pseudocolhounii、Ca.pseudoreteaudii[7],其中Ca.pseudoreteaudii YA51为致病性强的优势种。
植物的病原学研究以及抗病性鉴定等工作的重要环节之一是诱导促使真菌产生分生孢子[9]。通常促进分生孢子产生的方法主要有近紫外光照射、菌落划伤、菌丝涂断、更换培养基或在培养基中加入植物煎汁或组织、某种营养成分等[9-16]。课题组前期对桉树焦枯病菌研究中发现,Ca.pseudoreteaudii YA51在马铃薯葡萄糖琼脂培养基 (potato dextrose agar medium,PDA)中产孢量少且菌丝旺盛,不利于后期进行孢子原生质体的制备以及农杆菌介导转化试验。随着桉树的大规模种植,桉树焦枯病的危害日益加重[17]。如何通过人工的方式快速、高效的获得大量孢子成为该病害研究的瓶颈。有鉴于此,本试验以查彼德培养基(Czapek-Dox Medium)为基础,添加不同组分旨在寻找促进Ca.pseudoreteaudii YA51高效产孢的培养基配方,为后续研究奠定坚实基础。
1 材料与方法
1.1 试验材料
试验所用菌株分离自福建福州地区桉树焦枯病病样叶片,为实验室期鉴定的为Ca.pseudoreteaudii YA51[7]。
1.2 培养基
(1)马铃薯葡萄糖琼脂培养基(potato dextrose agar medium,PDA ),加水定容至 1 L[18]。

表1 马铃薯葡萄糖琼脂培养基Table 1 Potato glucose agar medium
(2)查彼特培养基(czapek-dox medium,Czapek),加水定容至1 L[18]。

表2 查彼特培养基Table 2 Chapel medium
(3)Czapek-Dox Medium+桉树叶煎汁 (Czapek+ELA),Czapek-Dox Medium中以3 g桉树叶煮沸的煎汁取代纯水。
(4)Czapek-Dox Medium+桉树叶煎汁+维生素 B1+维生素 B6(CzapekE+VB1+VB6)
(5)Czapek-Dox Medium+ 南美蟛 蜞 菊 (Wedelia trilobata(L.)Hitchc.)煎汁(Czapek+WTLA),其中以 3 g蟛蜞菊叶片煮沸的煎汁代替纯水。
(6)Czapek-Dox Medium+桉树叶煎汁+维生素 B1(CzapekE+VB1),设置维生素 B1的浓度梯度为 0.10、0.20、0.30、0.40、0.80、1.20、1.60、2.00、3.00、4.00、5.00 g·L-1。
各培养基110 kpa,121℃灭菌20 min,备用。
1.3 试验方法
1.3.1 培养基对Ca.pseudoreteaudii YA51生长的影响
将菌株接种于PDA培养基中,置于黑暗条件下,28℃恒温培养10 d,待菌落长至培养皿边缘时,用接种针挑取边缘新鲜菌丝,分别接种与上述(1.2培养基)不同平板(直径9 cm)中央,黑暗无光,28℃培养7 d[9]。测量菌落直径,观察并比较不同培养基之间菌落特征以及生长速度的异同。以PDA培养基作为对照。每种培养基重复3皿。
1.3.2 培养基对Ca.pseudoreteaudii YA51产孢和孢子萌发率的影响
接菌方式与培养条件和1.3.1相同。培养7 d后,先用移液枪枪头轻轻刮掉菌丝,再以2 mL无菌水清洗全皿,并用枪头轻轻刮洗培养皿表面,并反复用菌液清洗,确保分生孢子没有粘附在培养基上,吸取200μL置于血球计数仪板上计算和统计单位菌落面积的产孢量。以PDA培养基为对照。每种培养基重复3皿。
1.4 数据处理
利用SPSS和Excel对试验数据进行处理和分析。
2 结果与分析
2.1 不同培养基对菌落形态、生长的影响
不同培养基对菌株直径具有一定影响,其中CzapekE+VB1的平均直径最小,为4.2 cm,CzapekE+VB1+VB6最大直径为6.42 cm。PDA直径居中(图1)。说明复合维生素营养有宜菌落直径的生长。由图2可看出,不同培养基对菌落形态影响较大,PDA和CzapekE+VB1+VB6菌丝厚重,且菌落周边偏白,中央区域呈现淡褐色,但产孢较少,说明营养物质丰富,有利于菌丝生长。Czapek和Czapek+WTLA菌落呈现深褐色,菌丝较稀疏,其中Czapek有菌株老化的趋势,且产孢不明显,表明营养匮乏,仅能维持菌落基本生长,无法为后期生长提供充足养分。Czapek+ELA和Czapek+VB1菌落整体颜色偏白。CzapekE+VB1可明显看出产孢区,菌丝稀疏。因此,以上试验结果说明在可维持基本生长的Czapek基础上,CzapekE+VB1+VB6菌丝过胜,不利于后期分生孢子液的制作,CzapekE+VB1的组合菌丝稀少,且具有促进产孢的作用。
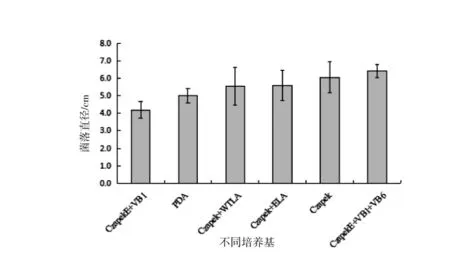
图1 不同培养基对Ca.pseudoreteaudii YA51直径的影响Figure 1 Effects of different culture media on mycelial growth of Ca.pseudoreteaudii YA51
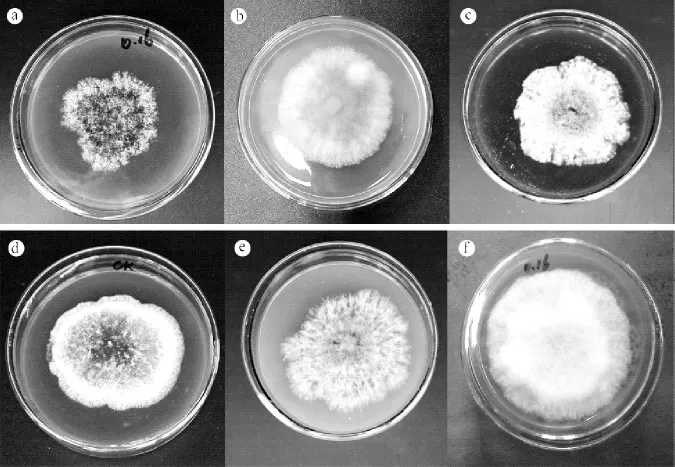
图2 不同培养基对Ca.pseudoreteaudii YA51形态和直径的影响Figure 2 Effects of different culture media on mycelial growth and shape of Ca.pseudoreteaudii YA51
2.2 不同培养基对产孢和孢子萌发率的影响
Czapek+ELA 、CzapekE+VB1、CzapekE+VB1+VB6、Czapek+WTLA均对菌株产孢有促进作用,产孢量依次为 1.33×106、1.17×106、7.00×105、1.43×106个/mL,分别为对照组的2倍、2倍、1倍、3倍。但不同培养基对孢子萌发率影响不大,萌发率均在95%以上,表明不同组分不会造成菌落突变或死亡。
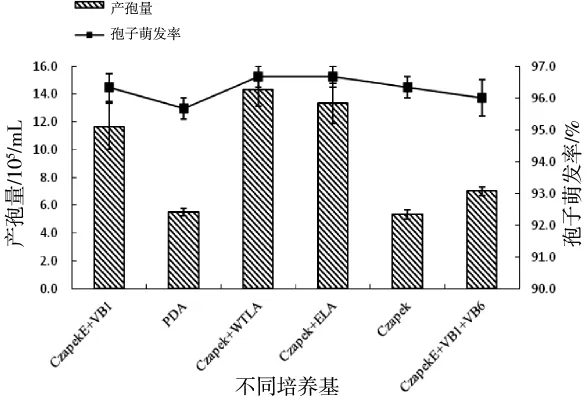
图3 不同培养基对Ca.pseudoreteaudii YA51产孢和孢子萌发的影响Figure 3 Effects of different culture media on sporulation and conidia germination of Ca.pseudoreteaudii YA51
2.3 不同浓度维生素B1对菌落形态、生长速度的影响
对VB1促进产孢最佳浓度筛选试验表明。不同浓度VB1对菌落直接影响不大(图4),但菌落形态有明显差异(图5)。添加桉树叶煎汁和VB1的菌落菌丝稀疏,肉眼可以明显观察到产孢区。然而,随着浓度的增加,菌落中间黄色区域明显变多,可见产孢区减少,有衰老趋势,因此,高浓度VB1对于Ca.pseudoreteaudii YA51具毒害作用。

图4 不同维生素B1浓度对Ca.pseudoreteaudii YA51直径的影响Figure 4 Effects of different vitamin B1’s concentration on mycelial growth of Ca.pseudoreteaudii YA51
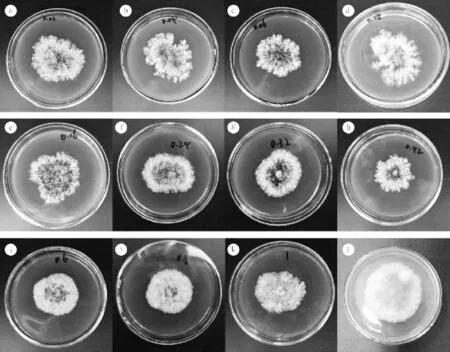
图5 不同维生素B1浓度对Ca.pseudoreteaudii YA51形态和直径的影响Figure 5 Effects of different vitamin B1’s concentration on mycelial growth and shape of Ca.pseudoreteaudii YA51
2.4 不同浓度维生素B1对产孢和孢子萌发率的影响
随着VB1浓度的增加,产孢量和孢子萌发率的趋势为先增加后减少(图6),在VB1浓度为0.4 g·L-1时达到巅峰,产孢量为3.23×106个/mL,是对照组的6倍,自0.4 g·L-1高峰后,产孢量极速下降,孢子萌发率也随着浓度的增高而降低,因此,高浓度VB1对Ca.pseudoreteaudii YA51有抑制作用,最适产孢VB1浓度为 0.4 g·L-1。
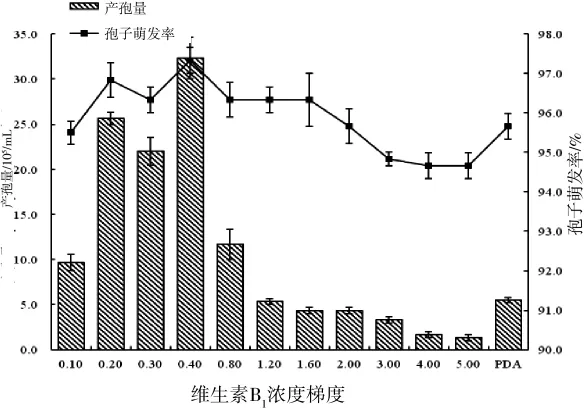
图6 不同维生素B1浓度对Ca.pseudoreteaudii YA51产孢量和孢子萌发率的影响Figure 6 Effects of different vitamin B1’s concentration sporulation and conidia germination of Ca.pseudoreteaudii YA51
3 小结与讨论
Ca.pseudoreteaudii YA51在PDA培养过程中,一般需要10 d才会大量产孢,且产孢量低,无法满足1.00×106个/mL的需求[19-20]。本试验中,在Czapek的基础上添加桉树叶煎汁和VB1可在培养7 d时达到1.00×106个/mL,既节约了时间,又满足试验需求量。
草莓炭疽病菌 (Colletotrichum theobromicola)、葡萄溃疡病菌(Botryosphaeria dothidea)等采用涂断菌丝或者刮伤菌落的方法进而促进产孢[9,21-23],但此类方法不适宜Ca.pseudoreteaudii YA51,本菌株在PDA培养基过程中易被青霉菌(Penicillium)污染,刮伤菌落后再培养,极大的增加了污染率。虽然在PDA基础上添加叶片煎汁等也可达到提高产孢量的作用[24]。但Ca.pseudoreteaudii YA51因营养物质的变化可引起可观的形态改变,我们在培养Ca.pseudoreteaudii YA51中发现,不同批次的PDA中菌落形态也有差异,这是由于不同批次土豆的营养物质含量不同。
为了避免非可控因素,本试验采用主要营养物质成分来源明确的Czapek培养基,通过自主改变其中某种元素进而达到改变菌落形态的目的。添加桉树叶煎汁的目的在于模拟和提供自然环境下菌株的生长环境。本试验结果表明,Czapek+ELA产孢量为1.33×106个/mL,确有提高产孢量的作用,在其基础上再添加VB1可进一步提高产孢量,最高可达3.23×106个/mL。何书婷等2017年发现入侵植物对某些真菌具有抑制作用[25],其中相关研究表明蟛蜞菊不仅可抑制植物生长,也对致病真菌菌的生长和活力具一定影响[26-28]。因福建本省南美蟛蜞菊居多,参照桉树叶煎汁的方式尝试南美蟛蜞菊煎汁,发现可以促进Ca.pseudoreteaudii YA51产孢,此方法原材料丰富,成本廉价,操作简单。
[1]PAULC.Taxonomy and pathology of Cylindrocladium(Calonectria)and allied genera[J].Mycologist,2003,17(3):127-127.
[2]LOMBARD L,CROUS P W,WINGFIELD B D,et al.Species concepts in Calonectria(Cylindrocladium)[J].Studies in Mycology,2010,66(1):1-13.
[3]陈帅飞,刘倩丽,李洁琼,等.中国丽赤壳属Calonectria真菌物种及遗传多样性[J].桉树科技,2015,32(2):34-56.
[4]陈全助,陈慧洁,郭文硕,等.桉树焦枯病菌(Calonectria pseudoreteaudii)生物学特性测定[J].福建林学院学报,2014,34(4):328-332.
[5]RODASCA,LOMBARD L,GRYZENHOUT M,et al.Cylindrocladium blight of Eucalyptus grandis in Colombia[J].Australasian Plant Pathology,2005,34(2):143-149.
[6]CHEN S F,LOMBARD L,ROUX J,et al.Novel species of Calonectria associated with Eucalyptus leaf blight in Southeast China[J].Persoonia.2011,26(1):1-12.
[7]陈全助,郭文硕,叶小真,等.福建省桉树焦枯病菌分类鉴定[J].福建林学院学报,2013,33(2):176-182.
[8]朱建华,郭文硕,陈红梅,等.桉树焦枯病对桉树生长量的损失估计研究[J].中国森林病虫,2011,30(5):6-10.
[9]黄军凯,张国珍.促进草莓炭疽病菌大量产孢的方法[J].植物保护,2014,40(4):107-111.
[10]王拱辰,陈辉珍.促进镰刀菌产孢的培养基[J].植物病理学报,1995(2):165-166.
[11]宋漳,江英成,饶如春.氨基酸维生素对绿僵菌液生分生孢子形成影响[J].福建林学院学报,2000(3):251-254.
[12]张淑红,段晓静,王建伟.氨基酸和维生素对白僵菌生长的影响[J].唐山师范学院学报,2008(2):51-52.
[13]阮元,马进川,薛元,等.维生素B1、B6和生长激素 2,4-D对蛹虫草液体发酵虫草素产量的影响[J].菌物学报,2014,33(2):477-482.
[14]宋漳,周晓妹.维生素对白僵菌生长和液生分生孢子形成的影响[J].福建林学院学报,2010,30(3):198-201.
[15]马璐,林衍铨,江晓凌,等.无机盐、维生素与植物生长调节剂对绣球菌菌丝生长的影响[J].菌物研究,2011,9(3):172-175.
[16]任桂梅,周茂林,毋楠,等.维生素B1对几种担子菌菌丝体生长的影响[J].安徽农业科学,2007(26):8075-8076.
[17]李国清,陈帅飞,吴志华,等.中国桉树焦枯病病原菌物种多样性及致病力初步分析 [J].热带作物学报,2014,35(6):1183-1191.
[18]方中达.植病研究方法(第二卷)[M].北京:中国农业出版社,1998.
[19]韩小路,白静科,张玮,等.PEG介导的苹果果生刺盘孢Colletotrichum fructicola原生质体转化[J].西北农业学报,2016,25(3):442-449.
[20]金丽.农杆菌介导柑橘指状青霉遗传转化体系的优化及其致病机理的初步研究[D].武汉:华中农业大学,2016.
[21]姚晟伟,谢悦,李兴红.葡萄溃疡病病菌(Botryosphaeria dothidea)的诱导产孢方法评价[J].中外葡萄与葡萄酒,2011(9):4-7.
[22]王静,任安芝,谢凤行,等.几种诱导黑麦草 Loliump erenneL.内生真菌产孢的方法[J].菌物学报,2005(4):120-126.
[23]赵红,王彩霞,陈晓忍,等.苹果腐烂病菌诱导产孢方法[J].中国农学通报,2012,28(10):151-154.
[24]陆宁海,徐瑞富,吴利民,等.长蠕孢菌产孢条件的研究[J].微生物学通报,2005(5):77-81.
[25]何书婷,贺锐林,王立,等.5种入侵植物提取物对2种芒果病原真菌的抑制作用[J].热带生物学报,2017,8(1):22-28.
[26]李守婷,周艳,麻兵继,等.蟛蜞菊烯酸钠盐抑制植物病原真菌菌丝生长活性研究 [J].河南农业大学学报,2015,49(5):653-657.
[27]柯展鸿,陈雁飞,惠苗,等.南美蟛蜞菊和蟛蜞菊化感作用的比较研究[J].华南师范大学学报(自然科学版),2014,46(1):83-88.
[28]吴易.南美蟛蜞菊根系分泌物抑制土传致病真菌从而有益于其入侵[A].中国植物学会.生态文明建设中的植物学:现在与未来——中国植物学会第十五届会员代表大会暨八十周年学术年会论文集——第2分会场植物生态与环境保护[C].北京:中国植物学会,2013:1.
