QuEChERS-超高效液相色谱-串联质谱法同时测定畜禽组织中6种黄曲霉毒素和杂色曲霉素
2018-05-29凌阿茹郭文博杨俊花赵志辉郭晋丽
凌阿茹, 郭文博, 杨俊花, 赵志辉, 郭晋丽
(上海市农业科学院农产品质量标准与检测技术研究所, 上海 201403)
黄曲霉毒素(aflatoxins, AFTs)是由寄生曲霉菌(aspergillusparasiticus)和黄曲霉菌(aspergillusflavus)等在适宜的温度、湿度条件下产生的次级代谢产物,普遍存在于花生、玉米、小麦等谷物和粮油产品中[1]。至今已鉴定到的AFTs有20多种,其中关于黄曲霉毒素B1(AFB1)、黄曲霉毒素B2(AFB2)、黄曲霉毒素G1(AFG1)、黄曲霉毒素G2(AFG2)及其代谢产物黄曲霉毒素M1(AFM1)、黄曲霉毒素M2(AFM2)的研究较多,以上AFTs均含有双呋喃环和致癌性结构氧杂萘邻酮[2]。杂色曲霉素(sterigmatocystin, SMC)是曲霉菌生物合成AFB1、AFG1等的前体物质,结构与AFTs极为相似,常协同污染谷物及粮油产品[3]。近年来多有研究[4,5]指出,真菌毒素中黄曲霉毒素的毒性最强,动物或人摄入较大剂量易引起急性中毒、肝炎、出血性坏死、肝细胞脂肪变性等,而持续微量摄入可造成慢性中毒,致癌、致畸及致突变等,严重时能引起肝硬化坏死、癌变甚至死亡[6,7]。1993年世界卫生组织(WHO)癌症研究机构将黄曲霉毒素列为Ⅰ级致癌物。此外也有研究表明,杂色曲霉素也具有肾脏和肝脏毒性,会造成动物肝细胞和肾小管上皮细胞坏死、肝硬化、中毒性肝炎等[8]。畜禽摄入被黄曲霉毒素或者杂色曲霉素污染的谷物饲料,不仅影响健康,还极易在动物源性产品(肉、奶、动物肝脏)中蓄积残留,严重威胁人类健康。因此,建立一种灵敏、简便、快速检测黄曲霉毒素和杂色曲霉素残留的分析方法非常必要。
动物源性组织中黄曲霉毒素的检测手段主要有高效液相色谱法(HPLC)、薄层色谱法(TLC)、酶联免疫吸附法(ELISA)和液相色谱-串联质谱法(LC-MS/MS)等[9-16]。史莹华等[9]采用免疫亲和柱净化,反相高效液相色谱法测定动物组织中AFB1、AFB2、AFG1和AFG2,该方法净化、衍生步骤复杂,前处理过程耗时,灵敏度低;薄层色谱法分析步骤复杂,不适宜大批量样品的检测[10];基于单克隆抗体或多克隆抗体的ELISA检测对象单一,容易出现假阳性结果[11]。目前,液相色谱-串联质谱法已广泛用于饲料、血浆、谷物、牛奶等不同基质中黄曲霉毒素的分析检测[12-15],其灵敏度高,检测限低,确证和定量分析准确。孙雪等[16]建立了LC-MS/MS检测猪肉、鱼肉和猪肝中AFB1、AFB2、AFG1、AFG2、AFM1和AFM2的方法,该方法采用免疫亲和柱净化,需大批量的样本筛查和安全监测,成本较高。因此,本研究在此基础上,选用经济、简单、快速、高效的QuEChERS前处理技术[17],结合超高效液相色谱-串联质谱法(UHPLC-MS/MS),同时增加污染频率较高、毒性仅次于AFTs的杂色曲霉素进行分析,旨在为动物源性产品中黄曲霉毒素和杂色曲霉素的安全监管提供便捷、高效、广泛的技术支持。
1 实验部分
1.1 仪器、试剂和材料
ACQUITY UPLC I-Class超高效液相色谱仪(美国Waters公司); TRIPLE QUAD 5500型三重四极杆质谱仪(美国AB Sciex公司); Sorvall ST 16R型高速冷冻离心机(美国Thermo Fisher公司); DC-24型氮气吹干仪、2500 TH型超声波清洗机(上海安普实验科技股份有限公司); DMT-2500型多管式旋涡混匀仪(上海豫明仪器有限公司)。
AFB1、AFB2、AFG1、AFG2、AFM1、AFM2和SMC标准品(纯度≥99%, Romer国际贸易(北京)有限公司);β-葡萄糖苷酶(3 000 U/mg,上海泰坦科技股份有限公司)、甲醇、乙腈、乙酸铵和甲酸(色谱纯,美国Merck公司);氯化钠、无水硫酸镁(上海埃彼化学试剂有限公司);正己烷(上海安谱科学仪器有限公司); 0.22 μm有机系滤膜(天津市津腾实验设备有限公司);实验用猪肉、猪肝、鸡肉样本均购自上海各超市及农贸市场。
1.2 溶液配制
称取AFB1、AFB2、AFG1、AFG2、AFM1、AFM2和SMC标准品各1 mg,分别置于100 mL棕色容量瓶中,用乙腈配制成10 mg/L的标准储备液,于-20 ℃避光保存;准确量取AFB1、AFB2、AFG1、AFG2、AFM1、AFM2和SMC标准储备液各100 μL,分别置于10 mL棕色容量瓶中,用乙腈定容,配制成1 mg/L混合标准工作液,于-20 ℃避光保存。
取适量混合标准工作液,用5 mmol/L乙酸铵水溶液-乙腈(80∶20, v/v)进行稀释,配制成质量浓度为0.1、1、5、10、20、50、100 μg/L的系列溶剂标准溶液;分别量取适量混合标准工作液,加入猪肉、猪肝、鸡肉组织的空白提取液进行稀释,配制成质量浓度为0.1、1、5、10、20、50、100 μg/L的系列基质标准溶液。
称取β-葡萄糖苷酶5 mg,用1 mL磷酸盐缓冲液(PBS)配制成5 g/L(15 000 U/mL)β-葡萄糖苷酶缓冲液;称取0.197 2 g乙酸铵冰晶,用500 mL超纯水配制成5 mmol/L乙酸铵溶液。
1.3 实验条件
1.3.1样品前处理
将猪肉、鸡肉和猪肝脏样品分别绞至匀浆状,分装好后于-20 ℃保存,测定前于4 ℃解冻。
准确称取(2.00±0.05) g样品,置于50 mL离心管中,加入20 μLβ-葡萄糖苷酶缓冲液和1.6 mL水,涡旋混匀,于37 ℃酶解12 h,加入8.4 mL乙腈,涡旋均匀,于40 ℃超声40 min,然后以2 000 r/min涡旋30 min,再分别加入NaCl 1.0 g和无水MgSO41.0 g,最后加入5 mL正己烷脱脂,涡旋均匀,以5 000 r/min离心10 min,取5 mL中层清液于10 mL离心管中,于40 ℃水浴氮气吹干;加入1 mL 5 mmol/L乙酸铵水溶液-乙腈(80∶20, v/v)复溶,过0.22 μm有机系滤膜,待上机检测。
1.3.2液相色谱条件
色谱柱:Agilent Poroshell 120 EC-C18柱(100 mm×3.0 mm, 2.7 μm);柱温:40 ℃;进样室温度:25 ℃;流动相A:甲醇;流动相B: 5 mmol/L乙酸铵溶液;流速:0.4 mL/min。梯度洗脱程序:0~1.0 min, 10%A; 1.0~6.0 min, 10%A~90%A; 6.0~6.5 min, 90%A; 6.5~6.7 min, 90%A~10%A; 6.7~8.0 min, 10%A。进样体积:5 μL。
1.3.3质谱条件
离子化模式:电喷雾正离子模式(ESI+);质谱扫描模式:多反应监测(MRM)模式;离子源温度:150 ℃;扫描范围(m/z): 100~800;各离子对驻留时间:100 ms;毛细管电压:2.5 kv;锥孔电压:25 v;干燥气温度:500 ℃;干燥气流速:1 000 L/h。其他质谱参数见表1。
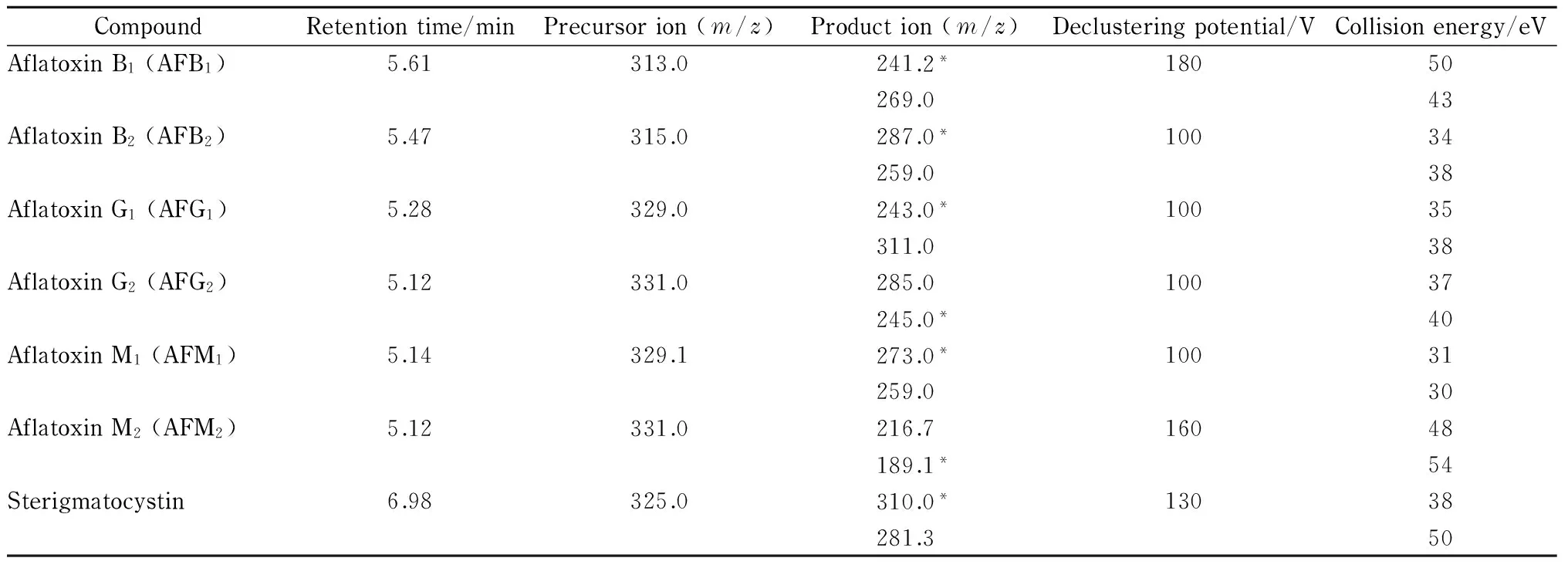
表 1 6种黄曲霉毒素和杂色曲霉素在多反应监测模式下的质谱参数
*Quantitative ion.
2 结果与讨论
2.1 样品前处理条件的优化
2.1.1提取溶剂的优化
6种黄曲霉毒素的化学结构相似,易溶于醇类、丙酮、氯仿等有机溶剂,难溶于水和正己烷等[4]。常见的提取溶剂有乙腈-水、乙腈-乙酸-水、甲醇-水、氯仿等,且混合提取溶剂的比例不同提取结果也存在差异。本实验对添加了50 μL 1 mg/L混合标准工作液的猪肉样品(即添加水平25 μg/kg)进行前处理,比较乙腈-水(84∶16, v/v)、乙腈-水(90∶10, v/v)、乙腈-水(50∶50, v/v)、乙腈-水-乙酸(79∶20∶1, v/v/v)4种不同提取溶剂对6种黄曲霉毒素和杂色曲霉素回收率的影响,结果见图1。不同提取溶剂对6种黄曲霉毒素和杂色曲霉素的回收率存在显著差异(p<0.05),当乙腈和水的体积比为84∶16时,6种黄曲霉毒素和杂色曲霉素的回收率均最高,为97.6%~118.5%。同时对鸡肉和猪肝样品进行考察也获得了相同的结果。因此本实验选用乙腈-水(84∶16, v/v)进行提取。
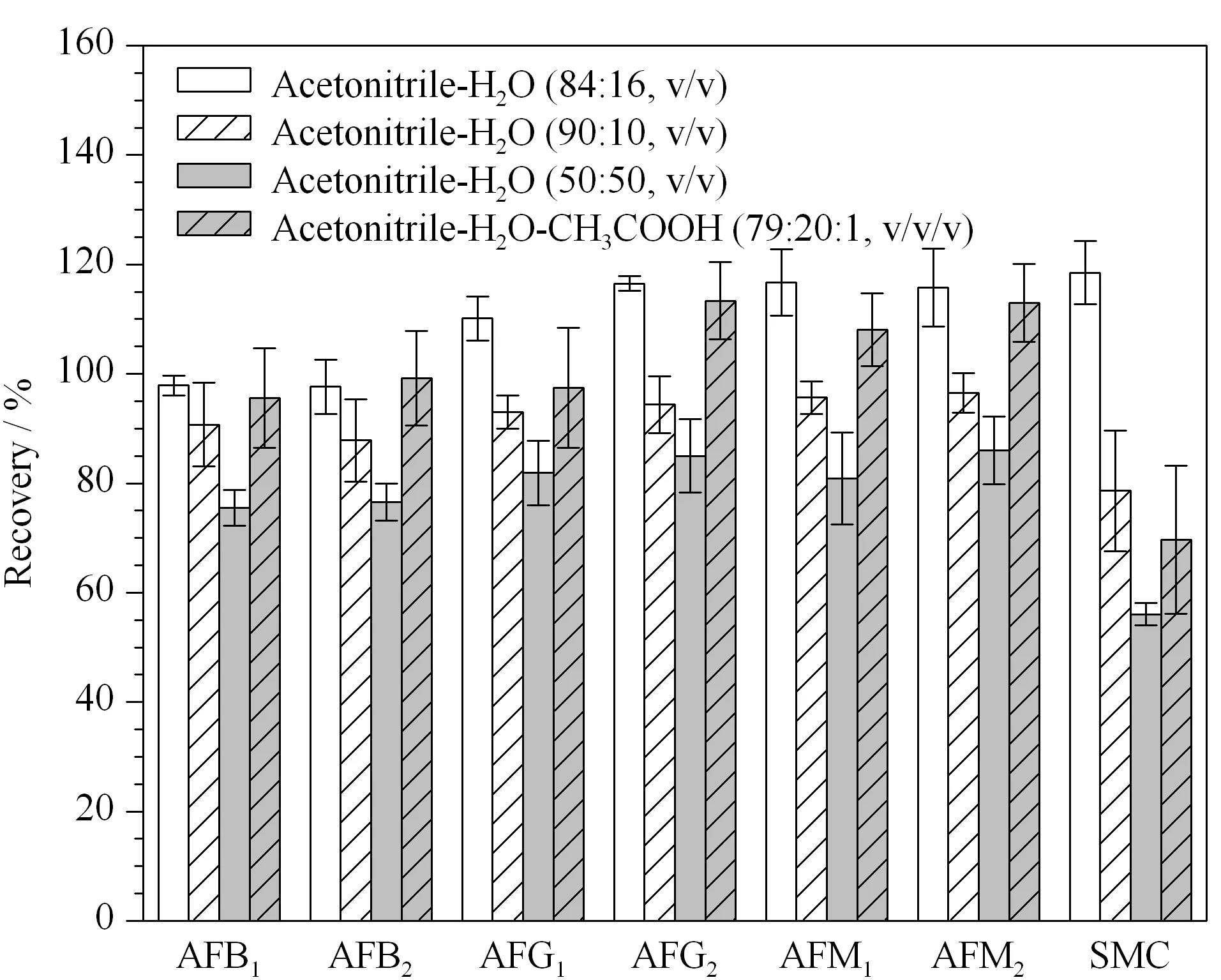
图 1 不同提取溶剂对6种黄曲霉毒素和杂色曲霉素回收率的影响(n=3)Fig. 1 Influence of different extract solvents on the recoveries of the six AFTs and SMC (n=3)
2.1.2酶的选择
Mabee和Chipley[18]通过观察鸡肉体内14C-AFB1的组织分布与代谢途径发现14C-AFB1的代谢产物14C-AFM1在鸡肉组织中与葡萄糖苷酸以共轭物的形式存在,并且检测结果显示,经β-葡萄糖苷酶酶解后的样品中有31.5%的14C都来源于该共轭物所释放的葡萄糖苷酸缀合物。曹晓琴[4]先利用β-葡萄糖苷酶酶解猪、牛、羊的肌肉、肝脏、肾脏和脂肪组织,再对黄曲霉毒素进行提取检测,其回收率较高。因此,本实验最终选择β-葡萄糖苷酶对畜禽组织进行酶解。分别制备加标猪肉、猪肝、鸡肉样品(25 μg/kg),各加标样品酶解前后的提取效果见图2。由图2可知,3种加标样品在经β-葡萄糖苷酶酶解后6种黄曲霉毒素和杂色曲霉素的回收率均高于未酶解的样品。表明酶解有助于6种黄曲霉毒素和杂色曲霉素的游离,使结果更准确,同时研究发现酶解使复溶液更容易过滤,上机样品也更澄清。
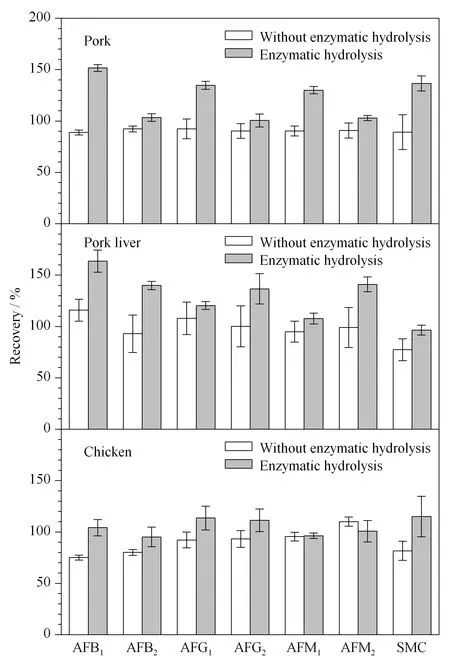
图 2 酶解前后不同加标样品中6种黄曲霉毒素和杂色曲霉素的回收率(n=3)Fig. 2 Recoveries of the six AFTs and SMC in different spiked samples with and without enzymatic hydrolysis (n=3)
2.2 色谱条件的优化
为了使结构类似的黄曲霉毒素和杂色曲霉素能够有效分离,本研究选用分离性能较好的Agilent Poroshell 120 EC-C18色谱柱(100 mm×3.0 mm, 2.7 μm),并比较了在不同流动相(乙腈-水、甲醇-0.1%(v/v)甲酸水溶液、甲醇-0.1%(v/v)乙酸水溶液和甲醇-5 mmol/L乙酸铵溶液)和不同洗脱梯度条件下各黄曲霉毒素和杂色曲霉素的响应值和峰形。结果显示,在水相中加入5 mmol/L乙酸铵时6种黄曲霉毒素和杂色曲霉素的响应值较高,分离度好,峰形尖锐。因此最终选择甲醇和5 mmol/L乙酸铵溶液作为流动相。
2.3 质谱条件的优化
实验通过直接进样方式对质谱条件进行优化。由于黄曲霉毒素和杂色曲霉素属于中等极性物质,所以采用电喷雾离子源进行离子化,并且在正离子模式下进行母离子全扫描。结果表明,黄曲霉毒素和杂色曲霉素均生成[M+H]+基峰离子,以此为母离子进行子离子扫描。通过两者之间信号强度的比较,优化母离子、定量子离子、去簇电压、碰撞电压等质谱参数,得到优化后的最佳质谱参数。
2.4 基质效应的考察
畜禽组织成分复杂,含有许多蛋白质等大分子化合物,极易对质谱离子化产生影响。为了保证实验的准确性,分别建立溶剂标准曲线和基质标准曲线,考察猪肉、猪肝、鸡肉不同基质对提取效果的影响。本实验分别制备了3种样品的空白基质溶液,用于基质效应的考察和方法学验证。对质量浓度为0.1、1、5、10、20、50、100 μg/L的系列溶剂标准溶液和基质标准溶液依次进行测定,以质量浓度为横坐标、相应的峰面积为纵坐标绘制溶剂标准曲线和基质标准曲线。根据Matuszewski等[19]的描述,用信号增强或抑制的程度(SSE)来评价基质效应,计算公式如下:
SSE=(S1/S2)×100% (1)
y: peak area;x: mass concentration, μg/L.
其中,S1和S2分别表示样品基质和溶剂标准曲线的斜率。SSE值的正常范围为80%~120%,当其高于120%时显示信号增强效应,当其低于80%时显示信号抑制效应[20]。不同畜禽组织对6种黄曲霉毒素和杂色曲霉素提取效果的干扰情况见表2。
由表2可知,猪肉基质对AFB2和AFM2有一定的抑制作用,其他4种黄曲霉毒素和杂色曲霉素的SSE值均在80%~120%之间;猪肝和鸡肉基质对部分毒素有一定的干扰效应,其SSE值>120%或<80%。因此,为了保证检测结果的准确性,选择基质匹配标准曲线进行定量分析。

表 2 不同畜禽组织中6种黄曲霉毒素和杂色曲霉素的基质效应
2.5 方法学验证
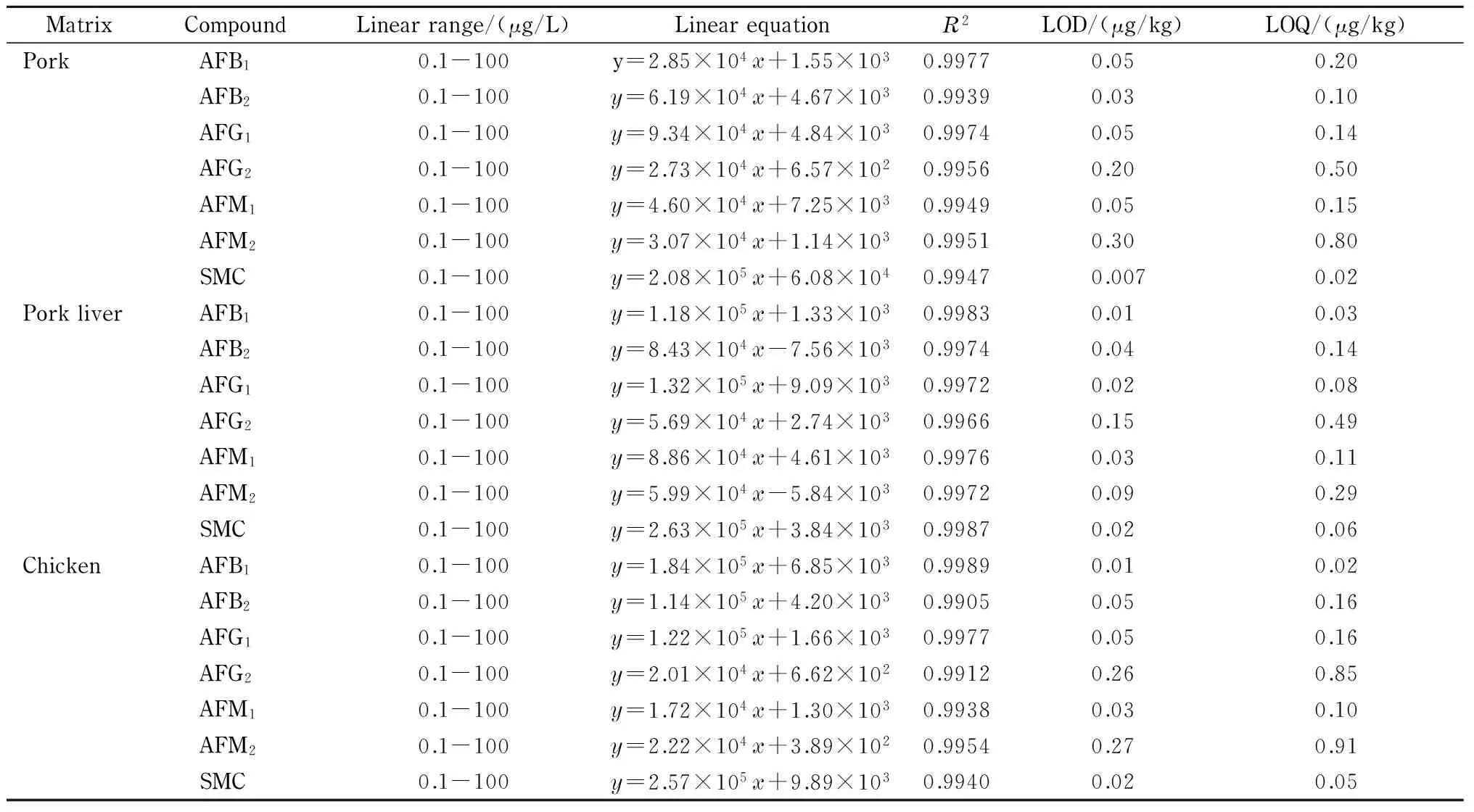
2.5.1线性关系、检出限和定量限
对质量浓度为0.1、1、5、10、20、50、100 μg/L的系列基质标准溶液进行分析,建立基质标准曲线(见表3)。分别根据定性离子通道中信噪比(S/N)=3和定量离子通道中S/N=10计算方法的检出限(LOD)和定量限(LOQ),结果见表3。
由表3可知,不同基质标准溶液中6种黄曲霉毒素和杂色曲霉素在线性范围0.1~100 μg/L内,相关系数均>0.99,参考2002/657/EC标准,说明本方法线性关系良好。猪肉、猪肝、鸡肉基质标准溶液中黄曲霉毒素及杂色曲霉素的检出限分别为0.007~0.30、0.01~0.15和0.01~0.27 μg/kg,定量限分别为0.02~0.80、0.03~0.49和0.02~0.91 μg/kg,说明本方法灵敏度高,可用于不同畜禽样品的定性和定量分析。
2.5.2回收率
称取(2.00±0.05) g空白样品,分别加入2、10和50 μL 1 mg/L混合标准溶液(即加标水平分别为1、5和25 μg/kg),每个水平做6个平行样品,静置10 min,依次对样品进行提取处理和色谱-质谱分析。根据检测结果计算回收率和相对标准偏差(RSD),结果见表4。在3个添加水平下,3种不同基质中6种黄曲霉毒素和杂色曲霉素的回收率为77.3%~118.5%,相对标准偏差(RSD)为1.5%~19.9%。
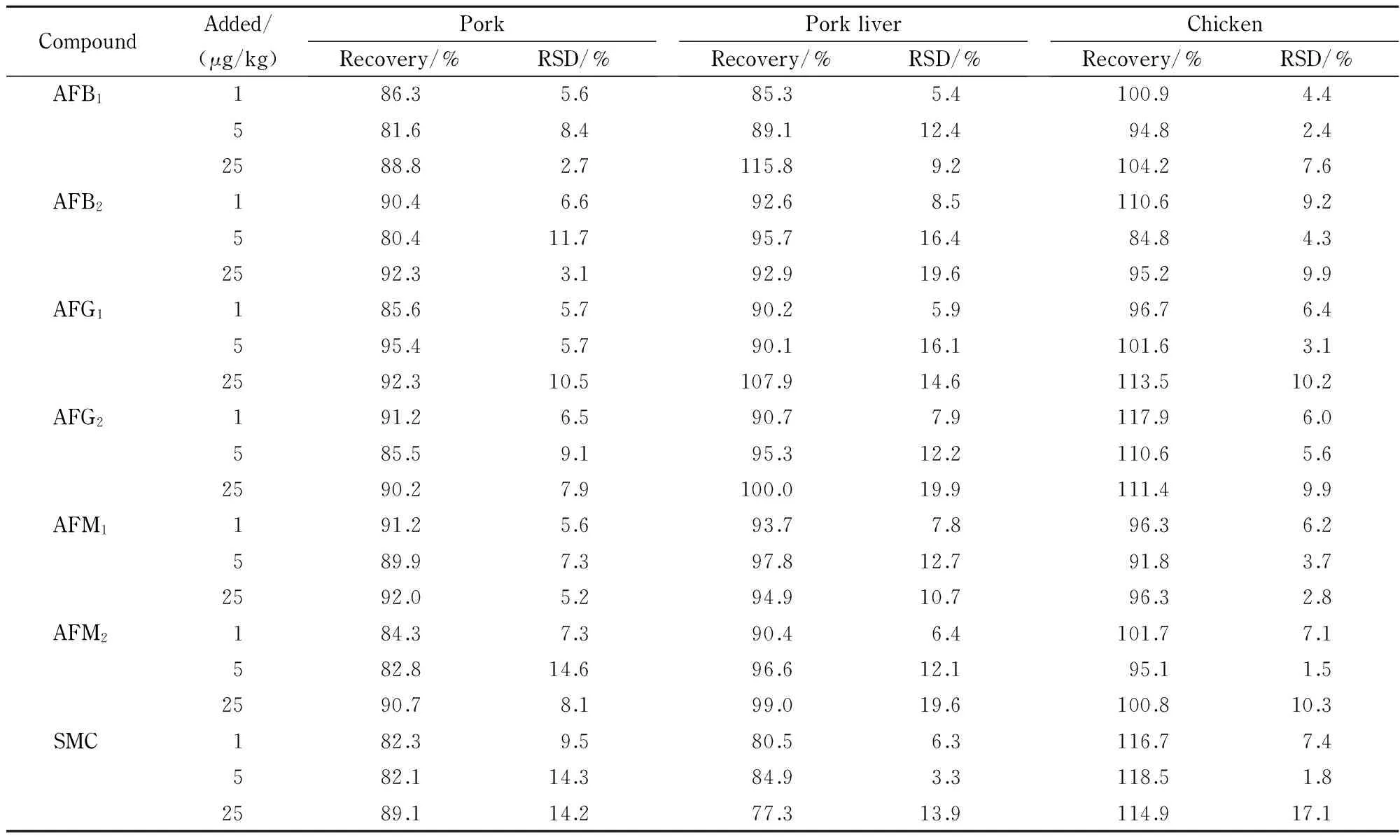
表 4 猪肉、猪肝和鸡肉样品中6种黄曲霉毒素和杂色曲霉素的回收率和精密度(n=6)
2.6 实际样品分析
通过本文建立的UHPLC-MS/MS方法对从各超市及大型农贸批发市场采购的127份样品(1~33号为猪肉样品、34~54号为猪肝样品、55~127号为鸡肉样品)中6种黄曲霉毒素和杂色曲霉素进行定量分析。127份样品中有10份检出黄曲霉毒素或杂色曲霉素,其中杂色曲霉素SMC的检出率最高,污染率为7.08%,含量为0.118~0.798 μg/kg; AFM1和AFM2未检出;其中只有27号猪肉样品同时检出了AFB1、AFB2、AFG1、AFG2和SMC,含量为0.118~0.458 μg/kg,表明畜禽产品中黄曲霉毒素和杂色曲霉素的残留量较低,其中主要以SMC残留为主。
3 结论
本文建立了以QuEChERS前处理技术为基础同时测定畜禽组织中6种黄曲霉毒素和杂色曲霉素的UHPLC-MS/MS定量分析方法。方法操作简单,灵敏度高,准确性好,稳定可靠,适用于畜禽组织中黄曲霉毒素和杂色曲霉素的确证和定量分析,同时可为建立检测畜禽组织中黄曲霉毒素和杂色曲霉素的国家标准方法和畜禽产品当中真菌毒素的风险监控提供参考。
:
[1] Li S H, Ren D D, Xie Y F, et al. Journal of Food Safety & Quality, 2015, 6(4): 1107
李少晖, 任丹丹, 谢云峰, 等. 食品安全质量检测学报, 2015, 6(4): 1107
[2] Li K, Liang Z H, Zeng S B, et al. Chinese Journal of Food Hygiene, 2016, 28(3): 310
李可, 梁肇海, 曾胜波, 等. 中国食品卫生杂志, 2016, 28(3): 310
[3] Luo Z S, Qin Y, Xu Y Q, et al. Food Science, 2015, 36(3): 250
罗自生, 秦雨, 徐艳群, 等. 食品科学, 2015, 36(3): 250
[4] Cao X Q. [MS Dissertation]. Wuhan: Huazhong Agricultural University, 2010
曹晓琴. [硕士学位论文]. 武汉: 华中农业大学, 2010
[5] Zhang M L, Ju H Q. China Food Safety Magazine, 2016(9): 30
张美玲, 鞠恒强. 食品安全导刊, 2016(9): 30
[6] Chen X Y, Xie L, Li S, et al. Guangdong Medical Journal, 2010, 31(16): 2066
陈晓燕, 谢丽, 李山, 等. 广东医学, 2010, 31(16): 2066
[7] Huang L H, Hu C J, Tang C X, et al. Livestock and Poultry Industry, 2013(10): 26
黄禄华, 胡昌金, 唐臣学, 等. 畜禽业, 2013(10): 26
[8] Zhao Y R, Liu X X, Zhao J, et al. Chinese Journal of Food Hygiene, 2016, 28(5): 680
赵亚荣, 刘香香, 赵洁, 等. 中国食品卫生杂志, 2016, 28(5): 680
[9] Shi Y H, Xu Z R, Feng J L, et al. Chinese Journal of Analytical Chemistry, 2005, 33(6): 850
史莹华, 许梓荣, 冯建蕾, 等. 分析化学, 2005, 33(6): 850
[10] Zhang P, Zhao W D, Zhang Y B. Chinese Journal of Analytical Chemistry, 2000, 28(3): 392
张鹏, 赵卫东, 张艺兵. 分析化学, 2000, 28(3): 392
[11] Lu X X, Xie H J, Song W, et al. Food Engineering, 2017(2): 58
卢晓霞, 谢海军, 宋崴, 等. 食品工程, 2017(2): 58
[12] Fan Z Y, Liu Q S, Shi D D. Modern Scientific Instruments, 2016(1): 81
范志影, 刘庆生, 石冬冬. 现代科学仪器, 2016(1): 81
[13] Wang R G, Su X O, Wang P L, et al. Chinese Journal of Analytical Chemistry, 2017, 45(2): 231
王瑞国, 苏晓鸥, 王培龙, 等. 分析化学, 2017, 45(2): 231
[14] Chen H F, Yu H F, Qin S Q, et al. Cereals & Oils, 2017, 30(2): 97
陈慧菲, 郁海菲, 秦施奇, 等. 粮食与油脂, 2017, 30(2): 97
[15] Liu Y, Zhou X, Liu X G, et al. Chinese Journal of Food Hygiene, 2016, 28(5): 613
刘颖, 周鑫, 刘晓光, 等. 中国食品卫生杂志, 2016, 28(5): 613
[16] Sun X, Xi C X, Tang B B. Chinese Journal of Analytical Chemistry, 2016, 44(6): 970
孙雪, 郗存显, 唐柏彬. 分析化学, 2016, 44(6): 970
[17] Anastassiades M, Lehotay S J, Stajnbaher D, et al. J AOAC Int, 2003, 86(2): 412
[18] Mabee M S, Chipley J R. Appl Microbiol, 1973, 25(5): 763
[19] Matuszewski B K, Constanzer M L, Chavez-Eng C M. Anal Chem, 2003, 75(13): 3019
[20] Sun W S. [MS Dissertation]. Shanghai: Shanghai Ocean University, 2015
孙文烁. [硕士学位论文]. 上海: 上海海洋大学, 2015
