组织蛋白酶S对犬颈动脉支架置入后再狭窄的影响及法舒地尔对其干预的研究
2018-05-21黄惠英郭富强
黄惠英, 郑 辉, 杨 树, 刘 丹, 郭富强
近年来,颈动脉支架成形术(carotidartery angioplasty and stenting,CAS)已广泛应用于颈动脉狭窄治疗。同时,人们也认同颈动脉支架成形术治疗颈动脉狭窄的安全性和有效性[1]。但是,颈动脉支架成形术术后6 m内有约20%~30%患者出现血管内再狭窄,远期观察血管内再狭窄机率更高。有研究表明血管成形术后血管再狭窄多好发于术后3~6 m,严重影响该手术方式远期疗效[2]。
新生内膜形成在血管成形术后再狭窄的形成过程中起着重要作用[2],而VSMCs(血管平滑肌细胞vascular smooth muscle cells,VSMCs)从中膜向内膜迁移是新生内膜形成的一个关键原因。在VSMCs迁移的过程中,细胞通过表达包括基质金属蛋白酶、组织蛋白酶等多种蛋白酶降解和破坏细胞外基质(extracellular matrix ECM)和内弹力板,从而实现细胞迁移[3]。已有细胞培养实验表明组织蛋白酶主要由单核细胞来源的巨噬细胞和活化的平滑肌细胞分泌[4];降解弹性组织的活性主要依赖于组织蛋白酶,这些实验还表明组织蛋白酶在平滑肌细胞、内皮细胞和巨噬细胞的粘附、增殖和迁移过程中都发挥了重要作用,而这些过程都发生在血管成形术后血管重塑过程中,阻滞这些酶的表达可能降低ECM的降解和积聚,从而降低血管成形术后再狭窄形成的程度和进程。组织蛋白酶能分解弹力蛋白,在动脉粥样硬化及其斑块不稳定性中的作用目前已经成为研究热点,然而在血管成形术后再狭窄血管重塑中的作用尚不清楚。组织蛋白酶S (Cathepsin S,CatS)能促进细胞外基质多种成分降解[5],具有显著的弹力纤维和胶原纤维水解活性,可以长时间在中性条件下保持蛋白水解活性,并参与各种生理病理过程。因此,Cat S具有在细胞内外发挥更大生理功能潜力[6]。已有研究表明[7,8],在大鼠颈动脉球囊损伤和兔颈动脉球囊损伤加高脂饮食饲养后,血管壁Cat S明显表达。这些研究提示Cat S在新生内膜形成中发挥重要作用。但是,血管成形术后再狭窄中研究很少,特别是支架置入术后再狭窄研究,目前国内外尚未有相关报道。
Cat S及其抑制剂在AS中的作用已广泛受到人们关注。Matsumoto等[9]首先报道了Rho激酶在再狭窄和Rho激酶抑制剂法舒地尔在防治再狭窄中的潜在效果,该研究表明在支架置入术后28 d,法舒地尔能显著抑制支架置入部位巨噬细胞聚集、胶原蛋白沉积。有研究表明[4],Cat S主要由单核细胞来源的巨噬细胞和活化的平滑肌细胞分泌,法舒地尔是否可以通过抑制Cat S的表达,从而抑制新生内膜的形成,目前国内外尚未见相关研究。
1 材料和方法
1.1 实验材料 雄性比格犬12只,硫酸氢氯吡格雷片、盐酸法舒地尔注射液等。
1.2 实验方法 雄性比格犬12只,随机分为A组(假手术组n=4,经前期假手术处理),B组(裸支架组n=4,经前期颈动脉粥样硬化狭窄造模),C组(裸支架+fasudil组n=4,经前期颈动脉粥样硬化狭窄造模)。在支架置入术前24 h及支架置入术后1 w喂食阿司匹林肠溶片300 mg/d,氯吡格雷片25 mg/d,之后改为喂食阿司匹林肠溶片100 mg/d,氯吡格雷片25 mg/(d·只),直至取血管标本。所有实验比格犬在造模后高脂饮食喂养2 m后进行造影检查,并将8枚金属裸支架置入B组和C组的比格犬颈总动脉最狭窄处。 C组在支架置入后2 h开始给予静脉输注法舒地尔,共7 d,其余组均给予同等剂量的生理盐水静脉滴注。在支架置入后7 d,2 m时对A组、B组和C组比格犬进行颈动脉彩超检查,了解颈动脉狭窄程度及支架置入后颈动脉情况。最后取血管标本进行结果分析。
1.3 颈动脉的结果分析 将取出的血管行石蜡包埋,显微镜下观察,新生内膜组织完整者可作为分析对象。通过HE染色和弹力纤维染色病理形态学,分析了解颈动脉支架置入后再狭窄情况;RT-PCR检测比格犬颈动脉中CatS mRNA表达情况;免疫组化观察血管中α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)和增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)表达情况;通过彩超与DSA检测血管的内径和斑块情况,了解血管的狭窄情况和支架的安置情况。
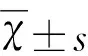
2 结 果
2.1 DSA数据分析 支架置入术前DSA显示,B组和C组管腔狭窄率显著高于A组(P<0.05),B组狭窄率和C组相似(P>0.05)。支架置入后2 mDSA示A组管腔光滑,无狭窄形成,B组狭窄率显著大于C组(P<0.05)(见图1,表1)。
2.2 比格犬颈动脉组织形态学的变化
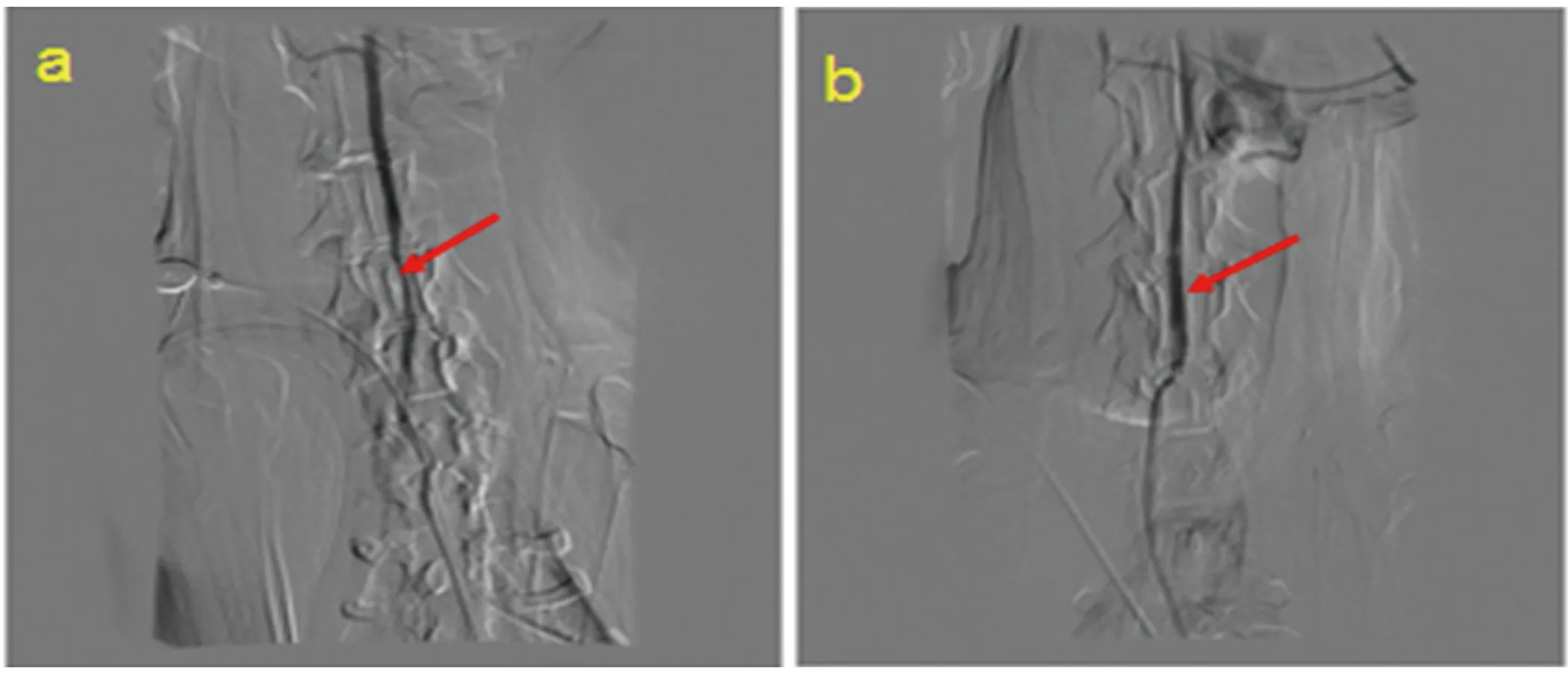
2.2.1 HE染色 光镜下A组(假手术组)比格犬颈动脉中膜由3~5层环行排列的弹性膜和平滑肌细胞组成,外膜由结缔组织组成,内弹力膜呈波浪状,内膜仅内衬单层内皮细胞,无新生内膜形成。与假手术组相比,B组、C组中膜平滑肌细胞层稍紊乱,内膜增生明显,新生内膜内可见平滑肌细胞(见图2)。
2.2.2 弹力纤维染色结果分析 A组血管无新生内膜形成,B、C组血管见大量新生内膜形成,B组新生内膜厚度、面积、狭窄率均大于C组,差异有统计学意义(见表2)。结合HE染色结果,可以看出新生内膜中细胞的成分较少,主要为细胞外基质成分(见图3、表2)。
2.3 比格犬颈动脉支架置入后2 m时Cat S mRNA的表达的比较 支架置入后2 m时颈动脉RT-PCR示Cat S mRNA在A组中有少量表达,而在B组和C组中表达水平明显升高,且和A组相比,差异均有统计学意义,B组和C组比较,B组Cat S mRNA表达水平明显高于C组,差异有显著统计学意义(见图4)。
2.4 免疫组化结果分析
2.4.1 颈动脉α-SMA的免疫组化表现 A组表现为中膜α-SMA染色阳性较多,无新生内膜形成。 B、C组中膜中膜和新生内膜上均可见α-SMA染色阳性的平滑肌细胞,表明平滑肌细胞突破基底膜,迁移到内弹力膜外增殖,是新生内膜的主要组成细胞(见图5)。α-SMA新生内膜平均光密度值检测结果示:B组新生内膜中α-SMA平均光密度值高于C组,差异有统计学意义(见表3)。
2.4.2 颈动脉PCNA的免疫组化表现 A组PCNA免疫组化阳性染色颗粒表达偶见于血管外膜,中膜表达较少。B、C组在支架周围及新生内膜中PCNA阳性表达较多(见图5)。新生内膜PCNA平均光密度值结果显示B组新生内膜上PCNA高于C组,差异有统计学意义。
2.5 统计学处理 采用Pearson相关系数对各指标的相关性进行分析,Cat S mRNA与α-SMA、PCNA、内膜厚度呈正相关。
a:支架置入术前DSA示管腔明显狭窄;b:支架置入术后10 min DSA示狭窄解除
图1 支架置入前后DSA检查结果

注:I:代表内膜;M:代表中膜。a:A组血管未见新生内膜形成;b:B组血管见新生内膜形成;c:C组血管见新生内膜形成
图2 各组支架置入后2 m血管HE染色(×40倍)
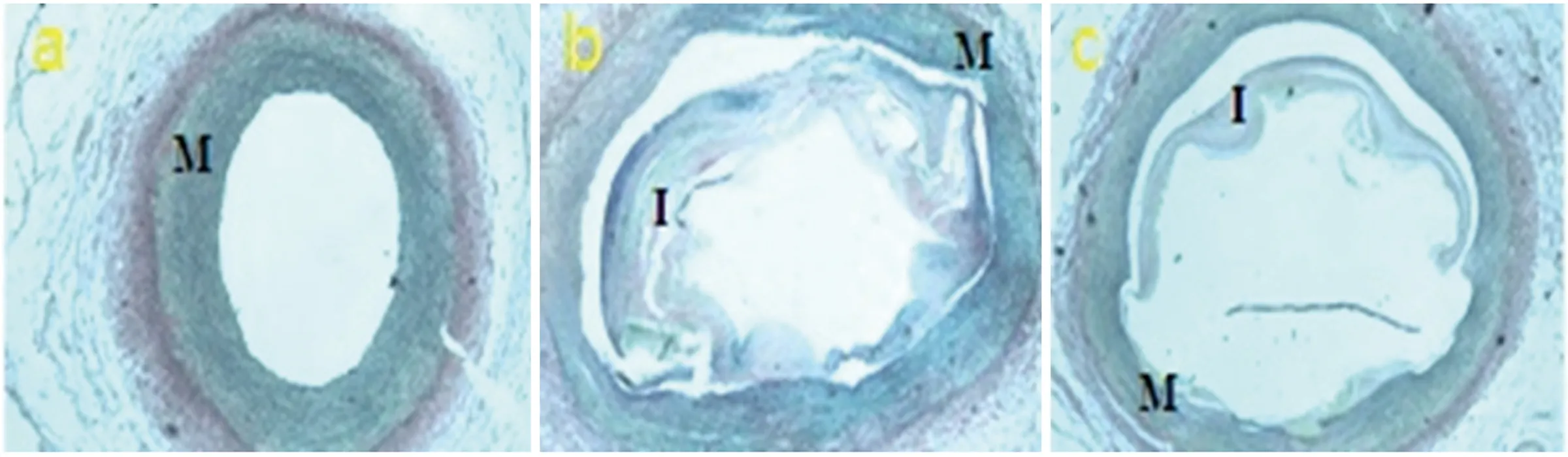
注:I:代表内膜;M:代表中膜 标尺为100 μm。a:A组血管未见新生内膜形成;b:B组血管见新生内膜形成;c:C组血管见新生内膜形成
图3 各组支架置入后血管2 m弹力纤维染色(×40倍)
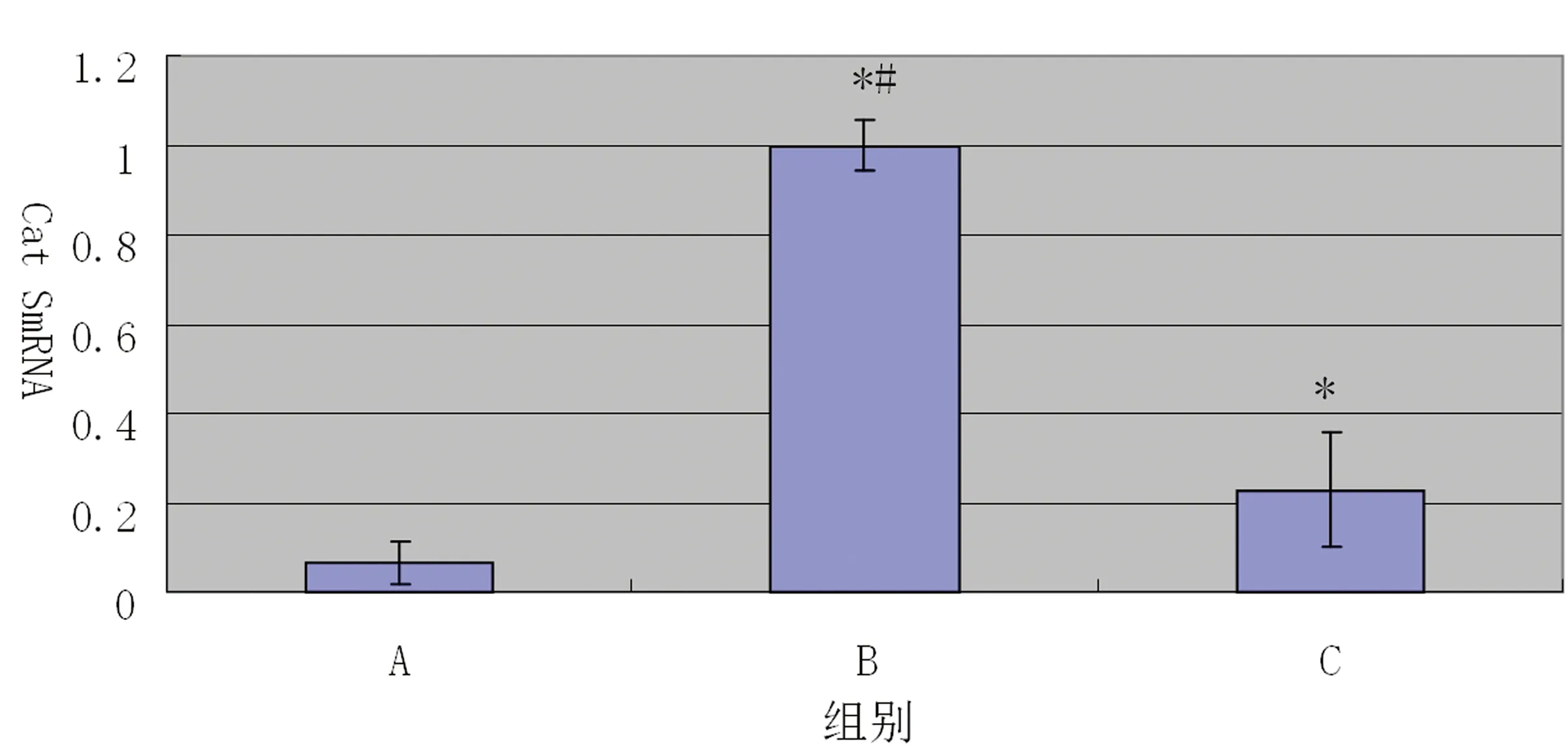
注:A组代表假手术组,B组代表裸支架组,C组代表裸支架+fasudil组。A组相比*P<0.05;与C组相比#P<0.05。
图4:各组支架置入后2 m比格犬颈动脉Cat S mRNA值

注:I:代表内膜;M:代表中膜。a:A组可见中膜α-SMA染色阳性;b:B组中膜和内膜上可见α-SMA染色阳性;c:C组中膜和内膜上可见α-SMA染色阳性;d:A组中膜上未见PCNA染色阳性;e:B组内膜上可见PCNA染色阳性;f:C组内膜上可见PCNA染色阳性

图5 支架置入2 m后血管α-SMA和PCNA免疫组化(×200倍)
注:A组代表假手术组,B组代表裸支架组,C组代表裸支架+fasudil组。*代表P值A组VS B组,#代表P值A组 VS C组,&代表P值B组 VS C组。P<0.05为差异有统计学意义

表2 支架置入后2 m病理形态学分析
注:A组代表假手术组,B组代表裸支架组,C组代表裸支架+fasudil组。*代表P值A组 VS B组,#代表P值A组 VS C组,&代表P值B组 VS C组。P<0.05为差异有统计学意义。标尺为100 μm

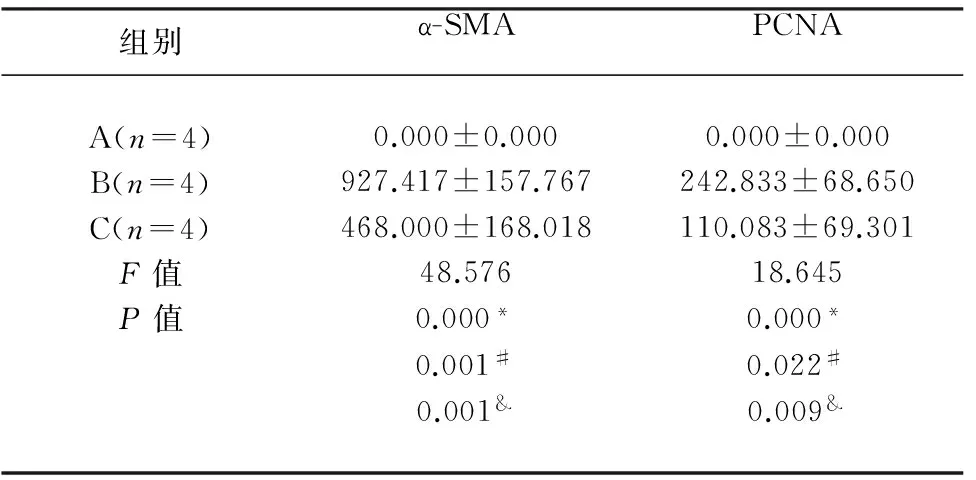
组别α-SMAPCNAA(n=4)B(n=4)C(n=4)F值P值0.000±0.000927.417±157.767468.000±168.01848.5760.000*0.001#0.001&0.000±0.000242.833±68.650110.083±69.30118.6450.000*0.022#0.009&
注:A组代表假手术组,B组代表裸支架组,C组代表裸支架+fasudil组。*代表P值A组VS B组,#代表P值A组VS C组,&代表P值B组VS C组。P<0.05为差异有统计学意义
3 讨 论
目前,对支架置入后再狭窄的动物实验研究,大多是以血管球囊损伤术为基础,支架与血管中层直接接触[10],而在人类患者中支架则与动脉粥样硬化斑块直接接触。因此,既往动物实验研究不能很好的模拟临床中支架置入术后再狭窄病理生理变化过程。本实验通过对比格犬进行颈总动脉粥样硬化狭窄造模后置入支架,研究支架置入后比格犬颈动脉Cat S表达情况,以及法舒地尔对Cat S表达的影响,为支架置入后再狭窄的防治提供了新思路。
法舒地尔于1995在日本首次被批准用于临床的Rho激酶抑制剂,通过竞争性抑制ATP与Rho激酶结合选择性抑制Rho激酶活性[11]。目前已有研究表明,法舒地尔可通过多种机制参与抑制支架术后内膜形成,包括抑制血管炎性反应、抑制VSMCs增殖和迁移、增加凋亡,以及减少胶原蛋白沉积等[12]。本实验通过在支架置入后急性期静脉输注法舒地尔干预支架置入后的再狭窄进程,对支架置入后2 m DSA和颈动脉病理形态学的结果分析表明,B组(裸支架组)再狭窄率显著高于C组(裸支架+fasudil组),表明法舒地尔可以抑制支架置入后再狭窄的进程。本实验研究结果与既往研究结果类似,进一步提示法舒地尔可以抑制支架术后再狭窄进程。
支架置入后再狭窄的形成主要由新生内膜增生所致[13]。动物模型和人类尸检表明血管支架置入后的病理生理机制和伤口愈合的病理生理机制相似[14]。伤口愈合的过程划分为3个过程:炎性反应(数小时至数天),肉芽形成或细胞增殖阶段(数天至数周),以及细胞外基质的重塑(数月)[14]。既往研究[15]表明,血管损伤后形成的新生内膜中,细胞外基质占89%,细胞仅占11%。 本实验颈动脉HE染色和弹力纤维染色结果表示,假手术组内弹力膜外仅覆盖单层内皮细胞,而支架置入2 m后的B组(裸支架组)和C组(裸支架+fasudil组)颈动脉内弹力膜外均可见新生内膜形成,其中细胞的含量较少,主要成分为胶原蛋白等细胞外基质,这与既往的研究结果一致。且B组的新生内膜厚度及面积均大于C组,表明法舒地尔可以通过抑制新生内膜的形成来抑制再狭窄的形成进程。
再狭窄形成过程中一个关键的机制是VSMC分化缺失,使之成为能够增殖和迁移的平滑肌细胞[13]。血管平滑肌细胞在出生后保持着显著的血管可塑性功能,能由收缩型转化为分泌型。对人类PTCA术后再狭窄血管的研究[13]显示,新生内膜中主要是α-SMA阳性的VSMCs,这些细胞周围富含以蛋白聚糖为主的ECM。本实验免疫组化染色的结果表明,A、B、C组血管的中膜上均可见大量α-SMA染色阳性的细胞,而A组内弹力膜外未见α-SMA染色阳性,而B组和C组的新生内膜上均可见α-SMA染色阳性细胞,表明支架置入后平滑肌细胞突破了内弹力膜,迁移至内弹力膜外,同时分泌大量的细胞外基质,导致新生内膜的形成。PCNA在细胞增殖的启动中起重要作用,是反映细胞增殖状态的良好指标;检测其在细胞中的表达,可作为评价细胞增殖状态的一个指标,且与内膜增生程度有关,是判断内膜增殖程度的有效指标[16]。本实验的PCNA免疫组化染色结果表明,A组血管中PCNA表达较少,而B组和C组血管的中膜和内膜上可见PCNA阳性染色,尤其是新生内膜上阳性染色的细胞颗粒较多。对新生内膜中α-SMA和PCNA的阳性染色光密度值的结果分析可见,B组的α-SMA和PCNA光密度值高于C组。相关性分析表明,α-SMA、PCNA与新生内膜厚度呈正相关,表明fasudil可以通过抑制支架置入后平滑肌细胞的迁移和增殖,进而抑制新生内膜的形成和再狭窄的进程,这与既往研究结果一致。
Cat S是木瓜蛋白酶超家族成员,具有较强的弹性纤维和胶原纤维溶解活性。Cat S能降解Ⅰ、Ⅲ、Ⅳ型胶原,层粘连蛋白、纤连蛋白和蛋白聚糖,是木瓜蛋白酶家族中一个强有力的ECM降解半胱氨酸蛋白酶[17]。弹性蛋白是中层ECM蛋白中最主要的蛋白,Cat S能在自然PH值条件下降解弹性蛋白,而弹性蛋白在再狭窄形成过程中ECM的重塑中具有重要的作用。进一步研究[18]发现,Cat S可通过降解ECM促进VSMCs从收缩型转化为分泌型,提高其增殖和迁移的能力,促进VSMCs从中膜迁移入内膜,从而在新生内膜的形成中发挥重要的作用。既往研究[7,8]表明,在正常血管中Cat S表达较少或几乎没有,而在高胆固醇饮食兔和大鼠颈动脉球囊损伤后,血管壁中可见Cat S明显表达。本实验RT-RCR检测结果表明,B组(裸支架组)和C组(裸支架+fasudil组)的Cat S mRNA的表达较A组(假手术组)显著升高,表明Cat S参与了支架置入后再狭窄形成过程。B组(裸支架组)的Cat S mRNA的表达显著高于C组(裸支架+fasudil组),表明fasudil可以降低支架置入后血管中Cat S mRNA的表达。对各指标的相关性分析表明,Cat S mRNA与α-SMA、PCNA、新生内膜厚度之间呈正相关,表明fasudil可能通过降低血管中Cat S mRNA的表达,进而抑制血管平滑肌细胞的迁移和增殖,从而发挥抑制新生内膜的形成和再狭窄进程的作用。
[参考文献]
[1]Umemura T,Kawamura T,Mashita S,et al. Higher levels of cystatin C are associated with extracranial carotid artery steno-occlusive disease in patients with noncardioembolicIschemic stroke[J]. Crebrovasc Dis Extra,2016,6(1):1-11.
[2]Morris DR,Ayabe K,Inoue T,et al. Evidence-based carotid interventions for stroke prevention:state-of-the-art review [J]. J Atheroscler Thromb,2017,24(4):237-387.
[3]Platt MO,Shockey WA. Endothelial cells and cathepsins:biochemical and biomechanical regulation[J]. Biochimie,2016,122:314-323.
[4]Hook V,Funkelstein L,Weqrzyn J,et al. Cysteine cathepsins in the secretory vesicle produce active peptides:cathepsin L generates peptide neurotransmitters and cathepsin B produces beta-amyloid of Alzheimer’s disease[J]. Biochim Biophys Acta,2012,1824(1):89-104.
[5]Wang Y,Tang C,Qin Y. Cathepsinsa new culprit behind abdominal aortic aneurysm[J]. Reqe Med Res,2013,1(1):5.
[6]Petanceka S,Canoll P,Lakshmi AD. Expression of rat cathepsin S in phagocytic cells[J]. J Biol Chem,1996,271(8):4403-4409.
[7]Burns-Kurtis CL,Olzinski AR,Needle S,et al. Cathepsin S expression is up regulated following balloon angioplasty in the hypercholesterolemic rabbit[J]. Cardiovasc Res,2004,62(3):6101-6120.
[8]Cheng XW,Kuzuya M,Sasaki T,et al. Increased expression of elastolytic cysteine proteases,cathepsins S and K,in the neointima of balloon-injured rat carotid arteries[J]. Am J Pathol,2004,164(1):243-251.
[9]Matsumoto Y,Uwatoku T,Oi K,et al. Long-term inhibition of Rho-kinase suppresses neointimal formation after stent implantation in porcine coronary arteries:Involvement of multiple mechanisms[J]. Arterioscler Thromb Vasc Biol,2004,4(2):181-186.
[10]张斯亮,刘地川,吴 健,等. 药物球囊与药物支架治疗支架内再狭窄的Meta分析[J]. 中国介入影像与治疗学,2015,12(12):735-740.
[11]Loirand G,Guerin P,Pacaud P,et al. Rho kinases in cardiovascular physiology and pathophysiology[J]. Circ Res,2006,98(3):322-334.
[12]Hsiao ST,Spencer T,Boldock L,et al. Endothelial repair in stented arteries is accelerated by inhibition of Rho-associated protein kinase[J]. Cardiovasc Res,2016,112(3):689-701.
[13]Nuhn H,Blanco CE,Desai TA. Nanoengineered stent surface to reduce in-stent restenosis in vivo[J]. ACS Appl Mater Interfaces,2017,9(23):19677-19686.
[14]Welt FG,Rogers C. Inflammation and restenosis in the stent era[J]. Arterioscler Thromb Vasc Biol,2002,22(11):1769-1776.
[15]Wight TN,Merrilees MJ. Proteoglycans in atherosclerosis and restenosis:key roles for versican[J]. Circ Res,2004,94(9):1158-1167.
[16]Zhao H,Han T,Hong X,et al. Adipose differentiation related protein knockdown inhibits vascular smooth muscle cell proliferation and migration and attenuates neointima formation[J]. Mol Med Rep,2017,16(3):3079-3086.
[17]Ahmad S,Siddiqi MI. Insights from molecular modeling into the selective inhibition of cathepsin S by its inhibitor[J]. J Mol Model,2017,23(3):92.
[18]Nakakuki T,Ito M,Iwasaki H,et al. Rho/rho-kinase pathway contributes to c-reactive protein-induced plasminogen activator inhibitor-1 expression in endothelial cells[J]. Arterioscler Thromb Vasc Biol,2005,25(10):2088-2093.
