穿心莲内酯喷干粉药代动力学研究*
2018-05-11吴双双罗晓健何明珍张尧熊静江西中医药大学南昌330004江西本草天工科技有限责任公司南昌330006江中药业股份有限公司南昌330096
★吴双双 罗晓健 何明珍 张尧 熊静(1.江西中医药大学 南昌 330004;.江西本草天工科技有限责任公司 南昌 330006;3.江中药业股份有限公司 南昌 330096)
穿心莲内酯(andrographolide,ADG)是爵床科草本植物穿心莲主要有效成分,为二萜内酯类化合物,具有解热、消炎、止痛等功效,对细菌、病毒引起的上呼吸道感染有一定疗效,被誉为“天然抗生素”[1];同时还能抑制各种恶性肿瘤,包括乳腺、肝、颈、结肠和胃癌的细胞系,以及临床前研究中的胶质母细胞瘤[2-3]。ADG呈无色方形或长方形结晶;味极苦,在水中几乎不溶,口服吸收差,生物利用度低[4],限制了其临床的应用。近年来,ADG溶出差、生物利用度低等问题得到众多药学工作者的关注,如赵国巍等采用溶剂蒸发法制备了不同药物-辅料质量比的ADG-聚乙二醇固体分散体,能有效提高难溶性药物ADG的溶出率[5];任科等使用冷冻干燥法制备ADG-羟丙基-β-环糊精包合物,使ADG在水中的溶解度可达到注射剂的要求[6];Hong Du等人以肉豆蔻酸异相丙酯为油相,吐温80为表面活性剂,醇为助表面活性剂和水制备了ADG微乳制剂,与ADG片剂相比,ADG微乳具有更好的抗炎作用和更高的生物利用度[7]。本实验前期,将ADG与糊精研磨、混合,采用喷雾干燥技术制备ADG细粉,发现糊精能够显著提高ADG溶出度,但还未对ADG喷干粉的体内药代动力学进行探索研究。因此,本实验建立了LC-MS/MS 方法测定ADG喷干粉给药后大鼠体内血药浓度,为ADG处方工艺的进一步研究与开发提供实验依据。
1 仪器与材料
1.1 仪器 Nexera X2 LC-30A超高效液相色谱仪,包含在线脱气机、高压二元泵、自动进样器、柱温箱(Shimadzu,日本);QTRAP 4500复合三重四极杆线性离子阱质谱,配备ESI离子源及Analyst 1.6数据处理软件(AB SCIEX,美国);KQ-4000B型超声清洗机(巩义市予华仪器有限责任公司);HC-3018R型高速冷冻离心机(安徽中科中佳科学仪器有限公司);旋涡混匀器(杭州奥盛仪器有限公司);MiLLipore-SimpLicity超纯水处理系统(默克密理博,德国);AL104分析天平(梅特勒-托利多仪器上海有限公司);CM2000研磨机(上海依肯机械设备有限公司)。
1.2 试药 ADG原料(江西青峰医药集团有限公司,批号:20160806);ADG对照品(批号110797-201609,中国食品药品检定研究院);己烯雌酚(批号100033-201308,中国食品药品检定研究院);肝素钠注射液(江苏万邦生化医药股份有限公司);乙腈(美国Fisher Scientific,公司色谱纯);纯净水(广州屈臣氏食品饮料有限公司);甲醇(Anaquur chemicals,色谱纯),糊精(张家港浩波化学品有限公司,药用级)等。
1.3 动物 SD大鼠,雄性,SPF级,体重(220±20g)左右,购于湖南斯莱克景达实验动物有限公司,动物许可证号:SCXK(湘)2016-0002。
2 方法与结果
2.1 ADG喷干粉的制备
2.2.1 ADG糊精喷干粉 分别称取糊精、ADG各50g,混合均匀,投入以200mL纯化水为介质的胶体磨中,固定研磨机工艺参数:研磨频率40Hz,研磨时间30min。将混合溶液进行喷雾干燥,喷雾干燥条件:进风温度140℃,空气压缩比100%,雾化器压力柱高40~50,流速8mL/min。喷雾干燥完成后,收集样品喷干粉,干燥器内保存备用。
2.2.2 ADG原料喷干粉 称取100g 的ADG原料药适量,按“2.2.1”项固定研磨机及喷雾干燥工艺参数。喷雾干燥完成后,收集样品喷干粉,置干燥器内保存备用。
2.2 体内分析方法的建立2.2.1 溶液配制 对照品溶液:精密称取对照品适量,加甲醇溶解稀释成1mg/mL的储备液(阴凉保存);临用前,用甲醇定量稀释成所需对照品浓度。
内标溶液:精密称取己烯雌酚对照品适量,加甲醇溶解稀释成250ng/mL的己烯雌酚溶液作为内标溶液。
2.2.2 检测方法的建立 色谱条件:分析柱Waters CORTECS C18柱(4.6mm×100mm,2.7μm);流速0.5mL/min;柱温40℃;进样量2μL;流动相B相乙腈,A相水;梯度洗脱,结果见表1。
质谱条件:ESI电喷雾离子源,负离子检测;离子源温度600℃;离子喷雾电压-4500V;气帘气气压30psi;雾化气气压50psi;辅助气气压50psi;气帘气、雾化气、辅助气均为氮气。扫描模式:多反应离子监测(MRM)。反应离子对:ADGm/z 395.0→331.4(去簇电压DP:-73v;碰撞能量CE:-16ev);己烯雌酚(内标)m/z 267.0→237.0(去簇电压DP:-99v;碰撞能量CE:-39ev)。
2.3 血浆样品处理 取大鼠血浆50μL,置1.5mL具塞尖底离心管中,加入250ng/mL己烯雌酚20μL,再加入80μL甲醇沉淀蛋白,涡旋3min,于15000r/min、5℃下高速离心10min。取上清液进样,进样量为2μL,进行分析。

表1 流动相梯度洗脱程序
2.4 方法专属性考察 分别取50μL大鼠空白血浆、空白血浆加入一定浓度的ADG对照品溶液和内标溶液、大鼠给药后血浆样品,按“2.3”项下方法操作,将三种样品进行HPLC-MS分析,结果分别见图1-3。结果表明,在选定的色谱及质谱检测条件下,内标和ADG均可实现完全分离,血浆中的内源性物质和代谢物不干扰内标和ADG的测定。

图1 空白血浆样品
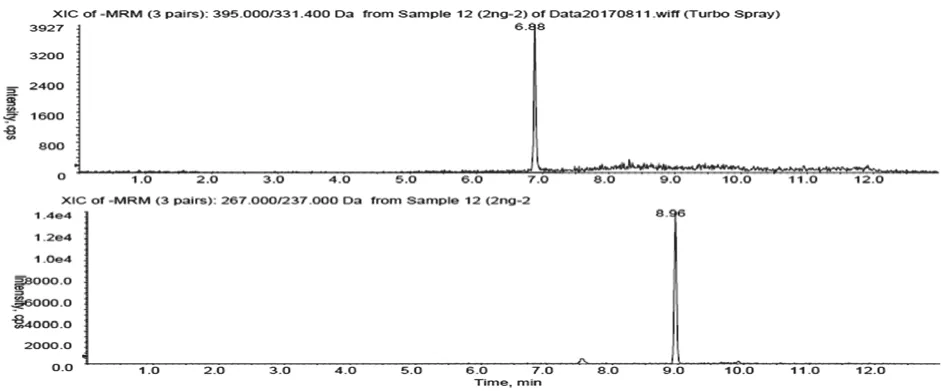
图2 空白血浆加ADG和内标
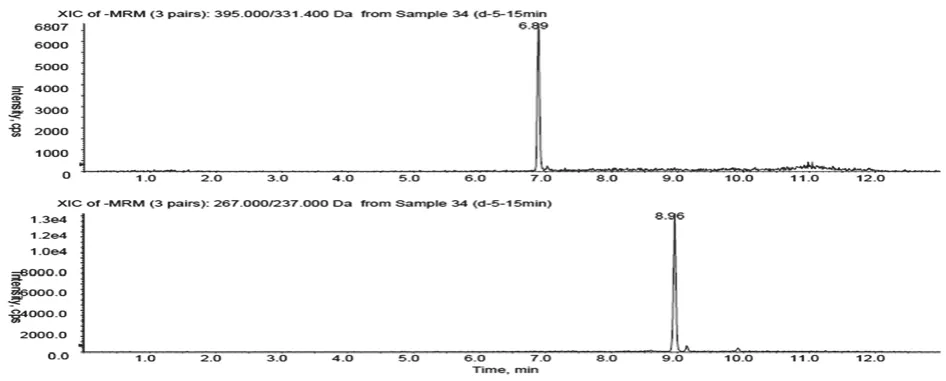
图3 大鼠口服喷干粉后血浆样品
2.5 标准曲线和定量限 取大鼠空白血浆50μL,置1.5mL 具塞尖底离心管中,加入20μL内标溶液,再加入适量ADG对照品配制成含ADG血浆质量浓度分别为2、5、10、25、50、100、200ng/mL的样品。按“2.3”项下的方法处理后进行HPLC-MS分析。以样品中ADG的浓度(ng/mL)为横坐标,ADG峰面积与内标的峰面积比值为纵坐标,采用加权最小二乘法进行回归计算,得ADG标准曲线为Y=0.0335X+0.0123(r=0.9985)(n=3),表 明 ADG的质量浓度在2~200ng/mL内线性关系良好。
最低定量限为标准曲线的最低浓度点,满足信噪比S/N大于10,相对标准偏差(RSD)及相对误差(RE)均在标示值的15%以内。结果表明本方法在2~200ng/mL范围内线性良好,定量下限为2ng/mL(S/N>10)。
2.7 提取回收率 取大鼠空白血浆,按“2.5”项下方法,分别制备ADG低、中、高四个浓度(2、5、100、150ng/mL)的ADG样品,涡旋离心后,取上清液,进样分析,每种浓度平行6样本。另取大鼠空白血浆,不加入内标及待测物标准溶液,按“2.3”项下方法进行处理,挥干后的残渣中加入未加基质但加内标的ADG标准液,使其终浓度分别为2、5、100、150ng/mL,涡旋离心后,取上清液,进样分析,每种浓度平行6样本分析。以每种浓度的两种不同处理方法分析得到的峰面积比值计算提取回收率。结果见表2,经测定,该方法ADG低、中、高四个浓度的提取回收率分别为89.90%、88.67%、95.37%、98.67%,内标的提取回收率均值为94.55%,均符合相关规定,表明四种浓度样品提取回收率良好。
2.6 基质效应 取空白血浆,按“2.3”方法进行处理,挥干后的残渣,加入未加基质但加内标的ADG标准液,使其终浓度分别为2、5、100、150ng/mL,进样,记录峰面积,得峰面积比值R(A)。另取未加基质但加内标的ADG标准液,使其终浓度为2、5、100、150ng/mL,进样,记录峰面积,得峰面积比值R(B)。将每组得到的峰面积比值R相比(B/A),计算ADG在血浆中别的基质效应,结果见表2。由表2可知,该方法ADG在2、5、100、150ng/mL四个浓度的基质效应分别为112.82%、103.49%、104.11%、95.97%,内标的基质效应均值为91.58,均符合相关规定,表明不同受试大鼠的血浆基质对ADG的质谱信号无显著性影响。

表2 ADG血浆样品的基质效应(n=6)

表3 ADG血浆样品的提取回收率(n=6)
2.8 精密度考察 取大鼠空白血浆50μL,按“2.5”项下方法,分别制备ADG四个浓度(2、5、100、150ng/mL)的ADG样品,每种浓度平行5份,重复3个分析批,每批随行标准曲线。以当日的标准曲线计算样品的浓度,计算分析方法的日内与日间精密度与准确度。结果见表4,四个浓度下的批内和批间RSD及RE均在QC样品均值的15%以内,符合方法学的相关要求。

表4 ADG血浆样品的精密度考察(n=5)
2.9 稳定性考察 配制5,100,150ng/mL三种浓度的ADG血浆样品,每个浓度平行配制3份,于-40℃条件下反复冻融3次,按“2.3”项下处理,用当天现配血浆标准曲线计算,结果见表5,测定结果表明,ADG血浆样品于在上述条件下稳定,符合相关规定。

表5 ADG血浆样品冻融稳定性考察(n=3)
2.10 动物实验 取SD雄性大鼠10只,体重220±20g左右,随机分成2组,大鼠给药前禁食12h,禁食期间自由饮水。分别以16.8mg/kg的剂量对ADG原料、糊精喷干粉的0.5%CMC-Na混悬液(以大鼠给料体积约2.1mg/mL/只计算,将样品溶于20mL的水中溶解)进行大鼠灌胃给药。于给药后的 5、10、20、45、60、90、120、180、240、360、480、720、1440min从眼眶取血,置于肝素化的EP管内,4000r/min,离心10min,移取100μL血浆转入2mL EP管中。样品按“2.3”项下处理后,涡旋离心后,取上清液2μL,进行LC-MS/MS分析。大鼠灌胃ADG喷干粉的血药浓度见图2。

图2 ADG喷干粉的平均血药浓度-时间曲线(,n=5)
表6 ADG喷干粉主要药动学参数(,n=5)
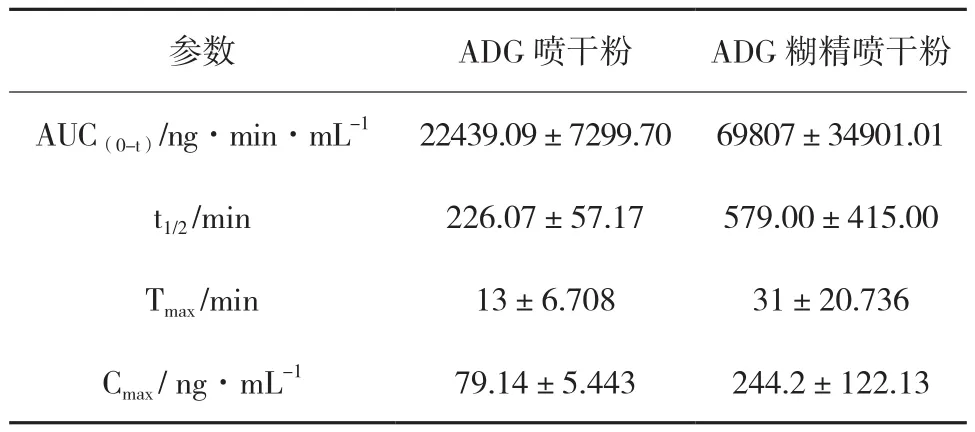
表6 ADG喷干粉主要药动学参数(,n=5)
参数 ADG喷干粉 ADG糊精喷干粉AUC(0-t)/ng·min·mL-1 22439.09±7299.70 69807±34901.01 t1/2 /min 226.07±57.17 579.00±415.00 Tmax /min 13±6.708 31±20.736 Cmax / ng·mL-1 79.14±5.443 244.2±122.13
采用DAS 3.0软件进行药动学参数的拟合,选择模式为非房室模型给药,主要药动学参数见表6。使用SPSS 17.0 统计学软件对以上药动学参数进行单因素方差分析。结果显示,ADG喷干粉与ADG 糊精喷干粉的 AUC0-t、AUC(0-inf)、Cmax、Vz/F、CL/F 均发生了显著性变化(P<0.05),其他参数均无显著性差异。
3 讨论
基于文献报道[8-10]ADG的内标选择多样,实验前期考察了银杏内酯、三七皂苷、己烯雌酚等内标,预试验发现银杏内酯、三七皂苷等提取回收率及基质效应均有超出范围,无法满足分析要求。最终确定选用己烯雌酚为内标,并建立了ADG的LC-MS/MS含量测定方法,该方法稳定、精确、重现性好,可准确测定大鼠血浆中ADG的浓度。
由图2显示,ADG原料、糊精喷干粉在大鼠体内均存在双峰,这和文献报道一致[11],说明大鼠口服ADG喷干粉制剂可能存在肝肠循环现象。由于ADG药代动力学主要表现为体内吸收快,生物利用度低等特征[12],ADG原料喷干粉相比于ADG糊精喷干粉的药-时曲线双峰现象不明显,血药浓度低、达峰时间短。由表6可知,ADG糊精喷干粉比ADG原料喷干粉在大鼠体内口服吸收(AUC0-t)(P<0.05)提高约3倍,可能ADG糊精喷干粉经研磨、喷雾干燥等技术避免ADG在喷雾干燥过程中发生微粉化聚集现象,有利于ADG细粉在水中分散,加快其在体外的溶出及体内的吸收。
4 结论
本实验建立了ADG的LC-MS/MS含量测定方法,该方法灵敏度高,专属性强,能准确测定大鼠血浆中ADG的含量。利用胶体磨粉碎结合喷雾干燥技术提高ADG的溶出度和生物利用度的研究国内尚未见报道。该制备工艺简单易行,成本较低,具有潜在的开发价值。
参考文献
[1]Zhou B, Zhang D, Wu X. Biological activities and corresponding SARs of andrographolide and its derivatives [J]. Mini reviews in medicinal chemistry, 2013, 13(2):298-309.
[2]Lee Y C, Lin H H, Hsu C H, et al. Inhibitory effects of andrographolide on migration and invasion in human non-small cell lung cancer A549 cells via down-regulation of PI3K/Akt signaling pathway [J]. European journal of pharmacology, 2010, 632(1):23-32.
[3]Hocker H J, Cho K J, Chen C Y K, et al. Andrographolide derivatives inhibit guanine nucleotide exchange and abrogate oncogenic Ras function [J]. Proceedings of the National Academy of Sciences, 2013,110(25):10 201-10 206.
[4]Ye L, Wang T, Tang L, et al. Poor oral bioavailability of a promising anticancer agent andrographolide is due to extensive metabolism and efflux by P-glycoprotein [J]. Journal of pharmaceutical sciences, 2011,100(11):5 007-5 017.
[5]赵国巍, 张守德, 梁新丽, 等. ADG-聚乙二醇固体分散体的制备及体外评价[J]. 中国医药工业杂志, 2017, 48(2):200-203.
[6]任科, 张志荣, 鞠静红, 等. ADG-羟丙基-β-环糊精包合物的鉴定和热力学稳定性研究[J]. 中草药, 2008, 39(4):518-521.
[7]Du H, Yang X, Li H, et al. Preparation and evaluation of andrographolide-Loaded micro emulsion [J]. Journal of microencapsulation, 2012, 29(7):657-665.
[8]Xu F, Fu S, Gu S, et al. Simultaneous determination of andrographolide,dehydroandrographolide and neoandrographolide in dog plasma by LC-MS/MS and its application to a dog pharmacokinetic study of Andrographis paniculata tablet [J]. Journal of Chromatography B,2015(990):125-131.
[9]Zhang S Q, Chen X H, Yu M, et al. Quantification of andrographolide sodium bisulphite in urine after intravenous injection to rats by LC-MS/MS [J]. Journal of Chromatography B, 2012(880):163-167.
[10]Chong L, Chen W, Luo Y, et al. Simultaneous determination of 9-dehydro-17-hydro-andrographolide and sodium 9-dehydro-17-hydro-andrographolide-19-yl sulfate in rat plasma by UHPLC-ESIMS/MS after administration of xiyanping injection: application to a pharmacokinetic study [J]. Biomedical Chromatography, 2013, 27(7):825-830.
[11]Yang T, Sheng H H, Feng N P, et al. Preparation of Andrographolide-Loaded Solid Lipid Nanoparticles and Their In Vitro and In Vivo Evaluations:Characteristics, Release, Absorption, Transports,Pharmacokinetics, and Antihyperlipidemic Activity [J]. Journal of pharmaceutical sciences, 2013, 102(12):4 414-4 425.
[12]王芳, 翟文婷, 李艳丽, 等. 穿心莲内酯制剂及药代动力学的研究进展[J]. 中国药业, 2013, 22(9):1-4.
