颞叶癫痫共患抑郁的工作记忆障碍theta振荡特征模式研究
2018-05-07杜雪云潘立平任艳苹宋毅军
杜雪云,潘立平,任艳苹,宋毅军
颞叶癫痫(temporal lobe epilepsy,TLE)是临床常见的难治性癫痫,多达50%的患者共患抑郁[1]。抑郁障碍导致TLE患者生活质量进一步降低,自杀风险增加[2]。TLE共患抑郁(TLE with depression)常有工作记忆(working memory,WM)损伤[3]。WM是对信息的短时存储和加工的有限容量系统,是学习、语言理解和逻辑推理等高级认知功能的基础。神经解剖学研究发现,海马、杏仁核、内嗅皮质、前额叶、扣带回和皮质下结构(如基底核和丘脑)等结构异常均与TLE共患抑郁有关[4]。同时,海马和额叶等脑区也是WM的责任脑区[5-7]。本研究以TLE共患抑郁、TLE和正常对照组在视觉WM任务中的多通道脑电(electroencephalograms,EEGs)信号为研究对象,研究WM延迟期多通道脑电的theta振荡特征模式,探讨TLE共患抑郁WM损伤的潜在神经机制。
1 对象与方法
1.1 研究对象 右利手TLE患者均来自2016年10月—2017年12月天津医科大学总医院神经内科门诊,所有患者均完成24h视频脑电监测,并收集详细的临床资料。纳入标准:诊断符合国际抗癫痫联盟关于颞叶癫痫的诊断标准;简易智力状态检查量表(MMSE)评分≥24分;近3个月未出现过癫痫持续状态。排除标准:药物滥用或乙醇依赖者;患有影响认知功能的其他疾患者;患有其他神经系统或精神疾病者;无法配合完成实验者。对符合纳入标准者进行量表检查及分组,所有纳入者均完成贝克抑郁自评量表-Ⅱ(BDI-Ⅱ)和汉密尔顿抑郁量表(17项,HAMD-17)检查。评分标准:BDI-Ⅱ量表评分≥14分为抑郁状态[8];HAMD-17评分>7分为抑郁状态[9]。根据评分分为TLE共患抑郁组(TLE+D组)和TLE组(每组10例)。招募10例年龄、性别、教育背景等相匹配的无神经系统或精神疾病史的右利手健康受试者为正常对照组(Con组)。所有受试者均自主签署知情同意书。3组受试者的性别、年龄比较差异无统计学意义(P>0.05);TLE组和TLE+D组病程、发作频率、抗癫痫药物(antiepileptic drugs,AEDs)种类比较差异无统计学意义(P>0.05)。BDI-Ⅱ和HAMD-17量表评分方面,TLE+D组高于TLE组和Con组(均P<0.01),TLE组和Con组比较差异无统计学意义(P>0.05),见表1。
1.2 方法
1.2.1 WM行为学检查 视觉延迟样本匹配范式(delayed matching-to-sample task,DMS),是视觉WM研究的经典范式,可将WM任务中的编码、延迟和探测3个阶段在时间上分开,分别研究WM不同阶段的神经机制。本研究采用DMS范式[10],以Snodgrass图片库中日常物体的图片作为视觉刺激,受试者编码记忆一组刺激,在数秒的延迟后判断出现的探测刺激是否与编码记忆的某个刺激相匹配。每次试验开始时屏幕中心出现0.5 s的注视点“*”,提示试验开始。依次呈现记忆序列中的4张图片,每张图片呈现1 s,图片之间间隔13 ms。第4张图片消失后,屏幕呈现“+”,提醒受试者进入3 s的延迟期。而后探测图片呈现2.5 s,在此期间受试者需要快速准确判断探测图片是否在记忆序列中出现过,若在2.5 s内受试者没有按键,则探测图片消失,该次试验结束;每次试验间隔4 s,见图1。本试验程序采用E-prime 2.0的组块设计,其中探测图片出现过和未出现过的概率分别为50%和50%。E-prime软件记录行为学数据:正确率和反应时间。正确率是指在试验过程中受试者判断正确的试验个数占所有试验个数的比例。反应时间基于受试者正确应答,从探测图片出现到受试者按键应答所用的时间。
1.2.2 多通道EEGs的采集与预处理 应用Nicolet One视频脑电图仪(Nicolet,美国)记录3组受试者在静息状态下和WM任务中34通道EEGs和2通道水平眼电(horizontal electrooculogram,HEOG)与2通道垂直眼电(vertical electrooculogram,VEOG)。34通道EEGs的Ag/AgCl电极位置按照国际10-20系统放置,见图2。其中1~34通道分别对应电极Fp1、Fp2、AF3、AF4、F3、Fz、F4、FC3、FCz、FC4、F7、FT7、T3、TP7、T5、F8、FT8、T4、TP8、T6、C3、Cz、C4、CP3、CPz、CP4、P3、Pz、P4、PO3、PO4、O1、Oz和 O2。两个水平眼电电极(HEOL,HEOR)位于双侧眼角外侧2.5 cm处,两个垂直眼电电极(VEOU,VEOL)分别位于左眼眉上与下眼睑下2 cm处。电极Cz与CPz连线中点为参考电极,电极Fpz与Fz的中点为接地电极。采样频率为1 024 Hz,在整个信号采集过程中电极的阻抗保持在5 kΩ以下,后续的数据处理以所有电极的平均电位为参考。数据预处理:去除34通道原始EEGs中由于眼动、50 Hz的工频干扰和肌肉收缩等造成的伪迹和基线漂移等噪声。
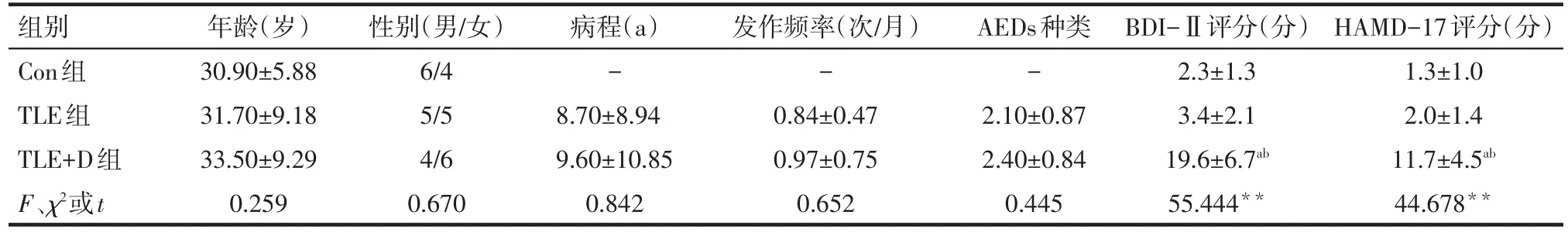
Tab.1 Comparison of general data and clinical data between three groups表1 受试者一般资料及临床资料比较 (n=10)

Fig.1 Schematic diagram of visual working memory paradigm图1 视觉工作记忆范式的示意图

Fig.2 Topographic distribution of 34 electrodes according to the international 10-20 systems图2 34通道EEGs记录电极按国际10-20系统放置的位置示意图
1.2.3 多通道EEGs能量密度的时间-频率分布 应用短时傅里叶变换,对预处理后的34通道EEGs进行时频分析,计算每个通道的能量密度的时频分布,确定WM相关任务阶段[11-12]。EEGs按照其生理意义可以分为 delta(0~4 Hz)、theta(4~8 Hz)、alpha(8~13 Hz)、beta(13~30 Hz)和 gamma(30~80 Hz)频段。计算WM相关的任务阶段,34通道EEGs各频段能量占总能量的百分比,确定WM特征频段。
1.2.4 多通道EEGs能量密度的特征通道和特征脑区 进一步分析3组受试者34通道EEGs特征频段能量密度的空间分布,比较不同通道以及脑区的平均能量密度(额区:Fp1、AF3、F3、FC3、Fz、FCz、Fp2、AF4、F4、FC4;颞区:F7、FT7、T3、TP7、T5、F8、FT8、T4、TP8、T6;中央-顶区:C3、CP3、P3、Cz、CPz、Pz、C4、CP4、P4;枕区:O1、PO3、Oz、PO4、O2)。同时分析3组受试者在静息状态脑电能量的空间分布。由于TLE组和TLE+D组的多通道EEGs信号中包含间歇期异常放电活动,所以本研究中WM效应的能量密度计算为:PWM=PRAW-PRS。其中PRAW为WM中预处理后EEGs的能量密度,PRS为静息态EEGs能量密度,PWM为WM效应的EEGs能量密度。本研究中WM效应的EEGs能量密度均指PWM。
1.3 统计学方法 采用SPSS 18.0软件进行统计分析。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析(ANOVA),组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 WM行为学结果 Con组、TLE组、TLE+D组WM任务的正确率分别为(97.35±2.32)%,(92.01±6.36)%,(91.28±3.78)%,相比Con组,TLE组、TLE+D组正确率明显降低(F=5.487,P<0.05),TLE组和TLE+D组之间正确率差异无统计学意义(P>0.05)。Con组、TLE组、TLE+D组的反应时间分别为(699.78±165.46)ms、(930.95±70.76)ms和(1 092.43±137.94)ms,相比Con组,TLE组、TLE+D组的反应时间增加(F=22.728,P<0.01),TLE+D组反应时间较TLE组增加(P<0.05)。
2.2 EEGs预处理 记录的34通道原始EEGs数据见图3A。根据同步记录到的HEOG和VEOG,利用协方差方法去除眼动对EEGs的干扰;采用陷波器,带阻滤波设为49.5~50.5 Hz,滤除EEGs中的工频干扰;应用多项式拟合方法,去除EEGs中的基线漂移。经过预处理后的34通道EEGs,见图3B。

Fig.3 Preprocessing of 34-channel EEGs图3 34通道EEGs预处理
2.3 工作记忆EEGs的时频分布结果 应用短时傅里叶变换,分析WM过程中34通道EEGs能量的时频分布。Con组1例受试者WM过程中多通道EEGs能量最大通道(Fz)的时频分布见图4,其中红色表示能量密度最大,蓝色表示能量密度最小。可见,能量主要集中在WM延迟期的theta(4~8 Hz)频段,表明WM任务相关时段为延迟期,主要频段为theta频段。
在WM延迟期,3组不同频段的能量比较差异有统计学意义(P<0.01),Con组theta频段能量高于同组其他频段(P<0.01);而TLE组和TLE+D组alpha频段能量最高(P<0.01)。3组受试者theta频段能量差异均有统计学意义,表现为Con组最高,TLE和TLE+D组较低(P<0.01),见表2。因此本研究选取WM延迟期的theta频段进一步分析其空间分布,研究WM特征频段的特征脑区和特征通道。
2.4 工作记忆特征频段能量密度的空间分布 Con组、TLE组和TLE+D组工作记忆延迟期theta频段能量的空间分布见图5。工作记忆延迟期的能量集中在额区,尤其是额中线的Fz通道。进一步比较3组工作记忆Fz通道和额区theta频段的能量密度(单位:μV2/Hz),与Con组(Fz:0.364 2±0.126 9,额区:0.286 9±0.143 6)相比,TLE组(Fz:0.289 5±0.083 9,额区:0.213 9±0.106 5)和 TLE+D 组(Fz:0.203 6±0.081 0,额区:0.058 6±0.042 0)能量显著降低,且TLE+D组也低于TLE组(F分别为118.597和214.115,均P<0.01)。
3 讨论
癫痫和精神性疾病(如抑郁)是双向作用的关系,癫痫患者抑郁发病率和抑郁患者癫痫发病率均高于一般水平[13],因此TLE和抑郁可能具有相同或相似的发病机制。TLE共患抑郁的病理研究发现,包括颞叶、额叶和海马在内的多个脑区存在结构和功能异常。Finegersh等[14]和郜玉婷等[15]均发现,相比于不伴抑郁的TLE患者,TLE共患抑郁患者更易发现海马萎缩,提示海马结构的改变可能与TLE共患抑郁具有密切联系。Kemmotsu等[16]发现TLE共患抑郁患者在静息状态下海马-前额叶、额叶边缘系统网络功能连接异常。Chen等[17]发现TLE共患抑郁患者双侧丘脑、岛叶和右侧前扣带回活动异常,前额叶-边缘系统、边缘系统和角回功能连接异常。由此推断,海马、颞叶、前额叶等结构和功能异常可能是TLE共患抑郁的发病基础。
WM与双侧额顶叶网络[18]、额颞叶网络[19]活动密切相关,特别是前额叶和海马在WM中不可或缺[6]。而TLE共患抑郁常表现为海马、前额叶等结构和功能异常,严重破坏了WM网络的完整性,从而导致WM损伤。Stretton等[3]研究发现TLE共患抑郁患者执行WM任务时应答正确率明显低于健康对照组,存在WM损伤。因此,本研究中TLE和TLE共患抑郁存在的WM损伤可能与海马和额区等结构和功能异常密切相关。
Theta振荡是大脑普遍存在的神经电活动,与注意、学习和记忆等认知过程密切相关,特别是在WM中起了重要作用[5]。临床和基础研究表明,theta振荡源自于前扣带皮质和内侧前额叶[20-21]。Zhang等[10]研究发现正常受试者WM中额区(特别是额中线Fz)的theta振荡明显增强,theta节律在WM信息维持中起重要作用。郜姗姗等[22]研究发现,TLE患者WM额区(主要是Fz)theta节律减弱。本研究中EEGs分析结果与上述研究一致,正常对照组WM延迟期theta频段能量百分比最高,表明theta频段是WM的关键频段;theta频段能量主要集中在额区(特别是Fz);TLE与TLE伴抑郁theta频段能量占比下降,且额区theta频段的能量密度均下降,表明theta振荡缺失。因此,本研究结果提示TLE共患抑郁患者的额区(特别是Fz)theta振荡缺损可能是其WM损伤的潜在机制之一。
文献报道WM延迟期alpha振荡与行为学反应时间成正比[23],在抑制WM无关信息中起了重要作用[5]。本研究发现,TLE和TLE共患抑郁的WM行为学反应时间比正常对照组明显增加,TLE和TLE共患抑郁WM延迟期的alpha频段能量占总能量的百分比增加,可能原因之一是TLE共患伴抑郁患者需要抑制更多的与WM无关的活动,如间歇期异常脑电和抑郁沉思等[24]。后续需要进一步研究alpha频段以及其他频段在WM中的作用。
Tab.2 Power percentages of different frequency bands during WM delay periods表2 工作记忆延迟期EEGs不同频段能量占总能量的百分比 (%,±s)

Tab.2 Power percentages of different frequency bands during WM delay periods表2 工作记忆延迟期EEGs不同频段能量占总能量的百分比 (%,±s)
**P<0.01;a与Con组比较,b与TLE组比较,P<0.05;#3组工作记忆任务分别为197、186和175次;A与delta频段比较,B与theta频段比较,C与alpha频段比较,D与beta频段比较,P<0.05
组别Con组TLE组TLE+D组F n#F 197 186 175 delta 14.80±1.76 13.61±1.50a 14.05±1.97ab 22.580**theta 32.26±3.79A 28.01±1.97aA 27.49±2.23aA 164.788**alpha 29.07±3.61AB 31.22±3.59aAB 30.64±4.46aAB 15.621**beta 16.57±2.05ABC 19.96±3.10aABC 19.89±2.94aABC 97.081**gamma 7.30±2.03ABCD 7.22±1.18ABCD 7.92±1.43abABCD 10.541**2 749.758**3 056.738**1 942.107**
本研究结合同步记录的视觉WM行为学和多通道EEGs发现,相比于正常对照组,TLE和TLE共患抑郁WM均明显受损,并且TLE共患抑郁较TLE损伤更明显;额区theta振荡缺失是TLE共患抑郁WM损伤的潜在神经机制之一,为TLE共患抑郁的发病机制和诊疗提供了理论支持。
(图4、5见插页)
[1]Kanner AM.Managementofpsychiatric and neurological comorbidities in epilepsy[J].Nat Rev Neurol,2016,12(2):106-116.doi:10.1038/nrneurol.2015.243.
[2]Raid,Kerr MP,McManus S,et al.Epilepsy and psychiatric comorbidity:a nationally representative population-based study[J].Epilepsia,2012,53(6):1095-1103.doi:10.1111/j.1528-1167.2012.03500.x.
[3]Stretton J,Pope RA,Winston GP,et al.Temporal lobe epilepsy and affective disorders:the role of the subgenual anterior cingulate cortex[J].J Neurol Neurosurg Psychiatry,2015,86(2):144-151.doi:10.1136/jnnp-2013-306966.
[4]Valente KD,Busatto Filho G.Depression and temporal lobe epilepsy represent an epiphenomenon sharing similar neural networks:clinicaland brain structuralevidences [J].Arq Neuropsiquiatr,2013,71(3):183-190.doi:10.1590/S0004-282X2013000300011.
[5]Roux F,Uhlhaas PJ.Working memory and neural oscillations:alpha-gamma versus theta-gamma codes fordistinctWM information?[J].Trends Cogn Sci,2014,18(1):16-25.doi:10.1016/j.tics.2013.10.010.
[6]D'Esposito M,Postle BR.The cognitive neuroscience of working memory[J].Annu Rev Psychol,2015,66:115-142.doi:10.1146/annurev-psych-010814-015031.
[7]Christophel TB,Klink PC,Spitzer B,et al.The distributed nature of working memory[J].Trends Cogn Sci,2017,21(2):111-124.doi:10.1016/j.tics.2016.12.007.
[8]Beck AT,Steer RA,Ball R,et al.Comparison of beck depression inventories-IA and-II in psychiatric outpatients[J].J Pers Assess,1996,67(3):588-597.doi:10.1207/s15327752jpa6703_13.
[9]Zimmerman M,Martinez JH,Youngd,et al.Severity classif i cation on the Hamilton depression rating scale[J].J Affect Disord,2013,150(2):384-388.doi:10.1016/j.jad.2013.04.028.
[10]Zhangd,Zhaoh,Bai W,et al.Functional connectivity among multi-channel EEGs when working memory load reaches the capacity[J].Brain Res,2016,1631:101-112.doi:10.1016/j.brainres.2015.11.036.
[11]李花娟,朱婧,张挺,等.轻度认知障碍工作记忆中theta振荡的特征研究[J].天津医药,2017,45(6):605-609.Li HJ,Zhu J,Zhang T,et al.The study of the theta oscillation characteristic in working memory in patients with mild cognitive impairment[J].Tianjin Med J,2017,45(6):605-609.doi:10.11958/20170091.
[12]朱婧,李花娟,宋毅军.额叶癫痫工作记忆的theta振荡特征研究[J].天津医药,2017,45(4):393-397.Zhu J,Li HJ,Song YJ.The study of the theta oscillation characteristic for working memory in frontal lobe epilepsy[J].Tianjin Med J,2017,45(4):393-397.doi:10.11958/20170123.
[13]Kanner AM,Mazarati A,Koepp M.Biomarkers of epileptogenesis:psychiatric comorbidities?[J].Neurotherapeutics,2014,11(2):358-372.doi:10.1007/s13311-014-0271-4.
[14]Finegersh A,Avedissian C,Shamim S,et al.Bilateral hippocampal atrophy in temporal lobe epilepsy:Effect of depressive symptoms and febrile seizures[J].Epilepsia,2011,52(4):689-697.doi:10.1111/j.1528-1167.2010.02928.x.
[15]郜玉婷,姚晓娟,毓青,等.颞叶癫痫伴抑郁状态患者静息态功能磁共振脑网络研究[J].中华医学杂志,2016,96(21):1696-1698.Gao XT,Yao XJ,Yu Q,et al.Resting-state functional magnetic resonance study of the brain’s network of the temporal lobeepilepsy patients with depression[J].Natl Med J China,2016,96(21):1696-1698.doi:10.3760/cma.j.issn.0376-2491.2016.21.017.
[16]Kemmotsu N,Kucukboyaci NE,Cheng CE,et al.Alterations in functional connectivity between hippocampus and prefrontal cortex as a correlate of depressive symptoms in temporal lobe epilepsy[J].Epilepsy Behav,2013,29(3):552-559.doi:10.1016/j.yebeh.2013.09.039.
[17]Chen S,Wu X,Lui S,et al.Resting-state fMRI study of treatmentnaive temporal lobe epilepsy patients with depressive symptoms[J].Neuroimage,2012,60(1):299-304.doi:10.1016/j.neuroimage.2011.11.092.
[18]Winston GP,Stretton J,Sidhu MK,et al.Structural correlates of impaired working memory in hippocampal sclerosis[J].Epilepsia,2013,54(7):1143-1153.doi:10.1111/epi.12193.
[19]Stretton J,Thompson PJ.Frontal Lobe function in temporal lobe epilepsy[J].Epilepsy Res,2012,98(1):1-13.doi:10.1016/j.eplepsyres.2011.10.009.
[20]Meltzer JA,Negishi M,Mayes LC,et al.Individual differences in EEG theta and alpha dynamics during working memory correlate with fMRI responses across subjects[J].Clin Neurophysiol,2007,118(11):2419-2436.doi:10.1016/j.clinph.2007.07.023.
[21]Tsujimoto T,Shimazuh,Isomura Y,et al.Theta oscillations in primate prefrontal and anterior cingulate cortices in forewarned reaction time tasks[J].J Neurophysiol,2010,103(2):827-843.doi:10.1152/jn.00358.2009.
[22]郜姗姗,王一旭,曹娟,等.颞叶癫痫工作记忆障碍theta振荡缺失的研究[J].国际生物医学工程杂志,2016,39(3):134-139,148.Gao SS,Wang YX,Cao J,et al.Study of absence of theta oscillation of working memory dysfunction in temporal lobe epilepsy[J].Int J Biomed Eng,2016,39(3):134-139,148.doi:10.3760/cma.j.issn.1673-4181.2016.03.002.
[23]Roux F,Wibral M,Mohr HM,et al.Gamma-band activity in human prefrontal cortex codes for the number of relevant items maintained in working memory[J].J Neurosci,2012,32(36):12411-12420.doi:10.1523/jneurosci.0421-12.2012.
[24]Segrave RA,Thomson RH,Cooper NR,et al.Upper alpha activity during working memory processing reflects abnormal inhibition in major depression[J].J Affect Disord,2010,127(1/2/3):191-198.doi:10.1016/j.jad.2010.05.022.
