减重代谢手术治疗重度肥胖合并2型糖尿病术后1年疗效分析*
2018-05-03王文越杨珵璨
王文越,杨珵璨,王 兵
(上海交通大学医学院附属第九人民医院,上海,200011)
近半个世纪以来,肥胖症与2型糖尿病(type 2 diabetes mellitus,T2DM)的患病率增长迅速,两者呈平行增长态势[1]。据WHO最新统计数据,2014年全球超过19亿的成年人超重,其中6亿多肥胖,体重指数(body mass index,BMI)>30。全球肥胖流行率较1980年翻了一倍以上。而2014年全球糖尿病患者(20~79岁)达3.87亿,较2013年增加了500万人,其中中国患者约为9 629万,居全球之首[2]。肥胖已成为T2DM的首要风险因素。近十年,胃肠减重代谢手术发展迅速,为重度肥胖合并T2DM的治疗开辟了新领域[3]。2011年国际糖尿病联盟正式推荐代谢外科手术可作为肥胖症合并T2DM的治疗方法。本研究旨在观察与分析腹腔镜胃旁路手术(laparoscopic Roux-en-Y gastric bypass,LRYGB)、腹腔镜胃袖状切除术(laparoscopic sleeve gastrectomy,LSG)治疗重度肥胖合并T2DM的短期临床疗效,以期为今后的临床治疗提供帮助。
1 资料与方法
1.1 临床资料 回顾分析2015年6月至2016年6月上海交通大学医学院附属第九人民医院为48例重度肥胖合并T2DM患者行减重手术的临床资料,其中男26例,女22例;平均(25.8±4.8)岁。术前患者均接受内分泌科会诊,明确T2DM诊断并评估胰岛功能。按手术方式分为LSG组与LRYGB组,两组患者年龄、BMI、空腹血糖(fasting plasma glucose,FPG)、空腹C肽、糖化血红蛋白(glycosylated hemoglobin,HbA1c)、胆固醇、甘油三酯情况见表1。
1.2 手术方法 患者均接受腹腔镜下减重代谢手术,其中30例行LSG,18例行LRYGB。术中残余胃容量均由Fr36指引胃管经口插入标识。术式要点、技术指标均符合2014版《中国肥胖和2型糖尿病外科治疗指南》要求[4],胃袖状切除术的要点:(1)沿大弯侧游离切断胃网膜左动脉、胃短动脉;(2)大弯侧距幽门4 cm处作为胃袖状切除起点,沿指引管向上切割闭合;(3)切割直至左食管胃角完全保留贲门;(4)仔细检查切割口有无出血、渗漏。见图1。胃转流手术要点:(1)隔绝全部胃底,建立容积为30~50 ml的胃小囊;(2)使用切割吻合器行胃空肠侧侧吻合;(3)用3-0可吸收缝线关闭胃肠吻合口;(4)行胆胰支、食物支侧侧吻合,胃肠支、胆胰支消化道长度均为100 cm;(5)用3-0可吸收线关闭吻合口。见图2。
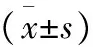

组别例数(n)年龄(岁)性别(n)男女BMI(kg/m2)FPG(mmol/L)空腹C肽(mmol/L)HbA1c(%)胆固醇(mmol/L)甘油三酯(mmol/L)LSG组3026.1±4.2161439.5±2.99.5±1.91.2±0.38.1±0.45.1±1.13.5±0.8LRYGB组1825.3±5.710840.7±2.39.2±1.01.1±0.28.2±0.65.0±0.63.6±1.0t/χ2值0.560.021.490.621.250.690.350.38P值0.580.890.140.540.220.490.720.70

图1 腹腔镜胃袖状切除术(A沿大弯侧游离切断胃网膜左动脉、胃短动脉;B大弯侧距幽门4 cm处作为胃袖状切除起点,沿指引管向上切割闭合;C完全切除胃底,完整保留贲门;D仔细检查切割口有无出血、渗漏)

图2 腹腔镜胃转流术(A隔绝全部胃底建立胃小囊;B胃空肠侧侧吻合(结肠前);C关闭胃肠吻合口;D行胆胰支、食物支侧侧吻合,胃肠支、胆胰支消化道长度均为100 cm)
1.3 观察指标与术后随访 观察手术时间、术中出血量、住院时间及并发症发生情况。随访由普通外科专人管理,分别于术后第6、12个月入院随访。观察指标包括:术后并发症、体重、BMI及多余体重减少百分比(excess weight loss,%EWL);糖脂代谢相关指标包括FPG、HbA1c、空腹C肽及血胆固醇、血甘油三酯浓度。计算Homa-IR即胰岛素抵抗指数=FPG水平(mmol/L)×空腹胰岛素水平(FINS,mIU/L)/22.5。
1.4 临床效果评价 术后糖尿病转归参考2014版《中国肥胖和2型糖尿病外科治疗指南》的评判标准[4-5]:(1)无效:与术前相比,FPG、HbA1c无明显改善;降糖药种类、剂量与术前相比无明显减少;(2)改善:降糖药种类或剂量与术前相比明显减少;术后HbA1c<7.5%;(3)缓解:术后仅通过改变生活方式干预即可控制血糖;HbA1c<7.0%;FPG≤6.9 mmol/L。
1.5 统计学处理 采用SPSS 19.0软件进行统计分析,计量资料以mean±SD表示;计数资料以百分率表示;计量资料组内比较采用配对t检验,组间比较采用独立样本t检验;计数资料组间比较采用Fisher确切概率法。P<0.05为差异有统计学意义。
2 结 果
2.1 手术情况 48例均成功完成腹腔镜手术,无中转开腹或死亡病例,手术均由同一医疗团队完成。LSG组手术时间较LRYGB组明显缩短(P<0.01),术中出血量两组差异无统计学意义,住院时间低于LRYGB组(P<0.01),见表2。术后LRYGB组中1例出现肠梗阻,保守治疗6 d后痊愈;1例术后出现胃瘫,经禁食等保守治疗9 d后缓解;术后均未出现出血、穿孔、吻合口狭窄等严重并发症。
2.2 肥胖改善 LSG组术后6个月、12个月体重指数分别为(31.4±2.5) kg/m2与(29.9±2.9) kg/m2,与术前相比差异有统计学意义(P<0.01);LRYGB组术后6个月、12个月体重指数分别为(30.4±2.4) kg/m2与(28.5±2.6) kg/m2,与术前相比差异有统计学意义(P<0.01)。术后6个月、12个月,两组患者间BMI与%EWL差异无统计学意义(P>0.05)。见表3。
2.3 糖代谢相关指标的变化 术后6个月、12个月,LSG组FPG、空腹C肽及HbA1c较术前均明显下降(P<0.01);术后12个月,Homa-IR平均(2.3±1.5),较术前(6.7±6.2)明显改善(P<0.01)。术后6个月、12个月,LRYGB组FPG、空腹C肽及HbA1c较术前均明显下降(P<0.01);Homa-IR由术前(5.9±5.5)降为(2.4±1.5),差异有统计学意义(P<0.01)。各项指标两组间相比差异均无统计学意义(P>0.05)。见表4。
2.4 脂质代谢相关指标的变化 两组患者血胆固醇、甘油三酯均较术前明显降低(P<0.05),术后6个月,两组间差异无统计学意义(P>0.05);术后12个月LRYGB组胆固醇浓度明显低于LSG组,差异有统计学意义(P<0.01)。见表5。
2.5 术后糖尿病缓解率 术后12个月,LSG组中22例患者无需使用药物即可控制血糖,且HbA1c<7.0%,缓解率73%;8例患者均停用胰岛素,仅口服降糖药即可控制血糖,且HbA1c<7.5%;LRYGB组中14例糖尿病缓解,缓解率78%;两组间差异无统计学意义(Fisher确切概率P=1.0000>0.05)。
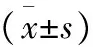

组别例数(n)手术时间(min)术中出血量(ml)住院时间(d)LSG组3074.5±6.413.7±3.57.8±0.8LRYGB组18143.8±8.215.9±4.38.8±1.5t值32.651.933.02P值<0.0010.060.004
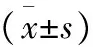

组别体重(kg)术前术后6个月术后12个月BMI(kg/m2)术前术后6个月术后12个月%EWL(%)术前术后6个月术后12个月LSG组108.7±15.491.5±12.0∗84.1±9.1∗39.5±2.931.4±2.5∗29.9±2.9∗⁃47.5±9.1∗60.8±13.4∗LRYGB组101.2±8.284.2±7.7∗79.1±7.9∗40.7±2.330.4±2.4∗28.5±2.6∗⁃49.5±5.8∗64.2±7.9∗P值0.030.060.180.100.410.33
*P<0.01 vs. 术前
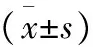

组别FPG(mmol/L)术前术后6个月术后12个月空腹C肽(mmol/L)术前术后6个月术后12个月LSG组9.5±1.97.1±1.3∗6.7±1.3∗1.2±0.30.9±0.3∗0.8±0.2∗LRYGB组9.2±1.07.0±1.5∗6.6±1.5∗1.0±0.20.8±0.3∗0.9±0.2∗P值0.810.800.270.1
续表4

组别HbA1c(%)术前术后6个月术后12个月Homa⁃IR术前术后6个月术后12个月LSG组8.0±0.46.9±0.9∗6.7±0.8∗6.7±6.22.4±1.1∗2.3±1.5∗LRYGB组8.2±0.66.7±0.7∗6.5±0.7∗5.9±5.52.8±1.2∗2.4±1.5∗P值0.420.380.240.82
*P<0.01 vs. 术前
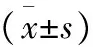

组别胆固醇(mmol/L)术前术后6个月术后12个月甘油三酯(mmol/L)术前术后6个月术后12个月LSG组5.0±1.14.7±0.7∗4.6±0.7∗3.5±0.82.4±0.6∗2.5±0.4∗LRYGB组5.0±0.64.3±0.8∗3.8±0.4∗3.6±1.02.5±0.8∗2.4±0.6∗P值0.08<0.0010.620.49
*P<0.05 vs.术前
3 讨 论
胃肠手术治疗糖尿病最早见于1982年,Pories等在手术治疗病态肥胖症时发现,体重减轻的同时血糖也快速恢复正常,且无需再采用降糖措施维持,从而开创了以外科手术治疗T2DM的新途径[6-8]。Buchwald等的一项Meta分析结果显示,术后T2DM患者的临床完全缓解率达78.1%,病情得到改善的比率达86.6%[9]。本文回顾性分析48例肥胖合并糖尿病患者的资料,术后随访12个月发现,糖尿病缓解率为75%,且LSG组与LRYGB组治疗效果相近,与国外文献报道类似。
减重代谢手术可有效治疗病态肥胖,不仅是因为能有效减轻体重,更重要的是对糖脂代谢的改善。LRYGB因具有显著的长期效果,一直作为减重代谢手术的“金标准”;但其操作相对复杂、学习曲线较长。与LRYGB相比,LSG具有操作相对简单、创伤较小等优点。国外文献显示[10],LSG已由早期的肥胖患者分期手术中的一期手术发展为独立的治疗肥胖合并糖尿病的术式。Li等[11]采用Meta分析的方法研究了62篇文献共计18 455例患者,结果显示在治疗糖尿病方面,两种手术疗效相近。而且由于我国肥胖患者因人种原因多为腹型肥胖,同等体重指数时腹腔内脂肪体积较欧美患者明显增多,造成腹腔空间小,手术风险、难度增加,因而对于我国重度肥胖患者,LSG可能是较理想的选择。
我们随访发现,LRYGB组胆固醇浓度低于LSG组,差异有统计学意义(P<0.01)。通过查阅文献发现其机制可能是LRYGB术后胆汁要经过较长的消化道才能与食糜结合,因而被乳化吸收的脂质比例降低[12]。然而,减重手术后血糖会发生改善的具体机制及其相关信号通路目前尚未可知。研究表明[13-16],患者减重手术后饥饿激素水平较术前明显减低,而胰高血糖素样肽-1、多肽YY术后水平较术前明显升高。然而这些胃肠激素与手术的关系及具体作用机制仍存在许多未知之处。最新的研究显示[17],减重手术后肠道菌群、细菌代谢产物可能是体重下降的重要原因,然而这些研究仍处于初级阶段,需要更多的数据证实。
综上所述,LSG与LRYGB均可有效治疗重度肥胖合并糖尿病,近期效果显著,且两种治疗方法效果相近,具体的治疗机制及长期疗效仍需大样本、长期的临床随访证实。
参考文献:
[1] Health Quality Ontario.Bariatric surgery for people with diabetes and morbid obesity:an evidence-based analysis[J].Ont Health Technol Assess Ser,2009,9(22):1-23.
[2] Wild S,Roglic G,Green A,et al.Global prevalence of diabetes:estimates for the year 2000 and projections for 2030[J].Diabetes Care,2004,27(5):1047-1053.
[3] Hahl T,Peromaa-Haavisto P,Tarkiainen P,et al.Fast track bariatric surgery[J].Duodecim,2016,132(1):63-70.
[4] 刘金刚,郑成竹,王勇.中国肥胖和2型糖尿病外科治疗指南(2014)[S].中国实用外科杂志,2014,34(11):499-504.
[5] 中华医学会糖尿病学分会.中国2型糖尿病防治指南(2013年版)[S].中华内分泌代谢杂志,2014,30(10):447-498.
[6] Pories WJ,Swanson MS,MacDonald KG,et al.Who would have thought it?An operation proves to be the most effective therapy for adult-onset diabetes mellitus[J].Ann Surg,1995,222(3):339-350.
[7] Zhang C,Yuan Y,Qiu C,et al.A meta-analysis of 2-year effect after surgery:laparoscopic Roux-en-Y gastric bypass versus laparoscopic sleeve gastrectomy for morbid obesity and diabetes mellitus[J].Obes Surg,2014,24(9):1528-1535.
[8] El Chaar M,Hammoud N,Ezeji G,et al.Laparoscopic sleeve gastrectomy versus laparoscopic Roux-en-Y gastric bypass:a single center experience with 2 years follow-up[J].Obes Surg,2015,25(2):254-262.
[9] Buchwald H,Estok R,Fahrbach K,et al.Weight and type 2 diabetes after bariatric surgery:systematic review and meta-analysis[J].Am J Med,2009,122(3):248-256.e5.
[10] Schneider J,Peterli R,Gass M,et al.Laparoscopic sleeve gastrectomy and Roux-en-Y gastric bypass lead to equal changes in body composition and energy metabolism 17 months postoperatively:a prospective randomized trial[J].Surg Obes Relat Dis,2016,12(3):563-570.
[11] Li J,Lai D,Wu D.Laparoscopic Roux-en-Y Gastric Bypass Versus Laparoscopic Sleeve Gastrectomy to Treat Morbid Obesity-Related Comorbidities:a Systematic Review and Meta-analysis[J].Obes Surg,2016,26(2):429-442.
[12] Vix M,Diana M,Liu KH,et al.Evolution of glycolipid profile after sleeve gastrectomy vs. Roux-en-Y gastric bypass:results of a prospective randomized clinical trial[J].Obes Surg,2013,23(5):613-621.
[13] Yousseif A,Emmanuel J,Karra E,et al.Differential effects of laparoscopic sleeve gastrectomy and laparoscopic gastric bypass on appetite,circulating acyl-ghrelin,peptide YY3-36 and active GLP-1 levels in non-diabetic humans[J].Obes Surg,2014,24(2):241-252.
[14] Sista F,Abruzzese V,Clementi M,et al.The effect of sleeve gastrectomy on GLP-1 secretion and gastric emptying:a prospective study[J].Surg Obes Relat Dis,2017,13(1):7-14.
[15] 郭翔,印慨,陈丹磊,等.腹腔镜减重手术对2型糖尿病患者胰高血糖素样肽-1及Ghrelin水平的影响[J].中华外科杂志,2013,51(4):323-327.
[16] Sista F,Abruzzese V,Clementi M,et al.Effect of Resected Gastric Volume on Ghrelin and GLP-1 Plasma Levels:a Prospective Study[J].J Gastrointest Surg,2016,20(12):1931-1941.
[17] Liu R,Hong J,Xu X,et al.Gut microbiome and serum metabolome alterations in obesity and after weight-loss intervention[J].Nat Med,2017,23(7):859-868.
