不同剂量FTY720对蛛网膜下腔出血大鼠炎症因子与神经功能的影响
2018-05-03董晓巧俞文华杨定博沈永锋杜垣峰
董晓巧,俞文华,杜 权,王 昊,杨定博,沈永锋,江 力,杜垣峰,朱 强
免疫反应是蛛网膜下腔出血后继发性脑损伤病理生理机制的重要组成部分[1,2]。FTY720是一种新型的免疫抑制剂,对机体免疫应答具有双向调节作用,抑制免疫反应的同时并不破坏机体对病毒的免疫应答和免疫记忆能力[3~5]。FTY720已经在临床上用于治疗多发性硬化症及器官移植后的排斥反应[6,7]。FTY720腹腔注射可以抑制颅脑损伤大鼠中枢神经系统炎症反应,降低神经细胞凋亡,改善大鼠神经功能[8,9]。FTY720腹腔注射也可以抑制蛛网膜下腔出血大鼠脑炎症反应,改善大鼠认知功能[10]。迄今,鲜见揭示FTY720神经保护的剂量-药效关系相关报道。本研究使用不同剂量FTY720腹腔注射治疗大鼠蛛网膜下腔出血,观察其对脑损伤大鼠海马组织炎症反应和细胞凋亡及神经功能的影响,探讨FTY720神经保护作用的剂量-药效关系。
1 材料与方法
1.1 材料:健康Wistar大鼠(南京大学模式动物研究所,雄性,清洁级,实验动物生产许可证SCXK(苏)2005_0003,使用许可证SYXK(苏)2005_0004);Morris水迷宫(型号:XR_XM101,安徽正华生物仪器设备有限公司);FTY720(规格:25mg,批号:SML0700,美国Sigma公司);酶标仪(型号:MK3,美国Thermo Scientific公司);低温高速离心机(型号:BECKMAN,北京普瑞麦迪实验室技术有限公司);荧光分光光度仪(型号:UV_1202,日本岛津公司);肿瘤坏死因子_α酶联免疫吸附试剂盒(批号:MTA00B,美国R&D公司),白介素_1β酶联免疫吸附试剂盒(批号:M6000B,美国R&D公司),白介素_6酶联免疫吸附试剂盒(批号:MLB00C,美国R&D公司)。
1.2 方法:将48只大鼠随机分成假手术组、模型组、小剂量组和大剂量组,每组12只。大鼠予50mg/kg戊巴比妥钠腹腔注射麻醉,采用Roux等[11]建立的枕大池二次注血法制作蛛网膜下腔出血大鼠模型。假手术组和模型组大鼠予以1ml 0.9%氯化钠注射液腹腔注射,小剂量组和大剂量组大鼠模型形成前0.5h分别予以FTY720 1mg/kg和5mg/kg剂量腹腔注射。24h后,取各组6只大鼠以80mg/kg戊巴比妥钠腹腔注射深度麻醉,断头处死,分离海马组织,用于炎症和细胞凋亡相关指标的测定;各组其余6只大鼠用于神经功能的评估。大鼠模型形成后,假手术组大鼠死亡1只,模型组大鼠死亡3只,小剂量组大鼠死亡2只,大剂量组大鼠死亡1只。大鼠死亡后补充成活大鼠,保证每组12只大鼠。经卡方检验,四组大鼠死亡率差异无统计学意义(χ2=1.80,P>0.05)。
1.3 海马组织炎症和细胞凋亡相关指标测定:取部分海马组织制作匀浆,离心后采用酶联免疫吸附法测定上清液肿瘤坏死因子_α、白介素_1β和白介素_6水平:将标准品和待测样本各50μl依次加入孔中,并做好标记;37℃温育30min后,弃去孔内液体,洗板5次;在各孔中分别加入50μl酶标试剂,37℃温育30min后,弃去孔内液体,洗板5次;在各孔中分别加入100μL显色试剂,37℃避光孵育10min后,每孔加终止液50μL,充分混匀,终止反应;用酶标仪在450nm测定OD值,结果表示为pg/mg脑组织。取部分海马组织制作匀浆,采用四肽荧光底物法检测caspase_3和caspase_9蛋白活性。取100μl脑组织匀浆和10μl caspase_3或caspase_9底物,加入缓冲液至1ml,37℃孵育1h。用荧光分光光度计在激发波长380nm或400nm,释放波长460nm或505nm处测定样本荧光强度,以未加脑组织时的荧光强度为参照值,计算荧光强度,最终比较相对荧光强度,间接反应caspase_3和caspase_9蛋白活性。
1.4 大鼠神经功能评价:参照Vorhees等[12]的方法,在脑损伤后第8、9、10、11和12天对大鼠进行Morris水迷宫定位航行实验,记录大鼠逃避潜伏期,用于反映大鼠的学习能力,从而评价大鼠的认知功能。将大鼠面向池壁分别从两个象限的入水点放入水中,记录其在120s内寻找到平台的时间,即为逃避潜伏期。如果大鼠120s内不能找到平台,则由实验者用手牵引其到平台上停留10s,再放回到笼中,记录时间120s。Chen等[13]的方法,在脑损伤后第14、15、16、17和18天测定大鼠改良神经功能缺损程度评分,包括运动、感觉、反射和平衡试验,最低分为0,最高分为18分,分值越高神经功能损伤越严重。
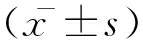
2 结果
2.1 FTY720对大鼠认知功能的影响:在蛛网膜下腔出血后第8、9、10、11和12各个时间点,四组大鼠逃避潜伏期组间比较差异均有统计学意义(均P<0.01);且组间两两比较,差异均有统计学意义(均P<0.05)。采用重复测量方差分析,考虑脑损伤后5个时间点,四组大鼠逃避潜伏期组间比较差异有统计学意义(F=308.86,P<0.01),且模型组逃避潜伏期显著长于假手术组(P<0.05),小剂量组逃避潜伏期较模型组显著缩短(P<0.05),大剂量组逃避潜伏期较小剂量组显著缩短(P<0.05),见表1。

表1 FTY720对大鼠蛛网膜下腔出血后逃避潜伏期的影响
2.2 FTY720对大鼠改良神经功能缺损程度评分的影响:假手术组大鼠改良神经功能缺损程度评分均为最低分,即为0分。在蛛网膜下腔出血后第14、15、16、17和18各个时间点,模型组、小剂量组和大剂量组三组大鼠改良神经功能缺损程度评分组间比较差异均有统计学意义(均P<0.01);且组间两两比较,差异均有统计学意义(均P<0.05)。采用重复测量方差分析,考虑脑损伤后5个时间点,三组大鼠改良神经功能缺损程度评分组间比较差异有统计学意义(F=74.32,P<0.01),且小剂量组大鼠改良神经功能缺损程度评分较模型组显著降低(P<0.05),大剂量组大鼠改良神经功能缺损程度评分较小剂量组显著降低(P<0.05),见表2。

表2 FTY720对大鼠改良神经功能缺损程度评分的影响
2.3 FTY720对大鼠海马组织炎性因子水平及凋亡相关蛋白活性的影响:四组大鼠海马组织白介素_1β、肿瘤坏死因子_α和白介素_6水平及caspase_3和caspase_9蛋白活性组间比较差异均有统计学意义(均P<0.01),且模型组较假手术组大鼠海马组织白介素_1β、肿瘤坏死因子_α和白介素_6水平及caspase_3和caspase_9蛋白活性均显著升高(均P<0.05),小剂量组较模型组大鼠海马组织白介素_1β、肿瘤坏死因子_α和白介素_6水平及caspase_3和caspase_9蛋白活性均显著降低(均P<0.05),大剂量组较小剂量组大鼠海马组织白介素_1β、肿瘤坏死因子_α和白介素_6水平及caspase_3和caspase_9蛋白活性均显著降低(均P<0.05),见表3。
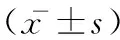
表3 FTY720对大鼠海马组织炎性因子水平及凋亡相关蛋白活性的影响
3 讨论
蛛网膜下腔出血是一种重要的脑损伤形式,可引发脑血管痉挛、脑缺血和神经功能障碍,甚至造成患者死亡[14,15]。脑动脉瘤破裂是蛛网膜下腔出血的主要原因,目前的医疗手段可有效地处理绝大部分脑动脉瘤,但对蛛网膜下腔出血造成的早期脑损伤却缺乏有效的治疗方法。免疫反应参与蛛网膜下腔出血后继发性脑损伤过程[1,2],抑制免疫反应对减少继发性脑损伤有着重要的作用。但临床常规使用的免疫抑制剂可导致全身免疫功能低下,继发感染。因此寻找一种安全有效的免疫抑制剂对于降低蛛网膜下腔出血后脑损伤有着重要意义。
FTY720由冬虫夏草抽提物中具有免疫抑制作用的ISP_I进行结构改造而成的,属于鞘氨醇_1_磷酸盐受体阻滞剂。FTY720作为一种新型的免疫抑制剂,在体外以无活性的形式存在,在体内需经鞘氨醇激酶2磷酸化而转化为具有生物活性的FY720异构体而发挥作用[3~5]。目前,FTY720在临床上主要用于治疗肝肾器官移植后的排斥反应及皮炎、重症肌无力等免疫紊乱/障碍疾病[6,7]。
FTY720用于脑损伤治疗方面的实验研究发展很快。FTY720可有效地阻止体外培养胶质细胞释放炎性因子[16],显著抑制颅脑损伤大鼠脑皮层炎性细胞聚集和炎症因子释放[17],明显抑制动物脑出血后脑内淋巴细胞浸润[18]。本研究发现,FTY720可以有效抑制蛛网膜下腔出血大鼠海马组织白介素_1β、肿瘤坏死因子_α和白介素_6的分泌。这些数据说明,FTY720可有效地抑制蛛网膜下腔出血继发的中枢神经系统炎症反应。
动物实验证实,FTY720可显著降低颅脑损伤大鼠海马组织caspase_3和caspase_9蛋白活性,抑制颅脑损伤大鼠神经细胞凋亡,提高脑损伤大鼠的肢体运动功能和认知功能[8,9];FTY720也可改善短暂性脑缺血和脑出血大鼠肢体运动功能[19,20]。本研究证实,FTY720可显著抑制蛛网膜下腔出血大鼠海马组织caspase_3和caspase_9蛋白活性,缩短逃避潜伏期,改善大鼠的认知功能,提高改良神经功能缺损程度评分,改善神经功能缺损。这些研究结果提示,FTY720可有效地抑制神经细胞凋亡,改善蛛网膜下腔出血大鼠神经功能。
既往的绝大部分动物实验均使用1mg/kg FTY720腹腔注射用于治疗脑出血、脑缺血、脑外伤和蛛网膜下腔出血[8~10,19,20]。但少有研究揭示FTY720治疗脑损伤的剂量和药效关系。本研究选择了FTY720 1mg/kg和5mg/kg两种剂量腹腔注射用于治疗大鼠蛛网膜下腔出血。本研究结果显示,FTY720腹腔注射可剂量依赖性地抑制大鼠海马组织白介素_1β、肿瘤坏死因子_α和白介素_6释放及caspase_3和caspase_9蛋白活性,同时明显改善蛛网膜下腔出血大鼠的认知功能和神经功能缺损。这些现象说明,FTY720对恢复神经细胞结构和功能具有重要作用。由于FTY720本身具有免疫功能抑制作用,而抑制炎症反应降低神经细胞凋亡与改善神经功能具有必然的联系[21~23]。因此,FTY720改善蛛网膜下腔出血大鼠神经功能可能与其抑制中枢神经系统炎症反应及降低神经细胞凋亡有关,而且这种效应呈现剂量依赖性。FTY720对脑损伤作用的更多着落点并非其作用于免疫系统,而是稳定地穿过血脑屏障,直接作用于中枢神经系统内的1_磷酸鞘氨醇受体,能通过上调神经营养因子表达、下调凋亡基因表达、受体激活或功能性内化等方式对中枢内神经元、星形胶质细胞、少突胶质细胞、小胶质细胞、微血管产生生物调节作用[24,25]。因此,在解释FTY720对脑损伤保护的机制方面需要保持谨慎态度。
[1]Lee CI, Chou AK, Lin CC, et al. Immune and inflammatory gene signature in rat cerebrum in subarachnoid hemorrhage with microarray analysis[J]. Mol Med Rep,2012,5(1):118-125.
[2]Ayer RE, Ostrowski RP, Sugawara T, et al. Statin_induced T_lymphocyte modulation and neuroprotection following experimental subarachnoid hemorrhage[J]. Acta Neurochir Suppl,2013,115:259-266.
[3]White C, Alshaker H, Cooper C, et al. The emerging role of FTY720 (Fingolimod) in cancer treatment[J]. Oncotarget,2016,7(17):23106-23127.
[4]Patmanathan SN, Yap LF, Murray PG, et al. The antineoplastic properties of FTY720: evidence for the repurposing of fingolimod[J]. J Cell Mol Med,2015,19(10):2329-2340.
[5]Estella_Hermoso de Mendoza A, Castello_Cros R, Imbuluzqueta E, et al. Lipid Nanosystems Enhance the Bioavailability and the Therapeutic Efficacy of FTY720 in Acute Myeloid Leukemia[J]. J Biomed Nanotechnol,2015,11(4):691-701.
[6]Luessi F, Kraus S, Trinschek B, et al. FTY720 (fingolimod) treatment tips the balance towards less immunogenic antigen_presenting cells in patients with multiple sclerosis[J]. Mult Scler,2015,21(14):1811-1822.
[7]Gholamnezhadjafari R, Falak R, Tajik N, et al. Effect of FTY720 (fingolimod) on graft survival in renal transplant recipients: a systematic review protocol [J]. BMJ Open,2016,6(4):e010114.
[8]蔡建勇,林群,巴华君,等.FTY720对颅脑损伤大鼠神经细胞凋亡的抑制作用[J].浙江医学,2016,38(11):776-778.
[9]蔡建勇,吴艳,巴华君,等.FTY720改善颅脑损伤大鼠神经功能的机制研究[J].中华危重症医学杂志,2016,9(4):240-244.
[10]董晓巧,俞文华,杜权,等.芬戈莫德改善蛛网膜下腔出血大鼠认知功能及其机制研究[J].中华危重症医学杂志,2017,10(1):18-22.
[11]Roux S, Løffler BM, Gray GA, et al. The role of endothelin in experimental cerebral vasospasm[J]. Neurosurgery,1995,37(1):78-85.
[12]Vorhees CV, Williams MT. Morris water maze: procedures for assessing spatial and related forms of learning and memory[J]. Nat Protoc,2006,1(2):848-858.
[13]Chen J, Li Y, Wang L, et al. Therapeutic benefit of intravenous administration of bone marrow stromal cells after cerebral ischemia in rats[J]. Stroke,2001,32(4):1005-1011.
[14]Fujii M, Yan J, Rolland WB, et al. Early brain injury, an evolving frontier in subarachnoid hemorrhage research [J]. Transl Stroke Res,2013,4(4):432-446.
[15]Yuksel S, Tosun YB, Cahill J, et al. Early brain injury following aneurysmal subarachnoid hemorrhage: emphasis on cellular apoptosis[J]. Turk Neurosurg,2012,22(5):529-533.
[16]Janssen S, Schlegel C, Gudi V, et al. Effect of FTY720_phosphate on the expression of inflammation_associated molecules in astrocytes in vitro[J]. Mol Med Rep,2015,12(4):6171-6177.
[17]Zhang Z, Zhang Z, Fauser U, et al. FTY720 attenuates accumulation of EMAP_II+ and MHC_II+ monocytes in early lesions of rat traumatic brain injury[J]. J Cell Mol Med,2007,11(2):307-314.
[18]Rolland WB, Lekic T, Krafft PR, et al. Fingolimod reduces cerebral lymphocyte infiltration in experimental models of rodent intracerebral hemorrhage[J]. Exp Neurol,2013,241(1):45-55.
[19]Hasegawa Y, Suzuki H, Sozen T, et al. Activation of sphingosine 1_phosphate receptor_1 by FTY720 is neuroprotective after ischemic stroke in rats[J]. Stroke,2010,41(2):368-374.
[20]Rolland WB, Manaenko A, Lekic T, et al. FTY720 is neuroprotective and improves functional outcomes after intracerebral hemorrhage in mice[J]. Acta Neurochir Suppl,2011,111(2):213-217.
[21]Serrone JC, Maekawa H, Tjahjadi M, et al. Aneurysmal subarachnoid hemorrhage: pathobiology, current treatment and future directions[J]. Expert Rev Neurother,2015,15(4):367-380.
[22]Tso MK, Macdonald RL. Subarachnoid hemorrhage: a review of experimental studies on the microcirculation and the neurovascular unit[J]. Transl Stroke Res,2014,5(2):174-189.
[23]Wan H, AlHarbi BM, Macdonald RL. Mechanisms, treatment and prevention of cellular injury and death from delayed events after aneurysmal subarachnoid hemorrhage[J]. Expert Opin Pharmacother,2014,15(2):231-243.
[24]Zhang L, Ding K, Wang H, et al. Traumatic Brain Injury_Induced Neuronal Apoptosis is Reduced Through Modulation of PI3K and Autophagy Pathways in Mouse by FTY720[J]. Cell Mol Neurobiol,2016,36(1):131-142.
[25]Stessin AM, Gursel DB, Schwartz A, et al. FTY720, sphingosine 1_phosphate receptor modulator, selectively radioprotects hippocampal neural stem cells[J]. Neurosci Lett,2012,516(2):253-258.
