海蜇胶原蛋白肽的生物活性研究
2018-05-01李玉芬郑明星叶秀云
李玉芬,郑明星,叶秀云,林 娟
(福州大学,福建省海洋酶工程实验室,福建福州 350116)
胶原蛋白是细胞外基质的结构蛋白,是结缔组织的主要组成成分,一般为白色纤维,广泛分布在多细胞动物体内,胶原蛋白中存在着多种生物活性肽,生物活性肽是一类由氨基酸组成的拥有特殊生理活性的多肽总称(其氨基酸数目一般小于50,分子量小于6 ku),根据其氨基酸种类和排列方式的不同,多肽呈现的生理活性也各不相同,即使相同蛋白来源的多肽也可能拥有不同的功能活性[1]。生物活性肽参与人体多种代谢和生理调节,易吸收利用,活性高,具有良好的溶解性、黏度性、流动性和热稳定性,有免疫调节、抗菌、抗病毒、降血压、降血脂、降胆固醇、抗疲劳、抗氧化、美白和调味等作用,食用安全性高,是当前食品科学界最热门的研究课题,极具发展前景[2-4]。由于哺乳动物体内存在大量的胶原蛋白,长期以来,工业上胶原蛋白的提取原料大部分都来源于猪皮、牛皮和羊皮等,但是近几年,由于口蹄疫、禽流感等家畜传染病的影响,人们对于家畜来源制品安全性的不信任感增强,再者某些地区的宗教习俗等原因,对家畜制品也会有排斥心理,因此,寻找动物毛皮以外的胶原蛋白来源成为新的课题方向。海洋来源的胶原蛋白拥有其他来源的胶原蛋白所不可比拟的优点,备受消费者青睐。目前,工业上也已开始利用鱼鳞、鱼皮等资源制备胶原蛋白产品;也有研究工作者探讨了海蜇来源胶原蛋白的制备工艺,但由于其技术上的一些问题导致海蜇来源的胶原蛋白制品还不能应用于工业生产。本文旨在解决海蜇产品在工业上的应用难题,为推进胶原蛋白的工业化生产和提高海蜇高值化利用提供理论指导。
本实验前期进行了海蜇加工下脚料胶原蛋白的提取[5],在此研究的基础上,进一步通过生物酶解方法制备胶原蛋白肽,并对不同分子量胶原蛋白肽的抗氧化活性、血管紧张素转换酶(ACE)抑制活性和酪氨酸酶双酚酶抑制活性进行表征,为海蜇的高值化利用提供理论指导。
1 材料与方法
1.1 材料与仪器
海蜇加工下脚料 主要是来自福建亿达食品有限公司所提供的南蛰海蜇皮,海蜇体呈伞盖状,通体呈半透明;福林试剂、谷胱甘肽、胃蛋白酶(1.58 U/mg)、胰蛋白酶(4.40 U/mg)、还原型谷胱甘肽 国药集团;风味蛋白酶(7.62 U/mg)、木瓜蛋白酶(13.73 U/mg)、中性蛋白酶(9.02 U/mg)、碱性蛋白酶(84.63 U/mg) Solarbio公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、ACE、马尿酰-组氨酰-亮氨酸(HHL)、马尿酸、Tyrosinase Sigma公司;DPPH Aladdin公司。
T6型新世纪紫外可见分光光度计 北京普析通用仪器有限责任公司;HWS24型电热恒温水浴锅 上海一恒科技有限公司;TP-114型分析天平 DENVER INSTRVMENT;UB-7pH计 DENVER INSTRVMENT;CF16R-XI型高速冷冻离心机 HITACHI;移液枪 Eppendorf;L-2455DAD型高效液相色谱仪 Hitachi;1510型酶标仪 Thermo Fisher Scientific;VFD-2000型真空冷冻干燥机 Labconco;611DI型超纯水系统 Sartorius stedim;MJ-BL 25H11搅拌机 广东美的生活电器制造有限公司。
1.2 实验方法
1.2.1 海蜇胶原蛋白肽的提取 将海蜇加工下脚料用清水冲洗,将除盐的海蜇用搅拌机搅碎20 min,过滤沥干;添加丙酮溶液没过海蜇,静置1 d,蒸馏水清洗至无异味,过滤沥干;置于0.1 mol/L磷酸氢二钠溶液中浸泡三次,每3 h更换一次溶液,蒸馏水清洗至中性,过滤沥干,4 ℃冰箱存放备用。
取一定质量的海蜇皮匀浆,加入一定体积相应pH7.39的磷酸盐缓冲液至0.50 g/mL,添加4.0%风味蛋白酶,置于44.1 ℃的温度条件下酶解4 h,温度43.5 ℃、pH8.33的Tris-HCl缓冲液、料液比0.50 g/mL和胰蛋白酶添加量3.0%条件下继续反应4 h,待反应结束后,将酶解液置于沸水浴中加热10 min使蛋白酶失活,13000×g离心10 min,取上清多肽液放于4 ℃冰箱中备用[5]。
1.2.2 不同分子量胶原蛋白肽的制备 将上述最佳海蜇蛋白肽制备工艺获得的酶解液,采用截留分子量为10 kDa的中空纤维超滤膜进行处理,将各组分进行旋转蒸发浓缩,于-80 ℃冷冻干燥成粉,并置于常温干燥器中短期保藏备用。
1.2.3 还原力的测定 参考Liu等[6]的方法,略有修改。在15 mL试管中,依次加入1 mL不同浓度的多肽样品、2.5 mL 0.2 mol/L的磷酸盐缓冲液(pH6.6)和2.5 mL 1%的铁氰化钾溶液;置于50 ℃水浴反应20 min,加入1 mL 10%的三氯乙酸终止反应;取上述溶液2.5 mL,加入2.5 mL蒸馏水和0.5 mL 0.1%的FeCl3溶液,于700 nm处测定其吸光值。吸光值越大表明样品的还原力越高。以蒸馏水作为空白对照,同时以谷胱甘肽(GSH)作为阳性对照。其IC50值定义为相对空白组吸光值为0.5时的有效多肽浓度。
1.2.4 羟自由基清除能力 参考Zhou等[7]的方法,略有修改。在15 mL试管中,依次加入不同浓度的样品、dH2O、3.0 mmol/L的FeSO4、9.0 mmol/L的H2O2和9.0 mmol/L的水杨酸各1.0 mL,摇匀;于37 ℃水浴反应30 min后,流水冷却至室温,于波长510 nm下测定其吸光值;以蒸馏水作空白对照,同时以GSH作为阳性对照,所有实验进行三组平行。按式(1)计算其对羟自由基的清除率:
羟自由基清除率(%)=(A1-A2)/A0×100
式(1)
式中:A1是样品溶液+双氧水的吸光度,A2是去离子水+双氧水的吸光度,A0是空白对照的吸光度。
其半抑制浓度IC50值定义为50%羟自由基清除率时的有效多肽浓度。
1.2.5 1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除能力 参考Fan等[8]的方法,略有修改。取溶于0.1 mol/L磷酸盐缓冲液(PBS)(pH6.0)的不同浓度样品1.0 mL,加入2.0 mL 45 mg/L的DPPH乙醇溶液(现用现配)并摇匀,置于暗处反应30 min,于517 nm处测定其吸光值;以0.1 mol/L PBS缓冲液代替样品作空白对照,同时以GSH作为阳性对照,所有实验进行三组平行。按以式(2)计算对DPPH自由基的清除率:
DPPH自由基清除率(%)=(A0-A1)/A0×100
式(2)
式中:A0为空白组吸光值;A1为实验组吸光值。
其半抑制浓度IC50值定义为50%DPPH自由基清除率时的有效多肽浓度。
1.2.6 超氧阴离子自由基清除能力 参考Girgih等[9]的方法,略有修改。在15 mL试管中,依次加入1 mL 0.1 mol/L Tris-HCl缓冲液(pH8.3,含1 mmol/L EDTA)、1 mL上述缓冲液配制的不同浓度的样品和0.5 mL 1.5 mmol/L连苯三酚(含10 mmol/L HCl),迅速摇匀,立即于420 nm处测定其在4 min内的吸光值变化;以蒸馏水作空白对照,同时以GSH作为阳性对照,所有实验进行三组平行。按下式(3)计算对超氧阴离子自由基的清除率:
式(3)
式中:ΔA0为空白组在4 min内吸光值变化;ΔA1为实验组在4 min内吸光值变化。
其半抑制浓度IC50值定义为50%超氧阴离子自由基清除率时的有效多肽浓度。
1.2.7 ABTS+自由基清除能力 参考Liu等[10]的方法,略有修改。配制7 mmol/L的 ABTS母液和2.45 mmol/L的过硫酸钾,等体积混合,静置于暗处12~16 h;使用前,将ABTS混合液用蒸馏水稀释50倍,使其在734 nm处的吸光值为0.900左右。
取不同浓度的的样品1.0 mL,加入3.0 mL ABTS+溶液并摇匀,置于30 ℃水浴反应6 min,于734 nm处测定其吸光值;以蒸馏水作空白对照,同时以GSH作为阳性对照,所有实验进行三组平行。按式(4)计算对ABTS+自由基的清除率:

式(4)
式中:A0为空白组吸光值;A1为实验组吸光值。
其半抑制浓度IC50值定义为50% ABTS+自由基清除率时的有效多肽浓度。
1.2.8 ACE抑制活性评价 参考Liu X等[11]的方法,取不同浓度的的样品10 μL,依次加入30 μL的 硼酸缓冲液和10 μL 10.0 mmol/L的HHL溶液并于37 ℃孵育10 min;加入10 μL 0.1 U/mL的ACE溶液,置于37 ℃水浴准确反应60 min;添加60 μL 1 mol/L的HCl溶液终止反应,作为待测样品备用;空白组在加入ACE前预先加入60 μL 1 mol/L的HCl溶液以提前终止反应,其他操作与实验组相同。根据上述实验方法,再由标准曲线测定生成产物马尿酸的含量,进而按式(5)计算得出ACE抑制率:
式(5)
式中:n0为空白组马尿酸浓度;n1为实验组马尿酸浓度。
其半抑制浓度IC50值定义为ACE抑制率为50%时的有效多肽浓度。
1.2.9 酪氨酸酶双酚酶抑制活性评价 根据抑制剂能否引起酶的不可逆性失活,可将酶抑制剂的抑制类型分为不可逆抑制与可逆抑制,本文对具有最高酪氨酸酶抑制活性的多肽组分的抑制类型进行了抑制类型的测定;根据抑制剂与酶结合的方式,可将可逆抑制分为竞争性抑制、非竞争性抑制和混合型抑制等。并对最高酪氨酸酶抑制活性的多肽组分的抑制作用机理进行了进一步的研究:固定蘑菇酪氨酸酶浓度,改变3,4-二羟苯丙氨酸-L-丙氨酸(L-DOPA)浓度,考察不同浓度JCP1对酶活力的影响,采用双倒数作图法(Lineweaver-Burk),判断酪氨酸酶的抑制类型。
1.2.9.1 酪氨酸酶双酚酶抑制活性 参考靳春平等[12-13]的方法,于96孔板中,添加0、10、20、30、40、50、60、70、80、90、100 μL的多肽样品,用0.05 mol/L的PBS缓冲液(pH6.8)补足至200 μL,再依次加入60 μL 2.5 mmol/L的L-多巴和40 μL 0.06 mg/mL的蘑菇酪氨酸酶溶液,迅速混匀,并于475 nm处检测30 s内吸光值变化;按式(6)计算其酪氨酸酶双酚酶抑制率:
式(6)
式中:ΔA0为空白组在30 s内吸光值变化;ΔA1为实验组在30 s内吸光值变化。
其半抑制浓度IC50值定义为酪氨酸酶双酚酶抑制率为50%时的有效多肽浓度。
1.2.9.2 海蜇胶原蛋白肽对酪氨酸酶双酚酶的抑制类型 在上述300 μL反应体系中,保持底物L-多巴终浓度不变,改变酪氨酸酶终浓度(1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0和10.0 μg/mL),测定不同酪氨酸酶浓度下不同浓度JCP1(0、6.67、13.33、20.00、26.67、33.33 mg·mL-1)对酪氨酸酶双酚酶初始反应速率的影响,消光系数按3700 L/mol/cm计算。
1.2.9.3 海蜇胶原蛋白肽对酪氨酸酶双酚酶的抑制动力学参数 参考王庆华等[14]的方法在300 μL反应体系中,保持酪氨酸酶浓度不变,改变底物L-多巴的终浓度(0.100、0.133、0.200、0.333、0.400、0.500、0.667、0.800和1.000 mol/L),测定不同L-多巴浓度下不同浓度JCP1(0、6.67、13.33、20.00、26.67、33.33 mg·mL-1)样品对酪氨酸酶双酚酶初始反应速率的影响,采用Lineweaver-Burk作图法判断多肽的抑制类型并求出酶反应抑制动力学参数。
2 结果与分析
2.1 不同分子量的胶原蛋白肽
采用截留分子量为10 kDa的中空纤维超滤膜进行处理,得到分子量范围为分子量>10 kDa(JCP1)和<10 kDa的多肽,继续对<10 kDa的多肽组分依次使用截留分子量为3 kDa和1 kDa的超滤离心管进行超滤处理,得到分子量3~10 kDa(JCP2)、分子量1~3 kDa(JCP3)和分子量<1 kDa JCP4三种组分。
2.2 不同分子量胶原蛋白肽的抗氧化活性
2.2.1 还原力的测定 由图1和图2可知,GSH的还原力比不同分子量胶原蛋白肽好,GSH的IC50值为0.190 mg/mL(图1);各组分还原力随多肽浓度的增大而增大,呈线性关系(图2)。各组分的IC50值在14.9~29.3 mg/mL之间;其中组分JCP3的IC50值最低,为14.9 mg/mL,表明其具有较其它组分更强的还原力;JCP1的IC50值最高,达29.3 mg/mL。根据相应的IC50值,各组分还原力由高到低依次为JCP3(14.9 mg/mL)>JCP4(16.9 mg/mL)>JCP2(20.4 mg/mL)>JCP1(29.3 mg/mL)。通过比较可知,各组分的还原力都不及GSH。

图1 GSH的还原力Fig.1 Reducing power of glutathione

图2 不同分子量海蜇胶原蛋白肽组分的还原力Fig.2 Reducing power of different fractions of jellyfish collagen peptide注:JCP1:MW>10 kDa;JCP2:MW 3~10 kDa; JCP3:MW 1~3 kDa;JCP4:MW<1 kDa;图4、图6、图8、图10~图12同。
2.2.2 羟自由基清除能力的测定 GSH的IC50为1.50 mg/mL(图3)。不同分子量海蜇胶原蛋白肽的羟自由基清除能力大小如下图4所示。图4表明,各组分羟自由基清除能力均随多肽浓度的增大而增大。图4表明,各组分的IC50值在2.21~3.51 mg/mL之间;其中组分JCP3的羟自由基清除能力较其他组分高,其IC50值最低,为2.21 mg/mL;JCP1、JCP2和JCP4组分的IC50值相差不大,表明其对羟自由基清除能力比较接近。根据相应的IC50值,各组分羟自由基清除能力由高到低依次为JCP3(2.21 mg/mL)>JCP2(3.06 mg/mL)>JCP1(3.10 mg/mL)>JCP4(3.51 mg/mL)。通过比较可知,各组分的还原力都不及GSH。

图3 GSH的羟自由基清除能力Fig.3 Hydroxyl radical scavenging activity of glutathione

图4 不同分子量海蜇胶原蛋白肽组分的羟自由基清除能力Fig.4 Hydroxyl radical scavenging activity of different fractions of jellyfish collagen peptide
2.2.3 DPPH自由基清除能力的测定 GSH的IC50值为0.267 mg/mL(图5);由图6可知,各组分DPPH自由基清除能力随多肽浓度的增大而增大,均在20 mg/mL之后趋于平缓。各组分的IC50值在28.3~44.0 mg/mL之间;其中组分JCP4的IC50值最低,为28.3 mg/mL;JCP1的IC50值最高,达44.0 mg/mL。根据相应的IC50值,各组分DPPH自由基清除能力由高到低依次为JCP4(28.3 mg/mL)>JCP2(36.6 mg/mL)>JCP3(37.3 mg/mL)>JCP1(44.0 mg/mL)。结果表明,分子量较低的多肽可能拥有更好的DPPH自由基清除能力。Onuh等[15]研究发现鸡皮蛋白酶解物中分子量<1 kDa的多肽组分表现出最高的DPPH自由基清除能力,这与我们的结果相符。也有研究表明[18],分子量较高的多肽其DPPH自由基清除能力明显高于低分子量多肽组分。通过比较可知,各组分的还原力都不及GSH。
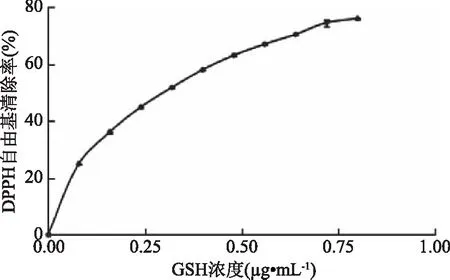
图5 GSH的DPPH自由基清除能力Fig.5 DPPH radical scavenging activity of glutathione

图6 不同分子量海蜇胶原蛋白肽组分的DPPH自由基清除能力Fig.6 DPPH radical scavenging activity of different fractions of jellyfish collagen peptide
2.2.4 超氧阴离子自由基清除能力的测定 GSH的0.037 mg/mL(图7)。图8表明,各组分超氧阴离子自由基清除能力均随多肽浓度的增大而增大。各组分的IC50值在22.6~30.6 mg/mL之间;根据相应的IC50值,各组分超氧阴离子自由基清除能力由高到低依次为JCP1(22.6 mg/mL)>JCP2(23.7 mg/mL)>JCP3(26.3 mg/mL)>JCP4(30.6 mg/mL)。结果表明,分子量与超氧阴离子自由基清除能力呈正相关。Saidi等[16]发现金枪鱼肌肉蛋白副产物的水解产物中,>1 ku分子量范围的多肽组分具有更高的超氧阴离子自由基清除能力,这与我们的结果类似。

图7 GSH的超氧阴离子自由基清除能力Fig.7 Super oxide anion radical scavenging activity of glutathione

图8 不同分子量海蜇胶原蛋白肽组分的超氧阴离子自由基清除能力Fig.8 Super oxide anion radical scavenging activity of different fractions of jellyfish collagen peptide
2.2.5 ABTS+自由基清除能力的测定 GSH的IC50值为0.015 mg/mL(图9)。不同分子量海蜇胶原蛋白肽的ABTS+自由基清除能力大小如下图10所示。图10表明,各组分ABTS+自由基清除能力均与多肽浓度呈正相关。JCP3组分的ABTS+自由基清除能力最好,其IC50值为0.61 mg/mL。根据相应的IC50值,各组分超氧阴离子自由基清除能力由高到低依次为JCP3(0.61 mg/mL)>JCP2(0.70 mg/mL)>JCP4(0.72 mg/mL)>JCP1(0.73 mg/mL)。Alashi等[17]发现油菜籽酶解物具有强ABTS+自由基清除能力,其中<1 ku多肽组分的活性最好;Ngoh等[18]发现斑豆酶解物中<3 ku的多肽组分具有最高的ABTS+自由基清除能力,这与我们的结果类似。

图9 GSH的ABTS+自由基清除能力Fig.9 ABTS radical scavenging activity of glutathione

图10 不同分子量海蜇胶原蛋白肽 组分的ABTS自由基清除能力Fig.10 ABTS radical scavenging activity of different fractions of jellyfish collagen peptide
2.3 不同分子量胶原蛋白肽的ACE抑制活性
由图11表明,各组分的ACE抑制率随多肽浓度变化的趋势相同,在20 mg/mL之前,ACE抑制率随多肽浓度的增加迅速增大,之后增长趋于平缓;不同组分在高浓度时表现的ACE抑制率稳定值略有差异,JCP3组分最高为80%,JCP1组分最低为55%;在相同浓度下,最低分子量组分JCP4较JCP3组分抑制率低,组分JCP1和JCP2的ACE抑制活性最弱;根据相应的IC50值,各组分ACE抑制活性由高到低依次为JCP3(15.8 mg/mL)>JCP4(22.4 mg/mL)>JCP2(56.9 mg/mL)>JCP1(61.5 mg/mL)。

图11 不同分子量海蜇胶原蛋白肽组分ACE抑制活性Fig.11 ACE inhibitor activity of different fractions of jellyfish collagen peptide
2.4 不同分子量胶原蛋白肽的酪氨酸酶双酚酶抑制活性
不同分子量海蜇胶原蛋白肽组分的酪氨酸酶双酚酶抑制活性表明,分子量最大的组分JCP1较其他组分具有更高的酪氨酸酶双酚酶抑制活性,其IC50值为11.96 mg/mL;其他三种组分JCP2、JCP3和JCP4的活性相差不大;根据相应的IC50值,各组分酪氨酸酶双酚酶抑制活性由高到低依次为JCP1(11.96 mg/mL)>JCP2(24.68 mg/mL)>JCP4(27.43 mg/mL)>JCP3(29.51 mg/mL)。
从已有的研究中发现,具有酪氨酸酶抑制活性的多肽分子量一般都比较小,均在1 ku以下;Hsiao等[19]从47263种自然化合物中筛选出了两种具有高酪氨酸酶抑制能力的多肽,分别为RCY和CRY;Oh等[20]从海洋微藻中分离纯化出一个对黑色素生成具有抑制作用的多肽,其分子量为526 u;这与本文获得的大分子量组分具有更高抑制活性的结果有点差异,分析其原因,可能是因为在海蜇胶原蛋白肽的制备过程中是以还原力而非酪氨酸酶抑制活性为指标的缘故,进一步利用不同蛋白酶酶解优化胶原蛋白肽的制备工艺是获得具更高酪氨酸酶抑制活性多肽的有效办法。

图12 不同分子量海蜇胶原蛋白肽组分酪氨酸酶双酚酶抑制活性Fig.12 Effect of different fractions of jellyfish collagen peptide on the activity of tyrosinase
图13表明,随着JCP1浓度的增大,酪氨酸酶双酚酶活力随酶浓度变化曲线的直线斜率减小,说明JCP1对酪氨酸酶双酚酶酶的抑制类型均属于可逆抑制,增加JCP1浓度导致的酶催化效率降低是由于抑制了酪氨酸酶活力,而不是减少其有效酶量。

图13 不同JCP1浓度下酶活力和酶量的关系Fig.13 Effect of different concentrations of JCP1 fraction on the activity of tyrosinase
从图14获得一组交于第二象限的直线,其横轴和纵轴截距均随JCP1浓度的增大而增大,说明米氏常数Ks随JCP1浓度的增大而增大,最大反应速度Vm随JCP1浓度的增大而减小,JCP1的抑制类型为混合型抑制。以斜率(Slope)和纵轴截距(Intercept)对JCP1浓度进行二次作图,分别求出JCP1对游离酶的抑制常数KI和对酶-底物络合物的抑制常数KIS分别为4.55 g/L和32.04 g/L,JCP1对酶-底物络合物的抑制强度是游离酶的7倍,其抑制程度随底物浓度的增加而增大。

图14 JCP1对酪氨酸酶双酚酶抑制作用的 Lineweaver-Burk双倒数作图Fig.14 Lineweaver-Burk plots for inhibition of JCP1 on the oxidant of L-DOPA by tyrosinase
3 结论
对海蜇胶原蛋白肽进行超滤分离,得到4个不同分子量的多肽组分JCP1(>10 ku)、JCP2(3~10 ku)、JCP3(1~3 ku)和JCP4(<1 ku),不同分子量海蜇胶原蛋白肽组分表现出不同的生物活性;JCP1具有最强的超氧阴离子自由基清除能力和酪氨酸酶双酚酶抑制效果,其IC50值分别为为22.6、11.96 mg/mL;JCP3具有最强的还原力、羟自由基清除能力、ABTS+自由基清除能力和ACE抑制活性,其IC50值分别为14.9、2.21、0.61和15.8 mg/mL;JCP4具有最强的DPPH自由基清除能力,其IC50值为28.3 mg/mL。
[1]王竹清,李八方. 生物活性肽及其研究进展[J]. 中国海洋药物,2010(2):60-68.
[2]赵利,苏伟,胡火根,等. 胶原蛋白生物活性肽的研究进展[J]. 食品科学,2005,26(9):578-582.
[3]陈华,易湘茜,陈忻,等. 海洋胶原蛋白肽的制备及生物活性研究进展[J]. 中国食物与营养,2010(8):57-60.
[4]任俊凤. 河豚鱼皮胶原蛋白肽的制备及其抗氧化性的研究[D]. 大连:大连工业大学,2008.
[5]李玉芬,郑明星,叶秀云,等.海蜇胶原蛋白肽的酶解制备工艺[J].食品工业科技,2018,39(7):132-139.
[6]Liu J,Jin Y,Lin S,et al. Purification and identification of novel antioxidant peptides from egg white protein and their antioxidant activities[J]. Food Chemistry,2015,175:258-266.
[7]Zhou C,Hu J,Ma H,et al. Antioxidant peptides from corn gluten meal:Orthogonal design evaluation[J]. Food Chemistry,2015,187:270-278.
[8]Fan L,Min P,Zhou X,et al. Modification of carboxymethyl cellulose grafted with collagen peptide and its antioxidant activity[J]. Carbohydrate Polymers,2014,112(21):32-38.
[9]Girgih A T,He R,Hasan F M,et al. Evaluation of theinvitroantioxidant properties of a cod(Gadus morhua)protein hydrolysate and peptide fractions[J]. Food Chemistry,2015,173:652-659.
[10]Canabady-Rochelle L L S,Harscoat-Schiavo C,Kessler V,et al. Determination of reducing power and metal chelating ability of antioxidant peptides:Revisited methods[J]. Food Chemistry,2015,183:129-135.
[11]Liu X,Zhang M,Jia A,et al. Purification and characterization of angiotensin I converting enzyme inhibitory peptides from jellyfish Rhopilema esculentum[J]. Food Research International,2013,50(1):339-343.
[12]靳春平,张海萍,杨明英,等. 丝胶蛋白及其酶解产物的保湿与抗氧化和抑制酪氨酸酶活性分析[J]. 蚕业科学,2013,39(6):1166-1171.
[13]Chen X X,Zhang J,Chai W M,et al. Reversible and competitive inhibitory kinetics of amoxicillin on mushroom tyrosinase[J]. International Journal of Biological Macromolecules,2013,62(11):726-733.
[14]王庆华,何云,王晓艺. 复合抑制剂对酪氨酸酶反应动力学的影响[J]. 食品研究与开发,2015(19):36-40.
[15]Onuh J O,Girgih A T,Aluko R E,et al.Invitroantioxidant properties of chicken skin enzymatic protein hydrolysates and membrane fractions[J]. Food Chemistry,2014,150:366-373.
[16]Saidi S,Deratani A,Belleville M P,et al. Antioxidant
properties of peptide fractions from tuna dark muscle protein by-product hydrolysate produced by membrane fractionation process[J]. Food Research International,2014,65:329-336.
[17]Alashi A M,Blanchard C L,Mailer R J,et al. Antioxidant properties of Australian canola meal protein hydrolysates[J]. Food Chemistry,2014,146(3):500-506.
[18]Ngoh Y Y,Gan C Y. Enzyme-assisted extraction and identification of antioxidative andα-amylase inhibitory peptides from Pinto beans(Phaseolusvulgariscv. Pinto)[J]. Food Chemistry,2016,190:331-337.
[19]Nai-Wan H,Tien-Sheng T,Yu-Ching L,et al. Serendipitous discovery of short peptides from natural products as tyrosinase inhibitors[J]. Journal of Chemical Information & Modeling,2014,54(11):3099-3111.
[20]Oh G W,Ko S C,Heo S Y,et al. A novel peptide purified from the fermented microalgaPavlovalutheriattenuates oxidative stress and melanogenesis in B16F10 melanoma cells[J]. Process Biochemistry,2015,50(8):1318-1326.
