猴头菇多糖的乙酰化修饰及其抗氧化活性研究
2018-05-01王华丽林晓颖陈义勇
徐 兵,王华丽,林晓颖,陈义勇
(常熟理工学院,生物与食品工程学院,江苏常熟 215500)
猴头菇(Hericiumerinaceus,HE)是一类罕有珍稀的药用菌,其子实体外形象猴子的头,味美可食,富含多种营养成分,并且还含有16种氨基酸,其中有8种为人体必需氨基酸,并且比例与人体需要的氨基酸相接近[1-2]。猴头菇多糖(HEP)可以控制细胞分裂速度,调控细胞分裂,衰老程度,经研究发现,可以用作免疫促进剂[3]。同时,猴头菇多糖还具有降低血糖血脂[4]、促进胃的健康[5]、提高免疫力[6]等生理作用,用其制成的医药保健品及功能性食品深受消费者喜爱,具有广阔的市场前景[7]。
乙酰化修饰是糖类物质的一种常见的修饰方法。目前,多糖的乙酰化修饰的研究主要集中在灵芝多糖[8]、南瓜多糖[9]、青钱柳叶多糖[10]、松树蕈多糖[11]等,对猴头菇多糖的研究仅限于提取、纯化方面[12-13],关于对其乙酰化修饰的研究还未见报道。为此,本文对猴头菇多糖乙酰化修饰进行研究探讨。研究料液比(多糖与乙酸酐的比例,g/mL)、反应温度以及反应时间对多糖乙酰化修饰的影响。在单因素实验基础上采用响应面分析法对乙酰化工艺进行优化,并探讨乙酰化猴头菇多糖的抗氧化活性,旨在为猴头菇多糖在保健食品领域应用奠定基础。
1 材料与方法
1.1 材料与仪器
猴头菇 东北黑龙江海成科技有限公司;乙酸酐、NaOH、浓盐酸、无水乙醇、DPPH、水杨酸、NaNO2、双氧水、硫酸亚铁、硝酸钠等 以上试剂均为国产分析纯。
RE-52A型旋转蒸发仪 上海亚荣仪器厂;HH-22型恒温数显水浴锅 金坛杰瑞尔有限公司;HK-20B型 1000 g摇摆式高速粉碎机 广州旭朗机械设备有限公司;722型分光光度计 上海金华科技仪器有限公司);Z326K型离心机 Hermle labor technik;DFS-101S集热式恒温加热磁力搅拌器 巩义予华仪器有限公司;DHG-P030A型电热恒温鼓风干燥箱 上海三发仪器有限公司;FE20 pH计 梅特勒-托利多仪器上海有限公司;NICOLET 380傅立叶变换红外光谱仪 美国Thermo公司。
1.2 实验方法
1.2.1 猴头菇多糖的提取 将猴头菇置入30 ℃鼓风干燥箱干燥,粉碎,过40目筛。取50.0 g猴头菇粉,按固液比1∶40 g/mL加入2 L蒸馏水,80 ℃水浴4 h得到猴头菇的初提液,经4500 r/min离心10 min,取上清液,经Sevag法脱蛋白、过氧化氢脱色得到洗脱液,将洗脱液旋蒸至一定体积,以1∶4的比例加入无水乙醇进行醇沉,静置12 h,经10000 r/min离心10 min,取沉淀,在40 ℃条件下恒温鼓风干燥24 h,取出后研磨成粉状,过60目筛,即为HEP样品,经苯酚-硫酸法测定[14-15],以葡萄糖浓度为横坐标,OD490为纵坐标,绘制标准曲线。
1.2.2 猴头菇多糖的乙酰化 参照梁少茹等的研究[16],精确称取HEP样品0.5 g加入烧杯中,加入10 mL蒸馏水充分混匀,用0.5 mol/L氢氧化钠溶液调节pH至9.0,在恒温下保持一定的时间,然后分别向HEP溶液中加入一定量的乙酸酐,并且用0.5 mol/L的氢氧化钠溶液保持pH为8.0,恒温反应一定时间。待反应完成后,用浓度为5 mol/L的盐酸调节反应液pH至7.0,待冷却后将反应液置于截留分子量为15000的透析袋中,流水透析48 h后将透析液置于旋转蒸发仪减压浓缩,用4倍95%乙醇醇沉24 h,沉淀经冷冻干燥后即得到乙酰化猴头菇多糖。
1.2.3 猴头菇多糖乙酰化取代度的测定 根据刘莹等[17]的研究,采用酸碱滴定法测定猴头菇多糖乙酰化取代度。准确称取10 mg乙酰化猴头菇多糖放入100 mL烧杯中,用10 mL 0.01 mol/L的氢氧化钠标准溶液溶解。以酚酞作为指示剂,用0.01 mol/L标准盐酸溶液反滴定至红色消失,记录加入盐酸的体积。取代度(DS)按下式计算[18]:
式中:A为乙酰基含量,%;V0为加入氢氧化钠溶液的体积,mL;C0为氢氧化钠溶液的浓度(0.01 mol/L);V1为消耗盐酸溶液的体积,mL;C1为盐酸溶液的浓度(0.01 mol/L);m为乙酰化猴头菇多糖样品质量,g。
1.2.4 猴头菇多糖乙酰化修饰的单因素实验
1.2.4.1 料液比对猴头菇多糖乙酰化修饰的影响 精确称取0.1 g HEP,反应时间35 ℃,保持反应液 pH为8.0反应时间3 h,分别考察料液比1∶20、1∶25、1∶30、1∶35和1∶40 g/mL对HEP乙酰化反应的影响,确定适宜的料液比。
1.2.4.2 反应时间对猴头菇多糖乙酰化修饰的影响 精确称取0.1 g HEP,反应温度40 ℃,乙酸酐3.5 mL,保持反应液 pH为8.0,分别考察反应时间2、2.5、3、3.5 和4 h对HEP乙酰化反应的影响,确定适宜的反应时间。
1.2.4.3 反应温度对猴头菇多糖乙酰化修饰的影响 精确称取0.1 g HEP,乙酸酐3.5 mL,反应时间3 h,保持反应液 pH为8.0,分别考察温度25、30、35、40和45 ℃对HEP乙酰化反应的影响,确定适宜的反应温度。
1.2.5 猴头菇多糖乙酰化修饰工艺条件优化 在单因素实验基础上,根据Box-Behnken 的中心组合实验设计原理,以取代度为指标,选取料液比(A)、反应时间(B)和反应温度(C)三个主要因素进行响应面设计优化猴头菇多糖乙酰化修饰工艺条件,实验因素及水平设计见表1。

表1 响应面实验因素水平Table 1 Level and code of independent variable used for response surface analysis
1.2.6 乙酰化猴头菇多糖的红外结构表征 充分干燥的乙酰化猴头菇多糖与KBr一起充分研磨,并取适量压片,用红外光谱仪在4000~400 cm-1范围内进行红外线光谱扫描,同时与修饰前猴头菇多糖的红外光谱图进行比较。
1.2.7 抗氧化活性测定
1.2.7.1 DPPH自由基清除率的测定 根据宋逍等[19]的研究,取不同浓度的(0.2、0.4、0.6、0.8、1.0 mg/mL)HEP样品溶液2 mL,加入2 mL现配的DPPH-乙醇溶液(0.1 g/mL)2 mL,作为样品管,混匀后常温避光30 min,在517 nm波长处测定溶液OD值,记录数据A1;用蒸馏水代替HEP溶液重复以上操作,在517 nm处测得吸光度值,记录数据A0;用蒸馏水代替DPPH-乙醇溶液,重复上述操作,测得吸光度数据为B1。
DPPH自由基清除率公式为:
式中:A1为加入不同浓度HEP溶液的吸光度;A0为空白组的吸光度;B1为不同浓度HEP不加DPPH-乙醇溶液的吸光度。
1.2.7.2 羟基自由基清除率的测定 根据王之珺等[20]的研究,各取1.2.7.1中配制好的不同浓度的HEP样品溶液1 mL,先后加入FeSO4(9 mmol/L)溶液1 mL,水杨酸-乙醇溶液(9 mmol/L)1 mL,H2O2溶液(9 mmol/L)1 mL,37 ℃水浴加热,30 min 后,在波长为510 nm处测定OD值,记录数据A1;用蒸馏水代替HEP溶液重复以上操作,在510 nm处测定OD值,记录数据A0;用蒸馏水替代H2O2溶液重复上述操作,测得吸光度数据为B1。
羟基自由基清除率公式为:
式中:A1为加入不同浓度HEP溶液的吸光度;A0为空白组的吸光度;B1为不加H2O2溶液不同浓度HEP的吸光度。
式中:V1为加多糖样品后清除超氧阴离子的速率;V0为邻苯三酚自氧化速率。
1.3 数据处理
所有实验数据均为3次重复实验的平均值,并以平均值±标准差表示,实验数据用Design Expert 8.0.5以及Microsoft Office Excel进行处理分析。
2 结果与分析
2.1 猴头菇多糖含量
根据标准曲线测定多糖含量(图1),获得回归方程:y=0.0050x+0.0155,R2=0. 9931。经测定猴头菇多糖含量为10.89%。

图1 标准曲线Fig.1 Standard curve
2.2 单因素对猴头菇多糖乙酰化修饰的影响
2.2.1 料液比对猴头菇多糖乙酰化取代度的影响 料液比对猴头菇多糖乙酰化取代度的影响结果见图2。
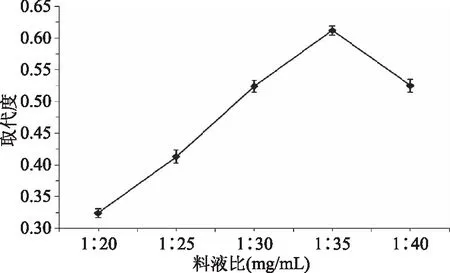
图2 料液比对猴头菇多糖乙酰化取代度的影响Fig.2 Effect of polysaccharides-to-acetic anhydrideratioon substitution degree of HEP
由图2可知,随着料液比的减少,HEP乙酰化取代度有一定程度增加,当料液比为1∶35 (g/mL)时,取代度达到最大值,乙酰化效果最好。当料液比进一步减少,水解副反应增加,反应体系取代度反而下降,这主要是因为生成的乙酰化多糖对反应起抑制作用导致,因此确定最适宜料液比为1∶35 (g/mL)。
2.2.2 反应时间对猴头菇多糖乙酰化取代度的影响 反应时间对猴头菇多糖乙酰化取代度的影响结果见图3。

图3 反应时间对猴头菇多糖乙酰化取代度的影响Fig.3 Effect of the reaction time on substitution degree of HEP
由图3可知,反应时间在1~3 h时,乙酰取代度随反应时间的增加而增加;在3 h时取代度达到最大为0.593,此时乙酸酐与HEP完全反应,乙酰化效果最好;超过3 h时,取代度下降,可能是由于反应时间过长,部分乙酰化多糖的乙酰基游离出来,使取代度降低[17],因此确定最适宜反应时间为3 h。
2.2.3 反应温度对猴头菇多糖乙酰化取代度的影响 反应温度对猴头菇多糖乙酰化取代度的影响结果见图4。

图4 反应温度对猴头菇多糖乙酰化取代度的影响Fig.4 Effect of the reaction temperature on substitution degree of HEP
由图4可知,反应温度在25~30 ℃时,取代度递增;30 ℃时取代度达到最大值;超过30 ℃时,取代度随温度升高降低,原因是温度升高使乙酸酐的水解速度加快,乙酰基与多糖的结合力降低,导致取代度下降[18]。因此确定最适宜反应温度为30 ℃。
2.3 响应面分析
2.3.1 响应面优化实验分析 为了确定猴头菇多糖乙酰化修饰的最优工艺条件,利用3因素3水平响应面分析法优化猴头菇多糖乙酰化工艺参数。选取料液比、反应时间和温度三个考察因素,以乙酰化取代度DS作为响应值,进行三因素三水平的实验设计。用Design-expert软件对17个实验点的取代度进行数据处理,从中发现各影响因素对修饰的HEP取代度的影响,找到各因素作用的最优区域,实验结果见表2,方差分析结果见表3。

表2 实验方案与结果分析Table 2 Design and results of tests

表3 方差分析表Table 3 Analysis of variance
通过对响应面优化实验的结果进行分析研究,三个因素经拟合,得到的多糖取代度的回归方程为
Y=0.59-0.036A+0.000875B-0.011C-0.028AB+0.021AC+0.00675BC-0.11A2-0.11B2-0.087C2
由表3方差分析可以看出,模型p小于0.05,说明模型有意义。失拟项p值为0.0917>0.05,失拟项差异不显著,表明干扰因素较小。相关系数R2=0.9047,表明超过90%的实验数据可用该模型进行解释,说明该方程可靠性较高。影响HEP乙酰化因素的主次顺序依次为A>C>B,即料液比>反应温度>反应时间。
2.3.2 响应面图分析 通过响应面实验得到响应面图,更直观地反映各因素交互作用对猴头菇多糖乙酰化取代度影响的强弱关系。各因素交互作用影响的响应面图见图5。

图5 两因素交互作用对取代度的影响Fig.5 Effects of cross-interaction of two factors on substitution degree of Ac-TMP
由图5可知:料液比对乙酰化取代度的影响最大,表现为曲线最陡;温度的影响次之,而图中时间曲线最平滑,因此影响最不显著。料液比和时间的交互作用最明显,料液比和温度的交互作用次之,时间和温度的交互作用不太明显,但都不显著。
2.3.3 最佳条件的确定及验证实验 利用Design-Expert 8.06软件对工艺参数进行优化,得到的最佳工艺条件为:料液比为1∶34.1 g/mL,反应时间3.01 h,温度为29.59 ℃时,猴头菇多糖乙酰化取代度最大为0.612。考虑实际操作,调整工艺参数料液比为1∶34 g/mL,反应时间3 h,反应温度30 ℃,在此条件下测得猴头菇多糖乙酰化的取代度为0.609,与预测值十分接近,表明该实验的最佳优化条件合理可行。
2.4 红外结构表征分析
乙酰化修饰前后猴头菇多糖红外光谱见图6和图7。

图6 HEP的红外光谱Fig.6 Infrared spectra of HEP

图7 A-HEP的红外光谱Fig.7 Infrared spectra of A-HEP
由图6和图7可见修饰前后的猴头菇多糖均具有多糖类物质红外的特征吸收峰:如图6,在1401.58 cm-1显现了多糖物质的特征吸收,表明该物质即为猴头菇多糖。同样,如图7所示,乙酰化猴头菇多糖在1640.28 cm-1出现了一个吸收峰,为酯基C=O双键的伸缩振动,在1398.14 cm-1处有C-O单键的伸缩振动,说明乙酰化产物中成功引入了乙酰基。
2.5 抗氧化活性检测
2.5.1 DPPH自由基清除能力 修饰前后猴头菇多糖对DPPH·的清除作用见图8。

图8 HEP和A-HEP对DPPH·的清除作用Fig.8 Scavenging capacity of HEP and A-HEP on DPPH free radicals
由图8可知,HEP和A-HEP在多糖浓度0.2~0.6 mg/mL范围内,清除率随多糖浓度增加而明显提高,而当多糖浓度大于0.6 mg/mL的时候,A-HEP对DPPH·的清除有明显变缓的趋势。HEP的最大清除率为18.7%,A-HEP最大清除率为22.8%,乙酰化后的HEP对DPPH·的清除能力略有增强。
2.5.2 羟基自由基清除能力 修饰前后猴头菇多糖羟基自由基清除能力结果见图9。

图9 HEP和A-HEP对·OH的清除作用Fig.9 Scavenging capacity of HEP and A-HEP on hydroxyl free radicals
由图9可知,在所选多糖浓度范围内HEP和A-HEP对·OH的清除作用均随浓度升高而增强,与HEP相比A-HEP对·OH的清除能力显著增强,A-HEP的清除率最大为42.8%,而HEP清除率最大为23.7%,表明了对HEP进行乙酰化修饰能提高其对·OH的清除能力。
2.5.3 清除超氧阴离子能力 修饰前后猴头菇多糖对超氧阴离子清除能力的影响结果见图10。

图10 HEP和A-HEP对超氧阴离子清除作用Fig.10 Scavenging capacity of HEP and A-HEP on superoxide anion free radicals
由图10可知,不同浓度下的A-HEP对超氧阴离子的清除作用都远远大于相同多糖浓度下HEP的清除作用,HEP的最大清除率为17.2%,A-HEP的最大清除率为30.2%,表明对HEP进行乙酰化修饰能提高超氧阴离子的清除作用。
对修饰前后猴头菇多糖抗氧化活性研究表明:猴头菇多糖经过乙酰化修饰后抗氧化活性有了明显增强,可能是因为猴头菇多糖经乙酰化修饰后,其空间构象发生变化,使其更易于提供羟基,从而有利于捕捉自由基,提高抗氧化活性。
3 结论
本文以猴头菇为原料,采用传统水提法提取猴头菇多糖,采用乙酸酐法对HEP进行乙酰化修饰,以乙酰基取代度为指标,通过响应面分析对HEP乙酰化修饰工艺参数进行优化,并比较修饰前后HEP的抗氧化活性。确定了猴头菇多糖乙酰化修饰的最佳工艺条件为:料液比1∶34 g/mL,反应时间3 h,反应温度30 ℃,在最佳修饰工艺条件下,猴头菇多糖乙酰化的取代度为0.609。利用该方法对多糖进行乙酰化修饰,具有反应可操作性强、试剂便宜易得、多糖的乙酰化取代度较高的优点,是一种较理想的能够有效提高猴头菇多糖抗氧化活性的一种修饰方法。
抗氧化性研究表明:HEP和A-HEP对DPPH自由基、羟基自由基和超氧阴离子自由基均有一定的清除作用,且清除率随多糖浓度增加而增大。与HEP相比,A-HEP抗氧化活性明显增强。本研究表明乙酰化修饰可以提高猴头菇多糖的抗氧化活性,可用于猴头菇多糖的结构改性,为其构效关系研究提供新的方向和思路。
[1]黄年来. 中国食用菌百科[M]. 北京:农业出版社,1997.
[2]樊伟伟,黄惠华. 猴头菇多糖研究进展[J]. 食品科学,2008,29(1):355-358.
[3]Yang B K,Park J B,Song C H. Hypolipidemic effect of an exo-biopolymer produced from a submerged mycelial culture ofhericiumerinaceus[J]. Bioscience Biotechnology & Biochemistry,2003,67(6):1292-1298.
[4]Kim D M,Pyun C W,Ko H G,et al. Isolation of antimicrobial substances fromhericiumerinaceum[J]. Mycobiology,2000,28(1):33-38.
[5]黄萍,罗珍,郭重仪,等. 猴头菇多糖胃黏膜保护作用研究[J]. 中药材,2011,34(10):1588-1590.
[6]罗珍,黄萍,郭重仪,等. 猴头菇多糖增强免疫功能的实验研究[J]. 中国实验方剂学杂志,2011,17(4):182-183.
[7]皇甫永冠,闫宝松,宗宪春. 猴头菇的营养功效及在食品加工中的应用[J]. 食用菌,2016,38(2):7-8.
[8]Chen Y,Zhang H,Wang Y,et al. Acetylation and carboxymethylation of the polysaccharide from ganoderma atrum,and their antioxidant and immunomodulating activities[J]. Food Chemistry,2014,156(3):279-288.
[9]Song Y,Yang Y,Zhang Y,et al. Effect of acetylation on antioxidant and cytoprotective activity of polysaccharides isolated from pumpkin(Cucurbita pepo,lady godiva)[J]. Carbohydrate Polymers,2013,98(1):686-91.
[10]Xie J H,Zhang F,Wang Z J,et al. Preparation,characterization and antioxidant activities of acetylated polysaccharides fromCyclocaryapaliurusleaves[J]. Carbohydrate Polymers,2015,133:596-604.
[11]徐田甜,陈义勇. 松树蕈多糖乙酰化修饰工艺及其抗氧化活性[J]. 食品与发酵工业,2017(4):164-170.
[12]张树海. 猴头菇多糖提取及纯化的研究[J]. 食品研究与开发,2006,27(11):103-106.
[13]韩伟,豆欣欣. 猴头菇多糖的提取纯化工艺及抗氧化活性研究[J]. 徐州工程学院学报:自然科学版,2016,31(3):22-28.
[14]韩伟,刘瑞丽,张晓坚. 猴头菇多糖纯化及活性研究[J]. 安徽医药,2008,12(9):793-794.
[15]和法涛,刘光鹏,朱风涛,等. 响应面法优化热水法浸提猴头菇多糖工艺提高多糖得率[J]. 食品科技,2015(1):210-215.
[16]梁少茹,肖霄,肖斌. 绿茶多糖的乙酰化修饰及其清除自由基、NO2-活性的研究[J]. 食品工业科技,2015,36(11):84-87,99.
[17]刘莹,赵杰,许琳. 乙酰化修饰金针菇多糖衍生物的抗氧化性研究[J]. 食品与发酵工业,2014,40(7):88-91.
[18]王晶,张全斌,张忠山,等. 乙酰化海带褐藻多糖硫酸酯的制备及其抗氧化活性研究[J]. 中国海洋药物,2008,27(1):50-54.
[19]宋逍,张丽华,赵鹏,等. 响应面法优选款冬花多糖的乙酰化工艺研究[J]. 中成药,2013,35(9):2030-2033.
[20]王之珺,张柳婧,钟莹霞,等. 青钱柳多糖的乙酰化修饰及抗氧化活性[J]. 食品科学,2015,36(21):6-9.
[21]杨春瑜,杨春莉,刘海玲,等. 乙酰化黑木耳多糖的制备及其抗氧化活性研究[J]. 食品工业科技,2015,36(23):105-110.
