超细至纳米级过氧化银的化学制法及其表征*
2018-04-26刘亚飞张永兴邢一龙张云舒
李 梦,刘亚飞,赵 欣,张永兴,邢一龙,张 然,张云舒
(1.中国民用航空飞行学院 航空工程学院,四川 广汉 618307;2.中国航空油料有限责任公司 西南公司,四川 成都 610202)
过氧化银具有独特的电化学特性、光化学性质、广谱抗菌性能以及强氧化性,在高比功率蓄电池、大容量存储设备和高性能抗菌材料等方面具有巨大的发展空间[1-5]。如何高效、快速地制备高纯度的超细过氧化银粉体一直是银系氧化物的研究热点。研究表明,随着超细过氧化银粉体纯度的增加和粒径的减小,由其制成的高比功率蓄电池快速放电性能及抗菌材料的抗菌性能越好[6-7]。制备超细过氧化银粉体的主要方法有电化学法、溅射法以及化学法等[8-12]。采用电化学法制备超细过氧化银粉体速率较慢,纯度不高,杂质较多;溅射法对设备的要求较高,其制备的超细过氧化银粉体纯度也较高,比较适合制备纳米过氧化银薄膜;化学法试验条件复杂,但较为适合工业化生产,同时可以通过控制其试验条件来提高过氧化银粉体纯度。本文采用化学法在不同的试验条件下制备出超细至纳米级过氧化银粉体,研究了不同试验条件对超细过氧化银粉体粒径、形貌及纯度的影响,并利用XRD、SEM对制得的超细过氧化银粉体进行了表征,分析得出了最佳的制备试验条件。
1 试验
1.1 试验原料与设备
试验所需的主要原料包括碳酸银、氢氧化钠、过硫酸钠、十二烷基苯磺酸钠、碘化钾、淀粉、硫代硫酸钠、稀硝酸、稀盐酸和去离子水等。
采用辽宁丹东方圆DX-2000型X射线衍射仪测试过氧化银粒子的晶型结构,测试所用靶材为铜,工作电压为40 kV,电流为30 mA,扫描速度为0.02 (°)/s,在2θ为20°~80°的范围内收集衍射峰型,通过与标准谱图(PDF卡片)对比,标定各组成相。采用场发射扫描电子显微镜JSM—5900LV拍摄照片,观察试样的形貌、粒径。
1.2 超细过氧化银粉体的制备机理
超细过氧化银粉体的制备过程中涉及到的反应原理为:采用碳酸银与硝酸为原料先制备中间产物硝酸银溶液,再利用硝酸银、过硫酸钠和氢氧化钠在碱性条件下制备超细过氧化银粉体。具体的化学反应方程式包括:
Ag2CO3+2HNO3→2AgNO3+CO2↑+H2O
(1)
2AgNO3+2NaOH→Ag2O↓+2NaNO3+H2O
(2)
Ag2O+Na2S2O8+2NaOH→2AgO↓+
2Na2SO4+H2O
(3)
1.3 超细过氧化银粉体的制备工艺
超细过氧化银粉体制备工艺如下。
1)配制浓度为0.2 mol/L的稀硝酸溶液及浓度为5 mol/L的氢氧化钠溶液备用。称取1.38 g(0.005 mol)碳酸银粉末,将其加入烧杯中,然后滴加稀硝酸直至碳酸银恰好完全溶解,即可得到浓度约为0.2 mol/L的硝酸银溶液,其中含有少量的稀硝酸。
2)在容量为500 mL的烧杯中加入150 mL去离子水,称取2.38 g(0.01 mol)过硫酸钠加入烧杯中,充分搅拌;之后加入0.174 g十二烷基苯磺酸钠,继续充分搅拌。
3)通过恒温水浴装置将溶液温度升高到设定温度60 ℃,期间当溶液温度达到约为50 ℃时,开始滴加氢氧化钠溶液,调节其pH至12.50,并采用2.5 mL/min的滴定速度滴加先前制备的硝酸银溶液,同时使用适量的氢氧化钠溶液维持反应的pH值为12.50,滴加结束后继续恒温搅拌10~30 min。
4)待反应完全后,将反应产物过滤,并冲洗至滤液呈中性。
5)将沉淀置于真空干燥箱内于80 ℃干燥24 h,即可制得超细过氧化银粉体。
1.4 制备粉末中过氧化银含量的确定
采用碘化钾滴定法测定制备的粉末中过氧化银的含量,具体做法为:取0.25 g制备的样品粉末、2 g碘化钾和50 mL水于烧杯中,搅拌至无黑点;然后将反应液过滤于带塞的锥形瓶中,使用50 mL浓度为4%的碘化钾溶液分别洗涤沉淀和漏斗各4次,再用蒸馏水洗涤漏斗2次,洗涤液直接加入锥形瓶中;接下来向锥形瓶中加入10 mL浓度为3 mol/L的盐酸,塞紧瓶塞置于阴暗处,10 min后取出;最后用蒸馏水吹洗塞子,轻摇锥形瓶同时滴加0.1 mol/L标准硫代硫酸钠至溶液呈浅黄色,加入0.5%的淀粉悬浊液3 mL,继续滴加硫代硫酸钠至蓝色消失。此时超细粉体中过氧化银含量使用如下公式进行计算:
式中,c为标准硫代硫酸钠摩尔浓度;v为滴定用硫代硫酸钠标准溶液的毫升数;123.83为过氧化银摩尔质量,单位为 g/mol;m为样品质量,单位为g。
2 结果与讨论
2.1 过硫酸钠与硝酸银物质的量之比对制备粉体中过氧化银含量的影响
由制备超细过氧化银粉体原理可知,过硫酸钠与硝酸银的添加量比值对反应产物具有重要影响。由于反应中反应物过硫酸钠是强氧化剂,反应产物过氧化银同样具有氧化性,因此它们在反应中的配比将直接影响试验结果中高价氧化银的产量。将试验条件设置为温度60 ℃,pH值为13.00,反应时间为30 min,十二烷基苯磺酸钠与硝酸银质量之比为1∶5。设计过硫酸钠与硝酸银物质的量之比分别为1∶3、1∶2、1∶1、1∶0.5和1∶0.25等5组对比试验,来研究不同反应物配比对于制备的超细粉体含量的影响,结果见表1。

表1 过硫酸钠与硝酸银物质的量之比对制备粉末中过氧化银含量的影响
当过硫酸钠与硝酸银物质的量之比为1∶3和1∶2时,生成的过氧化银量较少,主要原因为过硫酸钠的量相对于硝酸银较少,因而未能将1价银离子氧化为2价或3价;当过硫酸钠与硝酸银物质的量之比为1∶1时,反应的主要产物为过氧化银;当过硫酸钠与硝酸银物质的量之比为1∶0.5和1∶0.25时,由于过硫酸钠过量太多,过氧化银的产率大幅下降。由制备原理可得,当过硫酸钠与硝酸银物质的量之比为1∶2时可获得最高过氧化银含量,但试验结果表明获得最高过氧化银含量的配比为1∶1。推断此现象的原因为试验过程中碱液与硝酸银溶液首先反应生成氧化银沉淀,然后过硫酸钠氧化氧化银制得过氧化银颗粒,即反应需要在强氧化氛围下进行,而过氧化银本身具有氧化性,因此作为氧化剂的过硫酸钠需要适当过量;同时过二硫酸根离子为较强的氧化性离子,随着过硫酸钠添加量的进一步增加,过硫酸钠能分解为硫酸钠,促使制备过氧化银的反应式(见式3)逆向进行,导致过氧化银产量降低,而银离子增多,银离子与硫酸根离子结合生成了硫酸银,从而出现表1中反映的规律。
2.2 反应体系酸碱性对制备粉体中过氧化银含量的影响
根据反应原理可知,制备超细过氧化银粉体的整个反应需要在碱性环境下进行,为研究酸碱性对过氧化银产率的影响,设计了如下试验。将过硫酸钠与硝酸银物质的量之比设定为1∶1,反应时间为30 min,反应温度为60 ℃,十二烷基苯磺酸钠与硝酸银质量之比为1∶5。将4组试验的pH值分别调整为12.80、13.00、13.20和13.40,研究相应酸碱性条件下超细粉体中的过氧化银含量(见表2)。

表2 反应体系pH值对制备粉体中过氧化银含量的影响
由表2可知,当反应体系的pH值<13.00时,制得的粉体中过氧化银的含量较低。其主要原因是氢氧化钠用量较少,不足以将试验过程中产生的硫酸中和,反应过程中生成的过氧化银与硫酸发生反应,使制备粉末中过氧化银含量降低。当反应体系的pH值≥13.00时,制得的粉体中过氧化银的含量将大幅提高,因此反应体系的pH值应该保持在13.00以上。
2.3 反应温度对制备粉体中过氧化银含量的影响
初级粒子的大小和分布主要由反应过程的微观混合程度决定。在温度较低的情况下制备超细过氧化银粉体的反应速率较慢,试验过程中微观混合程度较低,只生成少量的超细过氧化银粉体,升高反应温度可以加快试验进程,促进微观混合,温度越高,反应速率也越快。由于过氧化银的分子中存在4个银原子,其中2个银原子价态为1价,另外2个为3价,在热力学上属于亚稳态,温度过高,过氧化银稳定性变差,会发生分解反应释放氧气,反应式如下:
4AgO=2Ag2O+O2↑
2Ag2O=4Ag+O2↑
反应温度对制备粉体中过氧化银含量的影响见表3。

表3 反应温度对制备粉体中过氧化银含量的影响
研究结果表明,温度对于过氧化银的形成有很明显的影响,在温度较低时,不利于过氧化银生成,而生成的氧化银较多,较高的温度会导致过氧化银分解,过氧化银会转化为氧化银甚至转化为银;因此,制备超细过氧化银粉体需要设定合适的反应温度。60 ℃时制得的粉体中过氧化银含量最高,故将其定为最佳的反应温度。
2.4 反应时间对过氧化银粉体粒径的影响
纳米粉体具有的纳米效应在实际应用中能否体现出来,一般取决于制备粉体过程中微粒的团聚粒径大小,而团聚粒子粒径可能达到一次粒径的几倍到几十倍甚至上百倍;因此,纳米粉体的聚集状况在超细过氧化银的制备过程中是需要考虑的一个重要问题。在其他试验条件不变的情况下,反应时间对过氧化银粉体粒径的影响状况如图1所示。
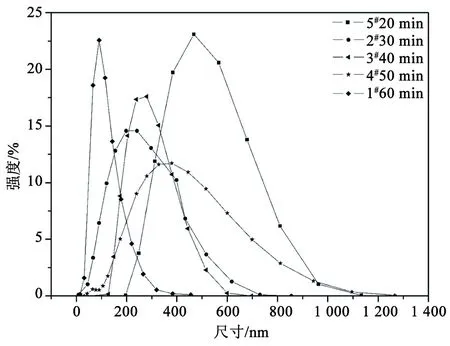
图1 反应时间对过氧化银粉体粒径的影响
由图1可知,随着反应时间的增加,超细粉体二次团聚粒径逐渐增大。制备超细过氧化银粉体的反应属于异相成核反应,与均相成核相比,异相成核所需的位垒较低,故在已有晶核存在时,粒子二次成核和多次成核会优先在已有的晶核上发生,即过氧化银粒子在制备过程中具有集聚趋势。随着试验时间的增长,粒子聚集使其粒径不断增大。考虑到过短的反应时间控制晶体生长不利,最终确定其反应时间为30 min。
2.5 表面活性剂对制备粉体中过氧化银含量和形貌的影响
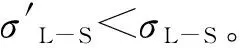

表4 十二烷基苯磺酸钠与硝酸银质量之比对制备粉体中过氧化银含量的影响
研究表明,在表面活性剂用量变化的情况下,反应产物中过氧化银的含量变化并不明显,可以推断表面活性剂的用量对于制备粉体中过氧化银的含量没有明显影响。上述4组试验制备的过氧化银产物的SEM图像如图2所示。

图2 十二烷基苯磺酸钠与硝酸银质量之比对过氧化银粒子形貌的影响
研究表明,表面活性剂十二烷基苯磺酸钠的用量主要影响制备的过氧化银产物的微观形貌与粒径。当十二烷基苯磺酸钠与硝酸银质量之比为1∶2.5时,过氧化银颗粒尺寸约为500 nm,颗粒粒径分布非常不均匀,形状为球形;当十二烷基苯磺酸钠与硝酸银质量之比为1∶5时,过氧化银颗粒粒径约为600 nm,颗粒粒径分布不均匀,形状为球形;当十二烷基苯磺酸钠与硝酸银质量之比为1∶10时,过氧化银颗粒粒径约为800 nm,颗粒粒径分布较均匀,形状以球状为主,但出现部分片状结构;当十二烷基苯磺酸钠与硝酸银质量之比为1∶20时,过氧化银颗粒尺寸约为600 nm,有大量的针状过氧化银晶体出现。针状及片状过氧化银颗粒不利于对颗粒的包覆等后续表面处理工艺的实施。当十二烷基苯磺酸钠与硝酸银质量之比为1∶10时,反应得到的过氧化银粉体粒径较小,其形貌以球状为主,有利于后续表面处理工艺的实施。
2.6 XRD分析
XRD是利用X射线在样品晶体中的衍射现象来分析材料的晶体参数、晶体结构、晶格参数、不同结构相的含量及内应力的方法。其具体方法为根据与超细过氧化银粉体的晶体样品发生衍射后的X射线信号的特征分析计算出样品中所含有的物相与晶格参数,并能够达到较高的精度。
采用XRD对制得的超细粉体中的物相组成进行分析表征。同时考虑超细粉体中过氧化银的含量、粒径及形貌,优选的制备条件是:过硫酸钠与硝酸银物质的量之比为1∶1,反应温度为60 ℃,pH值为13.40,反应时间为30 min,十二烷基苯磺酸钠与硝酸银质量之比为1∶10。将此条件下制得的超细过氧化银粉体进行XRD分析,其结果如图3所示。
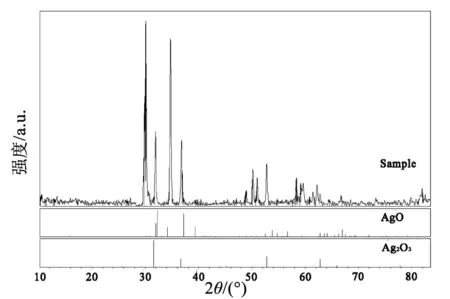
图3 优选试验条件下制备的粉体XRD图谱
由图3可知,该粉末的XRD衍射图谱衍射峰清晰规整,峰形尖窄,表明制备粉末的结晶度高。在2θ为30.294°、32.020°、34.914°、36.906°、52.750°及62.733°处均出现较强的衍射峰,相应的面间距值为2.95、2.79、2.57、2.43、1.73和1.47 Å;分别对应了过氧化银的(110)、(200)、(002)、(111)、(020)和(220)晶面;制备的超细过氧化银粉末的XRD衍射图谱与过氧化银的PDF卡片吻合度较高。根据XRD图谱分析结果可知,在上述试验条件下,制备产物中含有的杂质主要为三氧化二银。
3 结语
本文研究了各种试验条件的影响,可得出如下结论。
1)在过硫酸钠与硝酸银物质的量之比为1∶1时,制备的粉体中过氧化银的含量最高,因为超细过氧化银粉体的制备反应需要在较强的氧化氛围中进行,所以过硫酸钠需要适当过量,但不宜过量太多,否则会引起过氧化银含量下降,并生成硫酸银。
2)随着pH值的升高,超细粉体中过氧化银的含量逐渐增长但增速较为平缓,当pH=13.40时,过氧化银的含量达到最高。
3)反应温度对制得超细粉末中过氧化银的含量也有重要的影响,温度过低,反应速度较慢且反应生成的中间产物较多,反之制得的过氧化银会分解为氧化银甚至银。
4)反应时间太短不利于反应的充分进行,也不利于晶粒的生长。而随着反应时间的增加,粉体二次团聚粒径逐渐增大,其比表面积迅速减小,不利于发挥纳米材料的特定功能,故将反应时间定为30 min较为合理。
5)表面活性剂的添加量对于制得的超细粉体中过氧化银含量影响较小,但对于超细过氧化银粉体的微观形貌及粒径有比较显著的影响。
6)制备超细过氧化银粉体的最佳试验条件为:pH=13.40,过硫酸钠与硝酸银物质的量之比为1∶1,十二烷基苯磺酸钠与硝酸银质量之比为1∶10,反应温度为60 ℃,反应时间为30 min。
[1] 黄雯, 王宇轩, 崔菲菲, 等. 化学法合成过氧化银及其电化学性能[J]. 电源技术, 2013, 37(6):993-996.
[2] 原勇强, 冯秀丽, 崔益秀. 液相沉淀法制备AgO材料及电性能研究[J]. 电源技术, 2015, 39(6):1266-1268.
[3] 孟凡明, 李利群, 肖定全. Zn/AgO贮备电池存储寿命研究[J]. 功能材料, 2004, 35(2):203-205.
[4] 黄秀光, 沈德芳. 可录CD无机存储介质——AgOx的研究[J]. 无机材料学报, 1998, 13(3):440-444.
[5] 沈文宁, 冯拉俊, 孔珍珍, 等. 臭氧氧化法制备超细AgO粉末及其抗菌性能研究[J]. 化学学报, 2011, 69(3):277-283.
[6] 刘贺华, 鲁道荣. 添加剂对Zn/KOH/AgO电池性能的影响[J]. 金属功能材料, 2011, 18(6):35-39.
[7] 刘波涛, 李巧玲, 李春艳, 等. 纳米氧化高银的制备及抗菌性能[J]. 化工新型材料, 2012, 40(3):44-45.
[8] 孟凡明. 自动激活锌银储备电池电极材料的制备技术与性能研究[D]. 成都:四川大学, 2004.
[9] Dellasega D, Casari C S, Vario F, et al. Nanostructured Ag4O4thin films produced by ion beam oxidation of silver[J]. Applied Surface Science, 2013, 266(2):161-169.
[10] 张约品, 阮昊, 沈德芳, 等. AgOx掩膜的制备和性能研究[J]. 功能材料, 2003, 34(2):156-157.
[11] Dellasega D, Facibeni A, Fonzo F D, et al. Nanostructured high valence silver oxide produced by pulsed laser deposition[J]. Applied Surface Science, 2009, 255(10):5248-5251.
[12] 李洁, 尹海顺. 纳米Ag(Ⅰ,Ⅲ)O粉体化学沉淀法制备条件的正交试验及其光学热分解性能研究[J]. 科技信息, 2009(27):437-438, 464.
*中国民用航空飞行学院基金项目(J2016-02)
民航飞行技术与飞行安全科研基地基金项目(F2015KF05)
中国航空油料有限责任公司科技项目(航油科技-201707)
