功能性双取代乙炔单体的合成
2018-04-25何宁
何 宁
(中国刑事警察学院 法化学系,辽宁 沈阳 110035)
1 实验材料
对溴苯甲酸甲酯、N-氯代丁二酰亚胺(NCS)从安耐吉公司购买,三甲基硅乙炔(TMSA)、N,N'-二环己基碳二亚胺(DCC) 、4-二甲氨基吡啶(DMAP)、对碘苯酚、五氟苯酚、超干二氯甲烷从百灵威公司购买,三甲基硅基丙炔醇从阿拉丁公司购买,2-碘乙醇从Alfa公司购买,二(三苯基膦)二氯化钯(Ⅱ)PdCl2(PPh3)2从浙江冶金所购买,硝酸银、碘化亚铜、对甲基苯磺酸(TsOH)、氢氧化钾、无水硫酸镁、浓盐酸试剂以及正己烷、甲醇、二氯甲烷(DCM)、石油醚、乙酸乙酯、氯仿、四氢呋喃、三乙胺、甲苯溶剂均从国药化学试剂公司购买。除溶剂四氢呋喃、甲苯在氮气保护下以二苯甲酮为指示剂加钠回流除水除氧并蒸馏提纯,三乙胺加KOH蒸馏脱水后使用外,其它药品均未经处理直接使用。
2 测试仪器
1H NMR和13C NMR核磁谱图在Bruker ARX 500NMR波谱仪上测得,以氘代氯仿(CDCl3)为溶剂,四甲基硅烷(TMS)为内标。
3 单体的制备
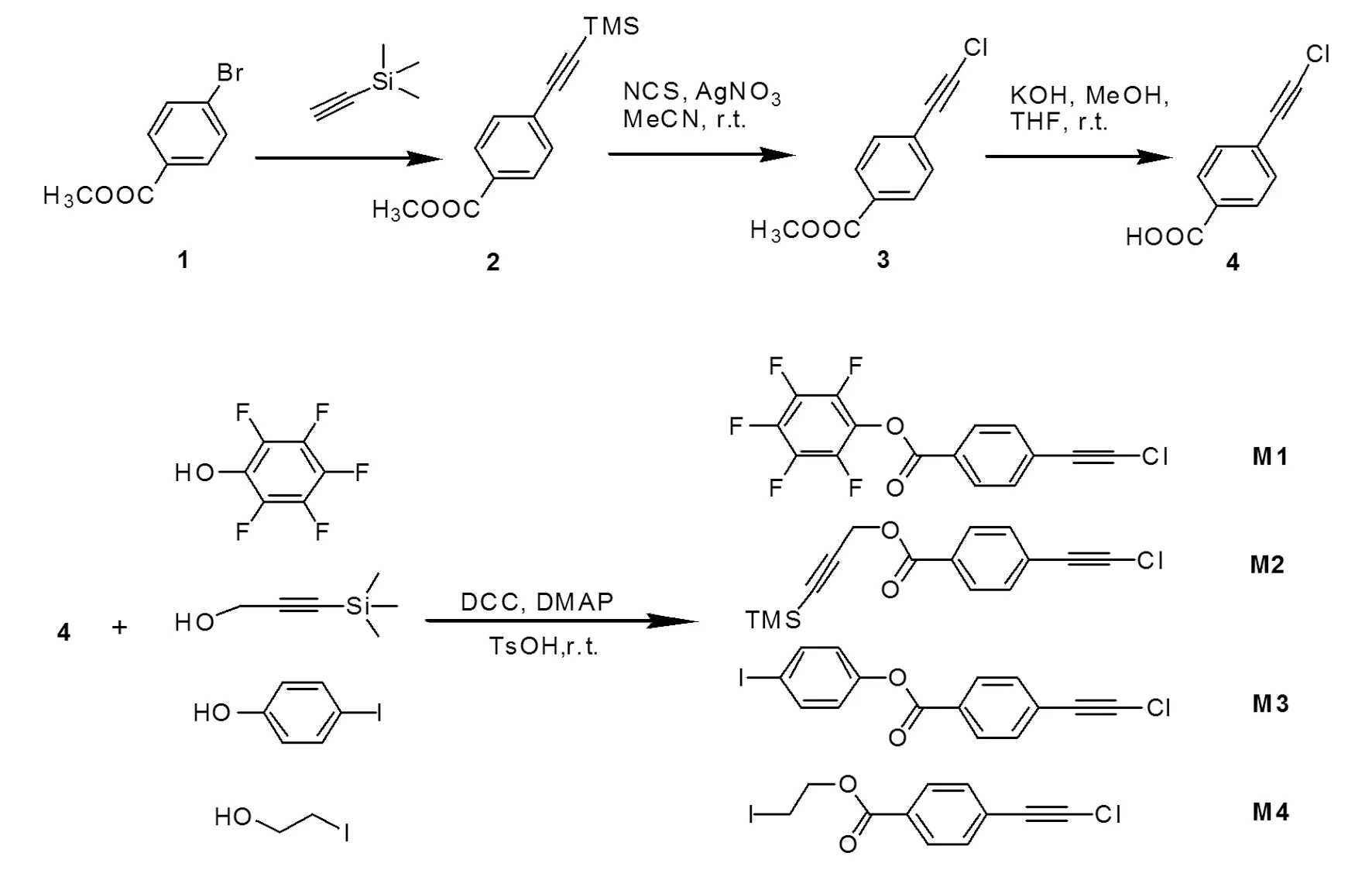
图式1 单体的合成路线
Scheme 1 Synthetic routes to monomers (M1 to M4) of 1-chloro-2-phenylacetylene derivatives.
单体的合成路线见图式1,具体的实验操作步骤如下所述:
(1)化合物2的制备[1]。往250 mL单口圆底烧瓶中加入6.451 g(30 mmol)对溴苯甲酸甲酯,放入适中的磁子,然后在手套箱中称取421 mg(0.6 mmol)PdCl2(PPh3)2、29 mg(0.15 mmol)CuI加入到烧瓶中并封装。取出后注入50 mL新蒸THF和50 mL除水处理过的三乙胺,待催化剂完全溶解后,再注入5.2 mL(36 mmol)三甲基硅乙炔,搅拌并加热至55 ℃反应24 h。反应结束后,冷却至室温,用滤纸过滤,THF洗涤数次,将滤液旋干。粗产物用硅胶色谱柱分离提纯,淋洗液为石油醚和乙酸乙酯混合溶剂(10∶1 v/v)。得到5.609 g黄色固体2,产率80.5%。1H NMR (400 MHz,CDCl3),δ (TMS,ppm):7.97(d,2H),7.52 (d,2H),3.92 (s,3H),0.26 (s,9H)。
(2)化合物3的制备[2]。在250 mL单口圆底烧瓶中依次加入适中磁子、4.647 g(20 mmol)化合物2、5.341 g(40 mmol)NCS、1.019 g(6 mmol)AgNO3。用双排管抽真空充氮气3次后,注入80 mL乙腈,待搅拌溶解后再缓慢注入13 mL(12 mmol)TBAF。该体系在室温下搅拌反应3 h后,过滤以除去体系中的沉淀,将滤液旋干,粗产物使用硅胶色谱柱进行分离提纯,淋洗液为石油醚和二氯乙烷混合溶剂(5∶1 v/v),得到3.466 g白色固体3,产率89%。1H NMR (400 MHz,CDCl3),δ (TMS,ppm):7.98 (d,2H),7.50 (d,2H),3.92 (s,3H)。
(3)化合物4的制备。在小烧杯中称取2.253 g (40 mmol) KOH,再加入50 mL甲醇与50 mL去离子水溶解。往250 mL单口圆底烧瓶中依次加入适中磁子、2.919 g (15 mmol)化合物3、50 mL的THF,待固体溶解后,将配好的KOH/CH3OH/H2O溶液加入烧瓶中,室温下搅拌反应3h。反应结束后,将反应液倒入搅拌下的200 mL浓度为1 mol/L的盐酸溶液中,使用乙酸乙酯萃取3次,合并有机相,用无水MgSO4干燥,旋干溶剂得到粗产物。用硅胶色谱柱进行分离提纯,淋洗液为石油醚和乙酸乙酯混合溶剂(10∶1 v/v),得到2.486 g白色固体4,产率91.8%。1H NMR (500 MHz,CDCl3),δ (TMS,ppm):8.04 (d,2H),7.63 (d,2H),2.06 (m,1H)。
(4)单体的制备[3-4]。M1:向250 mL单口圆底烧瓶中依次加入适中磁子、1.806 g (10 mmol)化合物4、1.841 g(10 mmol)五氟苯酚、3.093 g(15 mmol)DCC、73 mg(0.6 mmol)DMAP、103 mg(0.6 mmol)TsOH和150 mL超干DCM,在室温下搅拌反应24 h。用滤纸过滤除去沉淀,滤液旋干后得粗产物。用硅胶色谱柱分离提纯,淋洗液为石油醚和乙酸乙酯混合溶剂(v/v 10∶1),得到2.853 g白色固体M1,产率82.3%。1H NMR (400 MHz,CDCl3),δ (TMS,ppm):8.15 (d,2H),7.60 (d,2H)。13C NMR (125MHz,CDCl3),δ (TMS,ppm):162.0,132.4,130.6,128.8,126.6,72.9,68.4。19F NMR (400MHz,CDCl3),δ (TMS,ppm):-152.4,-157.6,-162.1。
M2:单体M2由化合物4与三甲基硅基丙炔醇反应制得,制备方法与投料量均与单体M1的制备相同,得到2.344 g白色固体,产率80.6%。1H NMR (400 MHz,CDCl3),δ (TMS,ppm):7.83 (d,2H),7.31 (d,2H),4.73 (s,2H),0.20 (s,9H)。13C NMR (125MHz,CDCl3),δ (TMS,ppm):165.4,132.3,130.1,129.6,127.5,99.1,92.7,71.8,69.0,53.8,0.3。
M3:单体M3由化合物4与对碘苯酚反应制得,制备方法与投料量均与单体M1的制备相同,得到2.892 g白色固体,产率75.6%。1H NMR (400 MHz,CDCl3),δ (TMS,ppm):8.10 (d,2H),7.72 (d,2H),7.55 (d,2H),6.97 (d,2H)。13C NMR (125MHz,CDCl3),δ (TMS,ppm):164.1,150.7,138.6,132.2,130.1,128.9,127.8,123.9,90.2,72.1,68.7。
M4:单体M4由化合物4与碘乙醇反应制得,制备方法与投料量均与单体M1的制备相同,得到2.419g白色固体,产率72.3%。1H NMR (400 MHz,CDCl3),δ (TMS,ppm):8.01 (d,2H),7.51 (d,2H),4.57 (t,2H),3.43 (t,2H)。13C NMR (125MHz,CDCl3),δ (TMS,ppm):164.9,131.7,129.4,129,1,126.9,71.3,68.4,64.8,0.3。
4 单体的结构表征
单体的合成路线在Scheme 1中给出,分Sonogashira偶联反应、氯代反应、水解反应、酯化反应四步进行,各步反应产率均较高,中间产物通过氢谱进行了表征,得到的目标产物即聚合单体通过氢谱、碳谱、氟谱、红外光谱进行了表征,中间产物和单体的详细表征数据见实验部分,所有中间产物和单体的结构表征结果与预期一致。
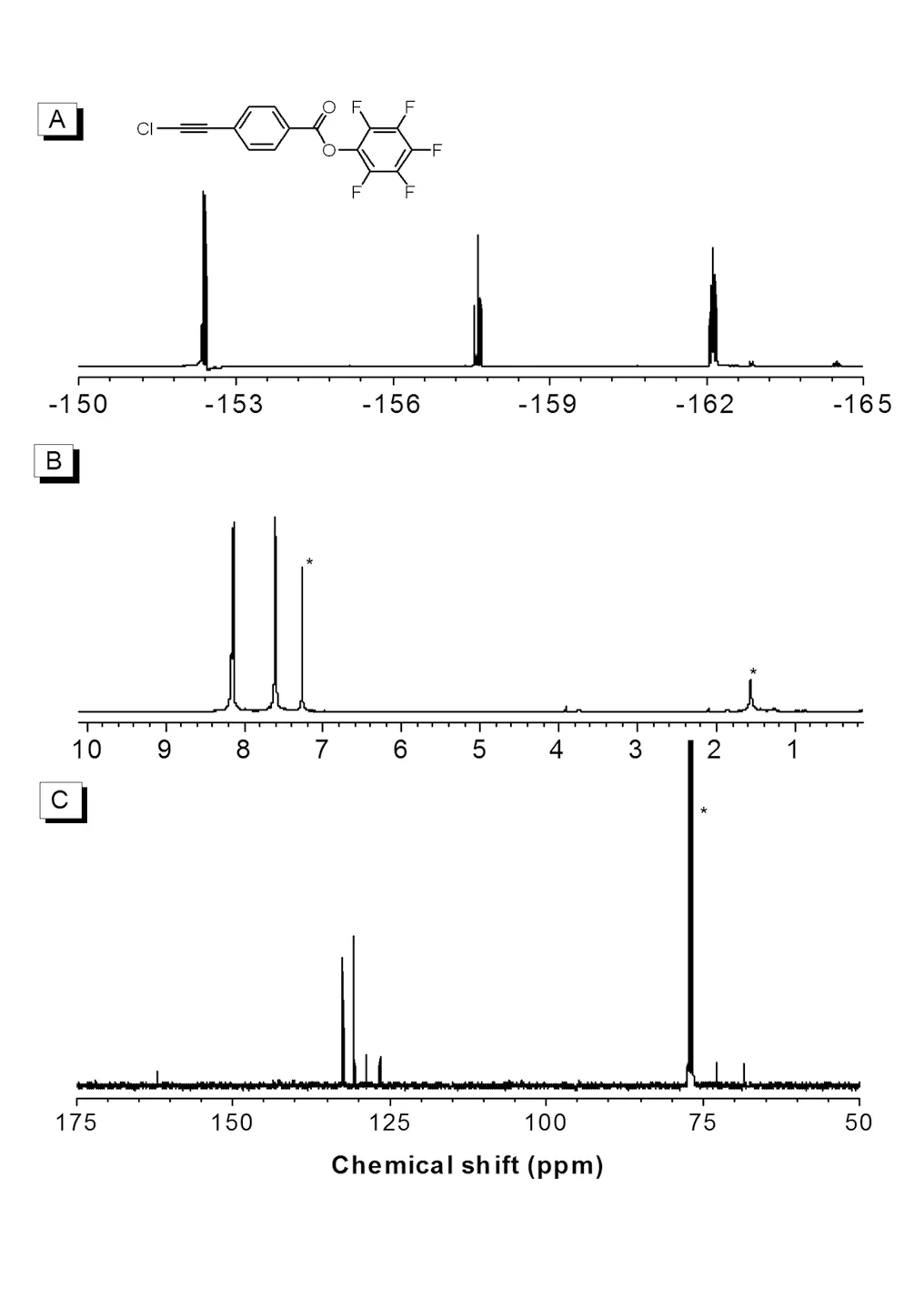
图1 单体M1的核磁谱图
Fig.119F NMR spectrum of (A) M1 in CDCl3,1H NMR spectrum of (B) M1 in CDCl3,and13C NMR spectrum of (C) M1 in CDCl3
单体M1的核磁谱图见图1。19F NMR谱图中M1在δ = -152.4,-157.6和-162.1 ppm处有三个共振吸收峰,分别对应于五氟苯环上3种化学环境的氟原子,它们的积分比为2∶1∶2,与五氟苯环上的5个氟原子对应。1H NMR谱图中M1在δ = 8.15和7.60 ppm处有两个共振峰,分别对应于苯环上两种化学环境的氢原子,其积分比为1∶1,而两种化学环境的氢原子个数都是2个,结果相符。13C NMR谱图中M1在δ = 162.0,132.4,130.6,128.8,126.6,72.9,68.4 ppm处有7个共振峰,在162.0 ppm处出现对应于酯基碳原子的共振峰,三键碳原子的共振峰出现在72.9、68.4 ppm,而132.4、130.6、128.8、126.6 ppm处的共振峰对应于苯环的4种化学环境的碳原子。
单体M2的核磁谱图见图2。1H NMR谱图中M2在δ = 7.83、7.31、4.73、0.20 ppm处有4个共振峰,7.83和7.31 ppm处的共振峰对应苯环上两种化学环境的氢原子,4.73 ppm处的共振峰对应于-O-CH2-基团上的氢原子,0.20 ppm处的共振峰对应于三甲基硅基上的氢原子,它们的积分比为2∶2∶2∶9,符合单体结构中4种化学环境的氢原子数。13C NMR谱图中M2在δ = 165.4、132.3、130.1、129.6、127.5、99.1、92.7、71.8、69.0、53.8、0.3 ppm处有11个共振峰,165.4 ppm处的共振峰对应于酯基碳原子,132.3、130.1、129.6、127.5 ppm处的共振峰对应于苯环上4种化学环境的碳原子,在99.1、92.7、71.8、69.0 ppm处出现的共振峰与两个三键的碳原子一一对应,53.8 ppm处的共振峰对应于-O-CH2-基团上的碳原子,0.3 ppm处的共振峰对应于三甲基硅基上的碳原子。
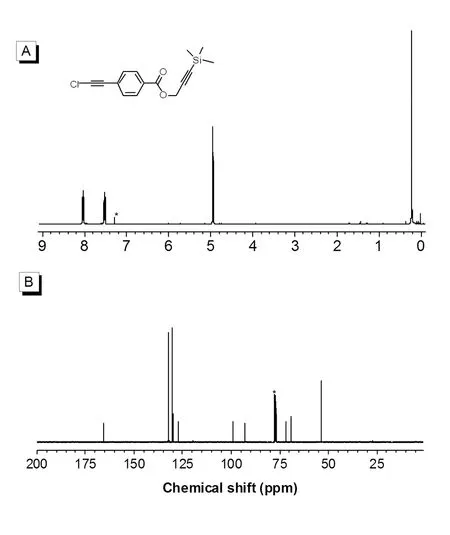
图2 单体M2的核磁谱图Fig.2 1H NMR (A) and 13C NMR (B) spectra of M2 in CDCl3
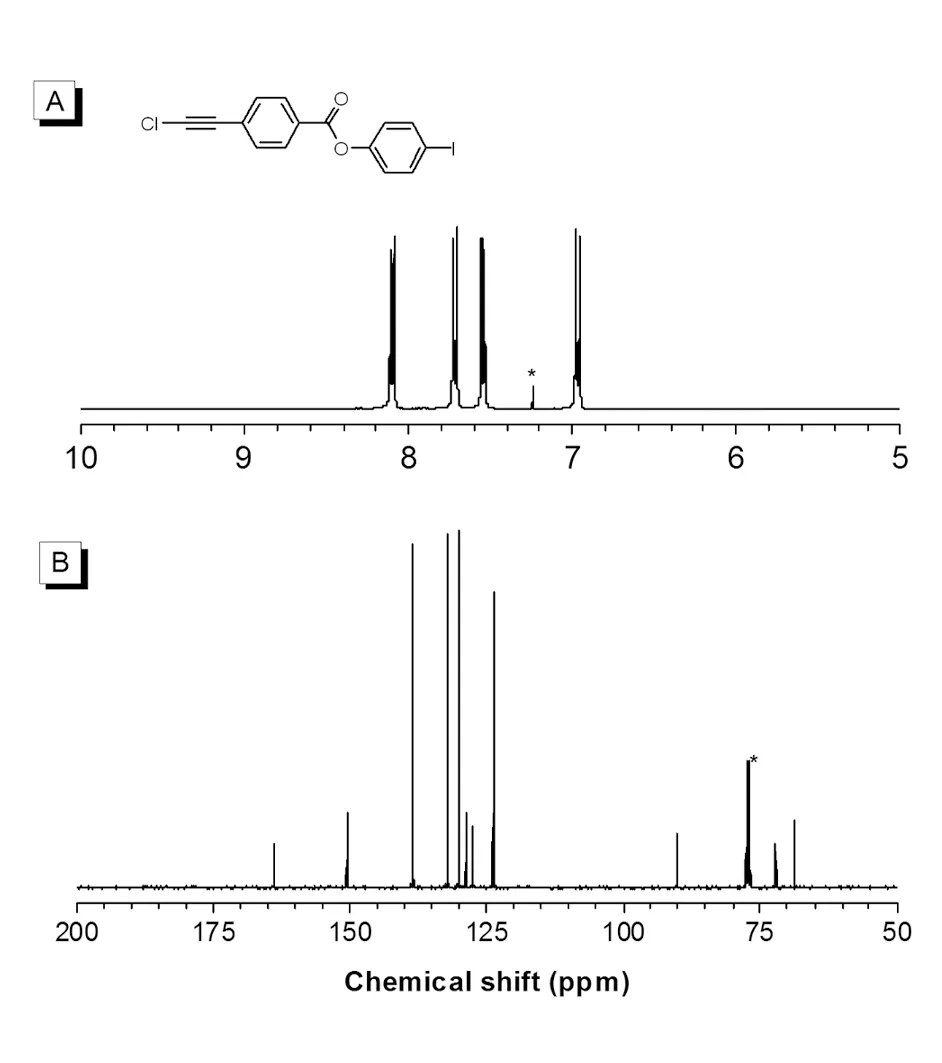
图3 单体M3的核磁谱图Fig.3 1H NMR (A) and 13C NMR (B) spectra of M3 in CDCl3
单体M3的核磁谱图见图3。1H NMR谱图中M3在δ = 8.10、7.72、7.55和6.97 ppm处有4个共振峰,分别对应两个苯环上的4种化学环境的氢原子,其积分比为1∶1∶1∶1,而每种化学环境的氢原子均为2个,结果与预期结构相符。13C NMR谱图中M3在δ = 164.1、150.7、138.6、132.2、130.1、128.9、127.8、123.9、90.2、72.1和68.7 ppm处出现11个共振峰,164.1 ppm处的共振峰对应于酯基碳原子,两个三键碳原子对应于72.1和68.7 ppm处的共振峰,在150.7、138.6、132.2、130.1、128.9、127.8、123.9和90.2 ppm处出现的共振峰分别对应于两个苯环中8种化学环境不同的碳原子。
单体M4的核磁谱图见图4。1H NMR谱图中M4在δ = 8.01、7.51、4.57、3.43 ppm处出现4个共振峰,8.01和7.51 ppm处出现的共振峰对应于苯环上两种化学环境的氢原子,4.57和3.43 ppm处的共振峰则对应于-O-CH2-CH2-I烷基链上的两种化学环境的氢原子,4个共振峰的积分比分别为1∶1∶1∶1,符合单体结构中4种化学环境的氢原子数。13C NMR谱图中M4在δ = 164.9、131.7、129.4、129.1、126.9、71.3、68.4、64.8和0.3 ppm出现9个共振峰,164.9 ppm处的共振峰对应酯基碳原子,131.7、129.4、129.1和126.9 ppm处出现的共振峰对应于苯环上4种化学环境的碳原子,71.3和68.4 ppm处出现的共振峰对应于两个三键碳原子,64.8和0.3 ppm处出现的共振峰则对应于-O-CH2-CH2-I烷基链上的两种化学环境的碳原子。
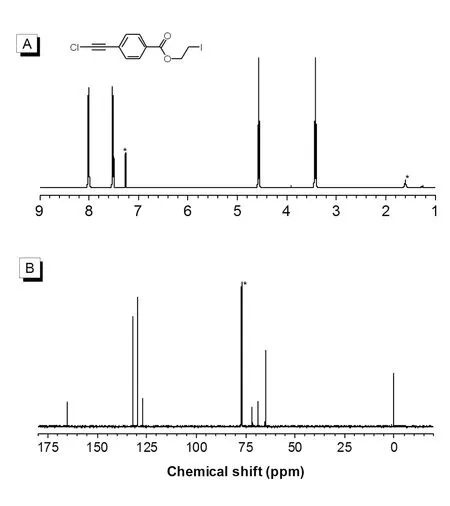
图4 单体M4的核磁谱图Fig.4 1H NMR (A) and 13C NMR (B) spectra of M4 in CDCl3
[1]Gong Y,Liu J.Sequential sonogashira and glaser coupling reactions: facile access to 1,4-disubstituted 1,3-butadiynes from arylbromide[J]. ChemInform,2016,57(35):2143-2146.
[2]Xiao A Z,Min R C,Hui Z,et al.A facile synthetic route to functional poly(phenylacetylene)s with tunable structures and properties[J]. Macromolecules,2011,44(17):6724-6737.
[3]Gulia N,Pigulski B,Charewicz M,et al.Cheminform abstract: a versatile and highly efficient method for 1-chlorination of terminal and trialkylsilyl-protected alkynes[J].ChemInform,2014,20(33):2746-2749.
[4]张孝阿.聚炔合成新路线探索及功能调控[D].杭州:浙江大学,2012.
(本文文献格式:何宁.功能性双取代乙炔单体的合成[J].山东化工,2018,47(7):19-21.)
