生长素和乙烯互作调控硝酸铵诱导的根毛分叉
2018-04-08郭政飞甘立军朱昌华
杨 娜,郭政飞,钱 锰,甘立军,朱昌华
(南京农业大学 生命科学学院,南京 210095)
根毛源于特定的表皮细胞,即生毛细胞,其发育过程分为3个阶段,即根毛细胞的特化及起始、根毛由起始转向顶端伸长、根毛迅速伸长直到完全成熟[1-2]。根毛是根系重要的组成部分,其存在增加了根系的表面积,不仅增强了植物吸收水分和矿质营养的能力,而且有助于植物根系的固定,并为植物与一些真菌及共生细菌提供了相互作用的场所[3-4]。
根毛的发育受到植物激素生长素(auxin)和乙烯(ethylene)的调控。外源1-氨基环丙烷-1羧酸(1-aminocyclopropane-1-carboxyli, ACC,乙烯合成的前体)处理野生型拟南芥诱导异位根毛的产生(由非生毛细胞产生根毛)[5-7],而乙烯合成抑制剂氨基乙氧基乙烯基甘氨酸(aminoethoxyvinylglycine, AVG)和乙烯作用抑制剂Ag+的处理则抑制根毛的产生[5,8]。CTR1 编码一种Raf-like的蛋白激酶,它负调控乙烯的信号传递,突变体ctr1产生异位的根毛[9]。外源生长素处理根毛缺失型突变体rhd6,能够恢复根毛的生长,而生长素相关的突变体aux1、axr1、axr2和axr3,根毛的发育均不正常[8-12],说明生长素也是调控根毛发育的一种关键激素。研究发现,根毛细胞中过量表达生长素输出载体抑制根毛的顶端伸长,又表明生长素的正确分布是根毛发育的必要条件[13-14]。
同时,根毛的发育还受到外界环境中矿质元素的调控。例如,缺乏铁、磷、钾、锰和镁均促进根毛的发育[15-19]。据报道活性氧(ROS )参与矿质元素调控的根毛发育过程。例如,ROS参与缺氮诱导的拟南芥根毛伸长生长,不同浓度镁对拟南芥根毛发育的调控依赖ROS的信号途径[19-20]。生长素和乙烯也参与了矿质营养对根毛发育的调控[14,21-22]。例如,生长素的极性运输和信号传递参与低磷对拟南芥根毛发育的影响,而乙烯则参与多种矿质元素缺乏对根毛发育的调控[20,22]。在低磷条件下,乙烯合成前体ACC促进根毛的伸长,而乙烯合成及作用抑制剂则抑制根毛的伸长。此外,缺钾和缺硼调控的根毛发育也依赖乙烯的信号传导途径[18,21]。
目前,氮素调控根毛发育的报道较少,我们前期报道了高浓度铵引起根毛的分叉,这些分叉根毛多数都畸形发育,有些分叉产生于一个膨大的突起,有些分叉产生于正在伸长的根毛,引起根毛伸长停止,茉莉酸和乙烯在高铵诱导根毛分叉中发挥相反的作用[23]。在上述研究的基础上,本试验进一步探讨了ROS、生长素和乙烯如何参与高浓度硝酸铵对根毛发育的调控。根毛是根系的重要组成部分,根毛发育畸形影响根系的吸收功能,本试验通过研究高铵引起根毛畸形的机制及生长素和乙烯在此过程中的作用,不仅为生产上的合理施肥提供理论依据,同时也为生产上如何缓解铵毒害提供思路。
1 材料和方法
1.1 植物材料及生长条件
试验所用的拟南芥野生型种子生态型为Columbia,突变体为乙烯不敏感型突变体etr1-1、和etr1-3,生长素不敏感突变体aux1-7和axr1-3,背景均为Columbia。
种子首先进行表面消毒。将种子放入70%(v/v)乙醇1 min,用去离子水洗4~5次。接着将其转入到0.1%(v/v)HgCl25 min,然后用去离子水洗4~5次。将消毒后的种子播在培养基表面后在4 ℃黑暗条件下放置1 d去春化,然后将其转移至光照培养箱中,培养箱培养条件(昼/夜)为25 ℃/23 ℃、16 h /8 h。用荧光灯(日立,日本)提供光源,光强约为250 μmol·m-2·s-1。培养所用的培养基包含5 mmol·L-1KNO3、2 mmol·L-1MgSO4、2 mmol·L-1Ca(NO3)2、2.5 mmol·L-1KH2PO4、70 μmol·L-1H3BO3、14 μmol·L-1MnCl2、1 μmol·L-1ZnSO4、0.5 μmol·L-1CuSO4、10 μmol·L-1NaCl、0.2 μmol·L-1Na2MoO4和40 μmol·L-1Fe-EDTA,培养液中加入1%(w/v)琼脂、蔗糖(43 mmol·L-1)和Mes(4.7 mmol·L-1),用KOH将pH调至5.8。培养4 d后将幼苗转移到新的对照和处理培养基上继续生长2 d,统计分叉根毛的数量或根毛的长度。处理培养基为对照培养基中去除5 mmol·L-1KNO3,所缺少的K+加入5 mmol·L-1KCl替代。NH4NO3处理时,根据不同处理浓度加入相应用量的NH4NO3。选择固体培养基的优势是便于对根毛的观察,培养皿垂直放置时,植物在培养基的表面生长,根毛能够平铺培养基表面,非常利于观察和测定根毛的数量及长度。
1.2 植物激素及活性氧处理
吲哚乙酸(IAA)和萘乙酸(NAA)分别溶于一定量的乙醇中,然后用去离子水稀释到1 mmol·L-1和0.01 mmol·L-1;ACC (Sigma)分别溶于去离子水中配制成母液1 mmol·L-1。所有这些试剂均在培养基温度为45~50 ℃时加入。
二苯基氯化碘(diphenylene iodonium chloride,DPI,NADPH氧化酶的抑制剂,抑制活性氧的产生)和OH·处理:DPI(Sigma)溶于二甲基亚砜(dimethylsulfoxide,DMSO),配置浓度10 mmol·L-1贮液;处理时,将其稀释至合适浓度的母液,按实验所需处理浓度加入相应的母液到培养皿中,然后加入冷却至45~50 ℃的相应用量的培养基,使新培养基含有实验所需处理浓度的DPI,对照中加入等量的DMSO。ROS以OH·的形式给与,按照Foreman等[24]方法,OH·利用 2 mmol·L-1H2O2、0.2 mmol·L-1Ca2+和0.2 mmol·L-1抗坏血酸(ascorbate)混合而产生。处理时,将合适浓度的H2O2、Ca2+和抗坏血酸母液按实验所需处理浓度加入相应的母液到培养皿中,然后加入冷却至45~50 ℃的相应用量的培养基,使新培养基含有实验所需处理浓度的OH·。
1.3 分叉根毛数和根毛长度的测定
1.3.1分叉根毛数将处理2 d的幼苗迅速转移到含有一薄层对照培养基(以此保持一定的湿度,确保在观察根毛的过程中,根毛不会干枯萎缩)的载玻片上,保持根毛在培养皿中的生长状态。将载玻片置于BH2Olympus显微镜的载物台上,于10倍物镜下观察根毛,统计距离根尖1 cm这段根长上分叉根毛和总根毛的数量。分叉根毛是从膨大的根毛基部产生多个顶端或是正在伸长的根毛停止伸长而从侧面产生一个新的顶端的根毛。分叉根毛的比率=分叉根毛数/总根毛数。
1.3.2根毛长度幼苗处理2 d后,将生长有幼苗的培养皿置于体式镜(MZFLIII,Leica Microsystem,Wetzlar,Germany)载物台上,对距根尖1 cm处的根部拍照,利用软件Motic Images Plus 2.0 (China Group CO., LTD.)分析根毛的长度。
1.4 数据分析
数据采用SPSS 16.0分析软件进行统计分析,并进行 LSD和Duncan检验(P<0.05)。
2 结果与分析
2.1 ROS在NH4NO3诱导根毛分叉中的作用
如图1所示,NH4NO3在诱导拟南芥分叉根毛形成时存在着剂量效应,浓度越高,分叉根毛产生得越多。处理2 d后,NH4NO3的浓度从1~50 mmol·L-1都能显著地增加分叉根毛的数量(图1,A);当NH4NO3的浓度达到20和50 mmol·L-1时,分叉根毛的数量也达到最大。由于2种浓度的NH4NO3诱导根毛分叉的效果相似,后续实验就选择20 mmol·L-1作为处理浓度。此外,各浓度NH4NO3处理均显著抑制了根毛的长度,且高浓度(20和50 mmol·L-1) NH4NO3处理抑制根毛伸长的效果更明显(图1,B)。

图中柱上不同的字母表示处理间差异达到0.05显著性水平,下同图1 不同浓度NH4NO3对拟南芥根毛发育的影响Different normal letters indicate significance difference among treatments at 0.05 level. The same as in the following figuresFig.1 The effects of different concentrations of NH4NO3 on root hair development in Arabidopsis seedling
ROS不仅是调控根毛发育的一个关键因子,而且ROS信号也参与营养元素对根毛发育的调控[25],本研究进一步探究ROS是否参与NH4NO3诱导的根毛分叉。外源进行ROS处理,且ROS以OH·的形式提供,当用外源ROS处理时,由NH4NO3诱导的分叉根毛数量大大减少,这说明ROS产生异常是NH4NO3诱导根毛分叉的主要原因(图2,A)。
根据上述结果,猜测NH4NO3诱导分叉根毛的形成可能是由于高浓度铵处理早期ROS产生减少(图2,A),外源补充ROS抑制了高浓度铵诱导的根毛分叉,而随着高浓度铵处理,后期ROS的产生又有所恢复,进而形成一个新的起点,造成根毛分叉。如果能够一直抑制ROS的产生,虽然根毛产生的数量会大大减少,但是这些产生的根毛可能不会分叉。DPI是NADPH 氧化酶的抑制剂,可以抑制ROS的产生[24]。图2,A 还显示,NH4NO3和DPI共同处理后,根毛的数量很少(图中未显示出,但是分叉根毛是将分叉的根毛除以总根毛数,所以原始数据可以看出),但在产生的根毛中几乎没有根毛分叉出现。另外,NH4NO3与ROS以及NH4NO3和DPI共同处理均显著抑制了根毛的伸长(图2,B)。上述实验进一步说明ROS的产生及分布决定了根毛顶端伸长的方向,高铵诱导根毛分叉的重要原因是改变了根毛活性氧的产生和分布。
2.2 NH4NO3诱导分叉根毛形成中生长素和乙烯之间的相互作用
2.2.1生长素和乙烯抑制NH4NO3诱导的根毛分叉植物激素生长素和乙烯参与调控根毛发育的各个阶段。为了研究生长素和乙烯是否参与NH4NO3诱导根毛分叉的过程,将生长4 d的拟南芥幼苗转入含有NH4NO3及不同浓度吲哚乙酸(IAA)和乙烯(ACC)的培养基上。由图3,A可知,在IAA浓度为0.1和0.5 μmol·L-1时,由于NH4NO3的存在而导致的分叉根毛数量大量减少,分别仅为对照的1/6和1/30。同时,外源ACC处理显著抑制了由NH4NO3诱导而产生的分叉根毛数,且随着ACC浓度从0.04 μmol·L-1增加到1 μmol·L-1,分叉根毛产生的比率减少到原来对照的1/4~1/20(图3,B)。上述结果表明生长素和乙烯能够抑制由于NH4NO3的存在而导致的根毛分叉。
2.2.2生长素和乙烯相互作用抑制NH4NO3诱导根毛的分叉在根毛发育过程中还存在着生长素和乙烯的相互作用。利用生长素不敏感型突变体和乙烯不敏感型突变体进一步研究两者在NH4NO3诱导根毛分叉中的相互作用。
由图4,A可知,乙烯不敏感型突变体etr1-3及生长素不敏感型突变体axr1-3和aux1-7在高浓度NH4NO3存在时,与野生型相似也产生大量的分叉根毛。外源1 μmol·L-1ACC和0.1 μmol·L-1
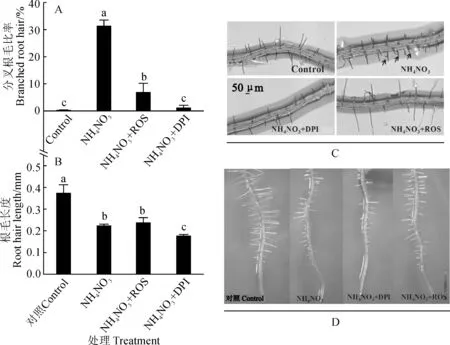
图2 ROS和DPI在NH4NO3诱导拟南芥根毛分叉中的作用Fig.2 Effects of ROS and DPI on NH4NO3-induced root hair formation in Arabidopsis seedlings

图3 生长素(IAA)和乙烯(ACC)抑制NH4NO3诱导的拟南芥根毛分叉Fig.3 Auxin(IAA)and ethylene(ACC)inhibited NH4NO3-induced branched root hair formation in Arabidopsis seedlings

图4 ACC、IAA和NAA在NH4NO3诱导的拟南芥分叉根毛形成中的作用Fig.4 Effects of ACC, IAA and NAA on NH4NO3-induced branched root hair formation in etr1-3, aux1-7 and axr1-3 seedlings
IAA处理各种突变体时,对于etr1-3来说,ACC的处理使分叉根毛减少了25.2%,而IAA的处理则使分叉根毛几乎不存在,分叉根毛的比率约是对照的1/20。这说明在缺乏乙烯信号传递时生长素能够抑制由于NH4NO3的存在而导致的根毛分叉,ACC之所以能部分抑制etr1-3分叉根毛的产生是因为etr1-3并非完全对ACC不敏感。对于axr1-3来说,IAA的处理使分叉根毛减少了24.6%,ACC处理则导致分叉根毛的比率仅为对照的1/20。这说明在缺乏生长素信号传递时,乙烯同样也能抑制分叉根毛的产生。aux1-7不仅抗生长素而且也抗乙烯[26],外源IAA和ACC处理aux1-7均不能抑制由于NH4NO3的存在而导致的根毛分叉现象(图4,A)。

图5 ACC和IAA在NH4NO3诱导的拟南芥突变体etr1-1分叉根毛形成中的作用Fig.5 Effects of ACC and IAA on NH4NO3-induced branched root hair formation in etr1-1 seedlings
突变体aux1-7是缺乏生长素运输载体的突变体,而NAA主要通过扩散进入植物体[27],如果生长素在缺乏乙烯信号传递时能够抑制由于NH4NO3的存在而导致的根毛分叉,外源NAA处理aux1-7应该能够抑制分叉根毛的产生。由图4,B可知,NAA处理抑制了NH4NO3诱导的aux1-7根毛的分叉。以上结果表明,生长素在缺乏乙烯信号传递时能够抑制分叉根毛的产生,而乙烯在缺乏生长素信号传递时也同样能够抑制根毛的分叉,生长素和乙烯2种激素在缺乏对方时,其抑制根毛分叉的作用可以通过另一种激素所起的补充作用来实现。
同时,在抑制NH4NO3诱导的根毛分叉时,生长素和乙烯之间是否还存在着相互依赖关系呢?利用突变体etr1-1来进一步说明这个问题。与NH4NO3处理相比,ACC处理没有显著影响etr1-1分叉根毛的比率,0.1 μmol·L-1IAA处理使etr1-1分叉根毛的比率降低了约50%(图5),而0.1 μmol·L-1IAA处理几乎可以完全抑制WT根毛的分叉(图4,A),说明缺乏乙烯信号时,生长素抑制根毛分叉的作用有所减弱。另外,将IAA的浓度增加为0.5 μmol·L-1,则etr1-1产生分叉根毛的比率可以降低到1.2%,分叉根毛的产生基本解除(图5)。表明生长素能够抑制因NH4NO3存在而导致的根毛分叉现象,但在缺乏乙烯信号传递时,需要更高浓度的生长素才能充分发挥其抑制根毛分叉的作用。
3 讨 论
3.1 ROS参与NH4NO3诱导的根毛分叉
不同形态和浓度的氮素对拟南芥根毛的发育有不同的作用。 Vatter等[28]研究发现局部供应铵态氮和硝态氮,随着浓度的增加,根毛的长度逐渐降低,且硝态氮的作用表现得更加明显。前期研究发现,随着氮素浓度的增加,不管是铵态氮还是硝态氮,拟南芥根毛伸长受阻,高浓度铵态氮诱导根毛大量分叉,而高浓度的硝态氮则不能引起根毛的分叉[23]。本试验结果再次表明随着外界NH4NO3浓度的增高,根毛长度呈现递减趋势,而分叉根毛产生的数量则呈现递增趋势。
ROS的产生及分布控制着根毛的正常发育[25]。Carol等[29]研究发现,与野生型相比,突变体scn1 根毛中ROS的产生不是集中于根毛的顶端,而是分布于整个根毛的表面,根毛分叉严重,说明ROS的正确分布对根毛的顶端伸长发挥重要的作用。PFT1通过调控过氧化物酶的表达而参与调节ROS的产生,突变体pft1 的根毛起始和伸长均受阻,表明ROS的产生和分布对根毛发育至关重要[30]。本研究结果显示,外源ROS(以OH·形式提供)与高浓度NH4NO3共同处理拟南芥幼苗可以一定程度上抑制根毛分叉,表明ROS参与调控了NH4NO3诱导的根毛分叉。Carol等[29]研究还显示双突变体scn1rhd2 产生的根毛数量很少,但是分叉根毛的形成大大减少,再次说明ROS是调控根毛发育的关键因子。在本试验中,外源DPI与NH4NO3共同处理使根毛产生数量减少,但是所产生的根毛中几乎没有分叉根毛,进一步证明ROS的产生及正确分布在NH4NO3调控根毛发育中发挥着重要作用。
3.2 生长素和乙烯相互作用抑制分叉根毛的产生
生长素和乙烯是调控根毛发育的关键因子。Pitts等[7]发现与生长素和乙烯信号传递相关的突变体严重影响根毛的发育,外源2, 4-D和ACC处理野生型拟南芥和突变体axr1、etr1后,根毛的长度与未处理的相比明显增长。这些结果表明生长素和乙烯能够促进根毛的顶端伸长。Ringli等[31]筛选到8种der(deformed root hairs)突变体,有些影响根毛的起始,有些影响根毛的顶端伸长,这些突变体从不同的发育阶段影响根毛生长。外源生长素和乙烯的处理抑制其中一些突变体根毛发育的异常现象说明两者影响了根毛发育的整个过程[31]。本研究结果显示,外源生长素和乙烯处理生长于高浓度NH4NO3条件下的拟南芥幼苗,可以基本解除由于NH4NO3存在而引起的根毛分叉,表明生长素和乙烯参与了NH4NO3诱导的根毛发育。
Takahashi等[32]报道外源生长素和乙烯相互作用调控莴苣根毛的发生。生长素和乙烯均通过调控微管排列而诱导莴苣根毛的产生,乙烯是通过生长素的作用而实现的。Rahman等[33]研究发现在根毛发育的不同阶段生长素和乙烯以不同的相互作用方式调控根毛的发育。在根毛发育的早期,缺乏乙烯信号传递时(如对于突变体ein2-1)内源生长素可以发挥弥补缺乏乙烯的作用;而在根毛顶端伸长阶段,生长素和乙烯共同调控这个阶段,当缺乏乙烯信号传递时,根毛的顶端伸长过程需要更高浓度的生长素才能完成。本研究结果与以上结果相似,生长素和乙烯都能抑制由于NH4NO3的存在而导致的根毛分叉现象,缺乏生长素信号传递时,乙烯可以发挥补充作用,而当缺乏乙烯信号传递时,生长素也可以发挥补充作用,只是需要更高浓度的生长素才能充分发挥其抑制根毛分叉的作用。
综上所述,本研究结果表明,ROS参与了NH4NO3诱导的拟南芥根毛分叉,生长素和乙烯相互作用抑制NH4NO3诱导的分叉根毛形成。
参考文献:
[1]DOLAN L, DUCKETT C, GRIERSON C,etal. Clonal relations and patterning in the root epidermis ofArabidopsis[J].Development, 1994, 120: 2 465-2 474.
[2]GALWAY M E, MASUCCI J D,etal. The TTG gene is required to specify epidermal cell fate and cell patterning in theArabidopsisroot [J].Developmentalbiology, 1994,166(2): 740-754.
[3]BIBIKOVA T, GILROY S. Root hair development[J].JournalofPlantGrowthRegulation, 2002,21(4): 383-415.
[4]OLDROYD G E, DIXON R. Biotechnological solutions to the nitrogen problem[J].CurrentOpinioninBiotechnology, 2014, 26: 19-24.
[5]TANIMOTO M, ROBERTS K, DOLAN L. Ethylene is a positive regulator of root hair development inArabidopsisthaliana[J].ThePlantJournal, 1995,8(6): 943-948.
[6]MASUCCI J D, SCHIEFELBEIN J W. Hormones act downstream of TTG and GL2 to promote root hair outgrowth during epidermis development in theArabidopsisroot [J].ThePlantCell, 1996,8(9): 1 505-1 517.
[7]PITTS R J, CERNAC A, ESTELLE M. Auxin and ethylene promote root hair elongation inArabidopsis[J].ThePlantJournal, 1998,16(5): 553-560.
[8]MASUCCI J D, SCHIEFELBEIN J W. Therhd6 mutation ofArabidopsisthalianaalters root-hair initiation through an auxin-and ethylene-associated process[J].PlantPhysiology, 1994,106(4): 1 335-1 346.
[9]KIEBER J J, ROTHENBERG M, ROMAN G,etal. CTR1, a negative regulator of the ethylene response pathway inArabidopsis, encodes a member of the raf family of protein kinases [J].Cell, 1993,72(3): 427-441.
[10]LEYSER H M, PICKETT F B, DHARMASIRI S,etal. Mutations in the AXR3 gene ofArabidopsisresult in altered auxin response including ectopic expression from the SAUR-AC1 promoter [J].ThePlantJournal, 1996,10(3): 403-413.
[11]LINCOLN C, BRITTON J H, ESTELLE M. Growth and development of theaxr1 mutants ofArabidopsis[J].ThePlantCell, 1990,2(11): 1 071-1 080.
[12]WILSON A K, PICKETT F B, TURNER J C,etal. A dominant mutation inArabidopsisconfers resistance to auxin, ethylene and abscisic acid [J].MolecularandGeneralGenetics, 1990,222(2-3): 377-383.
[13]CHO M, SANG H L, CHO H T. P-Glycoprotein4 displays auxin efflux transporter-like action inArabidopsisroot hair cells and tobacco cells [J].ThePlantCell, 2007,19(12): 3 930-3 943.
[14]LEE R D, CHO H. Auxin, the organizer of the hormonal/environmental signals for root hair growth [J].FrontiersinPlantScience, 2013: 448-454.
[15]MULLER M, SCHMIDT W. Environmentally induced plasticity of root hair development inArabidopsis[J].PlantPhysiology, 2004,134(1): 409-419.
[16]SHIN R, BERG R H, SCHACHTMAN D P. Reactive oxygen species and root hairs inArabidopsisroot response to nitrogen, phosphorus and potassium deficiency [J].PlantandCellPhysiology, 2005,46(8): 1 350-1 357.
[17]WEI Y, PERRY P J,etal. Manganese deficiency alters the patterning and development of root hairs inArabidopsis[J].JournalofExperimentalBotany, 2008,59(12): 3 453-3 464.
[18]JUNG J, SHIN R, SCHACHTMAN D P. Ethylene mediates response and tolerance to potassium deprivation inArabidopsis[J].ThePlantCell, 2009,21(2): 607-621.
[19]NIU Y, CHAI R,etal. Magnesium availability regulates the development of root hairs inArabidopsisthaliana(L.) Heynh [J].Plant,CellandEnvironment, 2014,37(12): 2 795-2 813.
[20]ZHU C H, YANG N, GUO Z F,etal. An ethylene and ROS-dependent pathway is involved in low ammonium-induced root hair elongation inArabidopsisseedlings [J].PlantPhysiologyandBiochemistry, 2016, 105: 37-44.
[21]MARTIN REJANO E M, CAMACHO CRISTOBAL J J, HERRERA RODRIGUEZ M B,etal. Auxin and ethylene are involved in the responses of root system architecture to low boron supply inArabidopsisseedlings [J].PhysiologiaPlantarum, 2011,142(2): 170-178.
[22]NAGARAJAN V K, SMITH A P. Ethylene’s role in phosphate starvation signaling: more than just a root growth regulator [J].PlantandCellPhysiology, 2011,53(2): 277-286.
[23]YANG N, ZHU C H, GAN L J,etal. Ammonium-stimulated root hair branching is enhanced by methyl jasmonate and suppressed by ethylene inArabidopsisthaliana[J].JournalofPlantBiology, 2011,54(2): 92-100.
[24]FOREMAN J, DEMIDCHIK V, BOTHWELL J H,etal. Reactive oxygen species produced by NADPH oxidase regulate plant cell growth [J].Nature, 2003,422(6 930): 442-446.
[25]SALAZAR-HENAO J E, VEKEZ-BERMUDEZ I C, SCHMIDT W. The regulation and plasticity of root hair patterning and morphogenesis [J].Development, 2016,143(11): 1 848-1 858.
[26]PICKETT F B, WILSON A K, ESTELLE M. Theaux1 mutation ofArabidopsisconfers both auxin and ethylene resistance [J].PlantPhysiology, 1990,94(3): 1 462-1 466.
[27]DELBARRE A, MULLER P, IMHOFF V,etal. Comparison of mechanisms controlling uptake and accumulation of 2,4-dichlorophenoxy acetic acid, naphthalene-1-acetic acid, and indole-3-acetic acid in suspension-cultured tobacco cells [J].Planta, 1996,198(4): 532-541.
[28]VATTER T, NEUHAUSER B,etal. Regulation of length and density ofArabidopsisroot hairs by ammonium and nitrate [J].JournalofPlantResearch, 2015,128(5): 839-848.
[29]CAROL R J, TAKEDA S, LINSTEAD P,etal. A RhoGDP dissociation inhibitor spatially regulates growth in root hair cells [J].Nature, 2005,438(7 070): 1 013-1 016.
[30]SUNDARAVELPANDIAN K N, CHANDRIKA N P, TSAI Y,etal. PFT1-controlled ROS balance is critical for multiple stages of root hair development inArabidopsis[J].PlantSignalingandBehavior, 2013,8(5): e24066.
[31]RINGLI C, BAUMBERGER N, KELLER B. TheArabidopsisroot hair mutantsder2-der9 are affected at different stages of root hair development [J].PlantandCellPhysiology, 2005,46(7): 1 046-1 053.
[32]TAKAHASHI H, KAWAHARA A, INOUE Y. Ethylene promotes the induction by auxin of the cortical microtubule randomization required for low-pH-induced root hair initiation in lettuce (LactucasativaL.) seedlings [J].PlantandCellPhysiology, 2003,44(9): 932-940.
[33]RAHMAN A, HOSOKAWA S, OONO Y,etal. Auxin and ethylene response interactions duringArabidopsisroot hair development dissected by auxin influx modulators [J].PlantPhysiology, 2002,130(4): 1 908-1 917.
