果胶改性纳米纤维制备及其在固定化酶中的应用
2018-03-30翠娥
,翠娥,
(安徽工程大学 纺织服装学院,安徽 芜湖 241000)
固定化酶的催化活性与载体的性质密切相关,优良的载体一方面可提高酶的固载量,另一方面也可保持酶的活性[1-2],因此构建合适的载体是酶固定化的重要环节.目前常用固定酶的载体有纳米金属材料、磁性纳米材料、多孔纳米材料等[3-4].其中,电纺丝纳米纤维是酶固定良好的载体之一,其优点包括:巨大的比表面积和富含功能性反应基团有利于酶固载量的提高;通过对纳米纤维的改性可以防止酶构象的扭曲以保证酶处于高活性构象状态;方便回收利用.目前报道的用于固定脂肪酶的电纺丝纳米纤维在固载量和生物相容性两方面仍较难实现完美统一[5].
果胶是一种非淀粉多糖类的可溶性膳食纤维,无毒、生物可降解、来源广泛[6],此外,果胶能有效减少蛋白的凝固沉淀,在一定 pH、温度变化内保护酪蛋白,且表面有大量功能性基团[7-8],可大量固定酶分子.综上,基于静电纺丝技术制备甲基丙烯酸甲酯-丙烯酸(PMMA-co-PAA)共聚电纺丝纳米纤维,并用果胶对纳米纤维表面进行改性,利用果胶的生物相容性为脂肪酶提供良好的生物环境,果胶的亲水性能为脂肪酶提供微水体系,有效维持酶在复杂环境下的稳定性,此外,果胶侧链有大量功能性基团,可有效固定脂肪酶,提高酶的固载量.
1 实验部分
1.1 试剂与仪器
丙烯酸(CP,上海凌峰化学试剂有限公司);甲基丙烯酸甲酯(98%,上海凌峰化学试剂有限公司);N,N-二甲基甲酰胺(AR,国药集团化学试剂有限公司);偶氮二异丁氰(CP,阿拉丁试剂上海有限公司);铝箔(东京化成工业株式会社);亮蓝G250(上海瀚思化工有限公司);磷酸(88%,无锡市亚盛化工有限公司);无水乙醇(AR,无锡市亚盛化工有限公司);聚乙二醇1788(AR,阿拉丁试剂上海有限公司);橄榄油(CP,阿拉丁试剂上海有限公司);氯化钠、氯化钾(AR,天津市科密欧化学试剂有限公司);氢氧化钠、磷酸氢二钠、磷酸二氢钾(AR,无锡市亚盛化工有限公司);果胶(98%,阿拉丁试剂上海有限公司);南极假丝酵母脂肪酶B(6%,杭州创科生物科技有限公司);蒸馏水,自制.
JZB-1800D双道注射泵(费森尤斯卡比健源(长沙)医疗科技有限公司);JSM-7500F扫描电子显微镜(SEM)(日本电子株式会社);DF-101S集热式恒温加热磁力搅拌器(杭州大卫科教仪器有限公司);PHS-3CpH计(上海仪电科学仪器股份有限公司);EA2004N电子天平(常州市衡正电子仪器有限公司);DSA-25型视屏光学接触角测量仪(德国Dataphysics公司).
1.2 实验过程
(1)纳米纤维的制备.①PMMA-co-PAA共聚物制备.通过溶液聚合法制备PMMA-co-PAA.取32 mL N,N-二甲基甲酰胺(DMF)于锥形瓶中,加入1.1 mL丙烯酸(AA),14 mL甲基丙烯酸甲酯(MMA)及0.076 g偶氮二异丁腈(AIBN),通入氮气,在70 ℃恒温水浴锅中反应2 h后加入8 mL DMF,0.076 g AIBN,0.55 mL AA继续反应,2 h后再加入8 mL DMF,0.076 g AIBN,0.55 mL AA,反应20 h后取出,用丙酮稀释,加入石油醚,过滤取沉淀,将沉淀真空干燥至恒重.②基于静电纺丝技术制备PMMA-co-PAA纳米纤维.将上述制备的PMMA-co-PAA聚合物用DMF配置成11%的纺丝液前驱体,将配制好的前驱体溶液移入注射器中,设置进样速度为0.3 mL/h,纺丝间距为14 cm,针头接入正极,铝箔接入负极,调节电压为18 kV且恒定,滚筒速度100 r/min.PMMA-co-PAA共聚反应如图1所示.
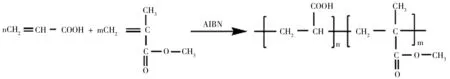
图1 PMMA-co-PAA共聚反应
(2)纳米纤维膜活化.取一定量PMMA-co-PAA纳米纤维膜,分别用蒸馏水和磷酸盐缓冲溶液(PBS,0.05 M,pH 7.0)冲洗.将清洗过的纳米纤维膜放入含有一定EDC/NHS(EDC和NHS的摩尔比为1∶1)的PBS中反应活化,在25 ℃水浴中浸泡1 h后取出.活化的纳米纤维膜用大量PBS冲洗,以除去表面粘附的活化剂.将纳米纤维膜自然风干保存备用.
(3)果胶改性膜材料.配置不同质量浓度的果胶溶液,与活化过的膜放入水浴锅中震荡2 h,取出后用PBS反复冲洗,以除去表面粘附的残留果胶,将活化的膜晾干保存备用.
(4)固定酶.配制脂肪酶溶液(酶溶液与PBS溶液体积比为2∶3),将表面活化的PMMA-co-PAA与PMMA-co-PAA@果胶纳米纤维膜浸入酶溶液中,于25 ℃水浴中振荡反应18 h.将膜取出,用大量PBS冲洗,以除去表面附着的酶液.将固定化酶膜吸干,于4 ℃下储存备用.
1.3 测试与表征
(1)酶固载量的测定.酶溶液和清洗液中的酶蛋白量用Bradford法测定[9],固定到载体上的酶蛋白量可以用下面的公式计算:
×100%
式中,Ae是固定酶蛋白量(mg/g);C0和C分别是反应液中起始和固定化后的酶质量浓度(mg/mL);V是反应液的体积(mL);W是载体的质量(g);数据是3次测定值所得的平均值.
(2)酶活的测定.根据GB/T 23535-2009测量酶活[10].酶活可以用下面的公式计算:

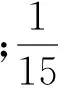
2 结果与讨论
2.1 红外光谱分析

图2 PMMA-co-PAA红外光谱
PMMA-co-PAA的红外光谱图如图2所示.由图2可以明显看出,1 736 cm-1处是酯羰基的伸缩振动峰,1 710 cm-1处是羧酸羰基的伸缩振动峰,这两个峰有重叠;3 400 cm-1处是羧酸中羟基的伸缩振动峰,表明聚合物中酯和羧酸同时存在;而2 986 cm-1,2 932 cm-1,2 843 cm-1处是甲基和亚甲基的伸缩振动峰.红外图谱表明聚合物是PMMA-co-PAA.
2.2 扫描电镜分析
纳米纤维果胶改性前后的电镜照片如图3所示.从图3中可以看出,PMMA-co-PAA纳米纤维的直径在400~600 nm左右.修饰果胶后纤维的直径增加到500~700 nm,这是因为在纤维表面接枝了一层果胶,果胶本身为线型多糖聚合物,经果胶修饰后,纤维的质地也变得柔软,固定酶之后,纤维的直径进一步增加到700~900 nm左右.另外,从图3中可以明显地看到纳米纤维表面变得粗糙.

图3 纳米纤维的扫描电镜图
2.3 静态接触角分析
果胶质量浓度对材料亲水性能的影响如表1所示.纳米纤维的静态接触角如图4所示.从表1及图4可知,修饰果胶前后纳米纤维的亲水性能发生显著变化,修饰之前的PMMA-co-PAA纳米纤维接触角为103.7°(见图4a),表现出明显的疏水性能;修饰有果胶之后,PMMA-co-PAA@果胶的静态接触角明显降低(见图4b),呈现优良的亲水性能.继续提高果胶质量浓度会提高材料的亲水性能,但影响并不大,可能是因为PMMA-co-PAA纤维为良好的疏水性材料,当在其表面裹覆一层果胶后,果胶表面大量的亲水基团赋予了纤维较好的亲水性,降低了其静态接触角,极大地改善了其亲水性,继续增加果胶质量浓度不能明显地改变其亲水性.较好的亲水性可以为脂肪酶提供良好的微水环境,有利于脂肪酶保持较高的活性.

表1 果胶质量浓度对材料亲水性能的影响
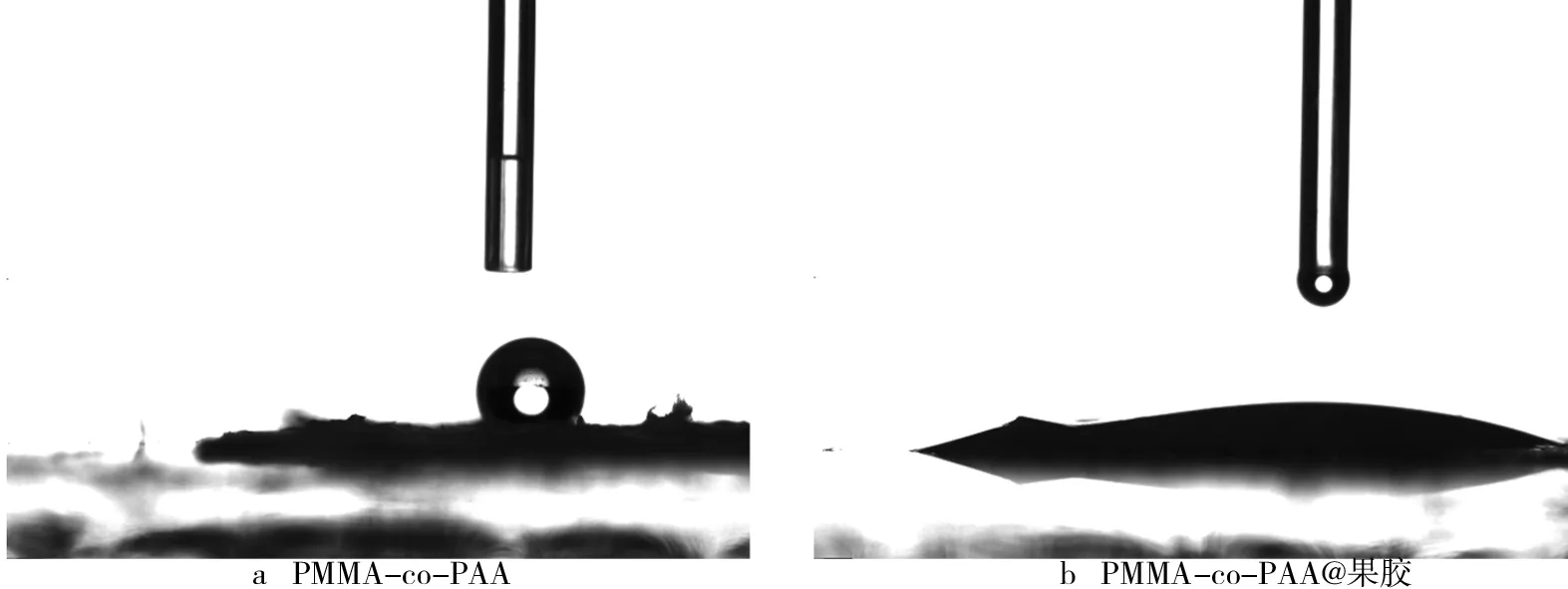
图4 纳米纤维的静态接触角
2.4 载酶量测定
果胶质量浓度对酶载量的影响如图5所示.由图5可看出,未经果胶改性的纳米纤维对酶的固载量为83 mg/g,经果胶改性后,当果胶质量浓度从0.1 mg/mL升高到0.15 mg/mL时,酶的固载量从114 mg/g增加到150 mg/g.未经果胶改性的纳米纤维表面功能基团较少,难以大量地固载脂肪酶.经果胶改性后,随着果胶质量浓度的增加,使得固定酶的功能基团增加,导致酶的固载量提高.继续增加果胶的质量浓度,酶的固载量反而下降,这可能是由于果胶质量浓度的进一步增加,使得表面的空间位阻显著增加,另外,当果胶在纤维膜上的密度增加,其侧链上羟基距离变小,羟基之间容易形成氢键,降低了羟基的反应性能.
2.5 固定化酶的稳定性研究
(1)不同pH下改性前后纳米纤维固定化酶相对酶活的比较.不同pH下改性前后纳米纤维固定化酶相对酶活的比较如图6所示.由图6可以看出,经改性后的PMMA-co-PAA纳米纤维其pH稳定性有了显著地增强.pH为5时,改性前后纳米纤维的相对酶活均较高,基本都能维持在70%以上,PMMA-co-PAA@果胶纳米纤维的相对酶活略高于PMMA-co-PAA纳米纤维;在pH为7时,相对酶活最大;当pH逐渐升高时,相对酶活都呈下降趋势;在pH为9时,PMMA-co-PAA固定化酶相对酶活降至30%,而PMMA-co-PAA@果胶固定化酶相对酶活仍保持在65%左右,可能是由于果胶为生物酶提供了良好的生物环境,果胶表面的大量亲水性基团可以在相对苛刻的条件下继续维持脂肪酶生存的微水环境,相比固定于PMMA-co-PAA上的脂肪酶而言,固定于PMMA-co-PAA@果胶上的脂肪酶处于更优的生存环境.因此,实验结果可以说明果胶改性纳米纤维有利于提升固定化酶的pH稳定性.
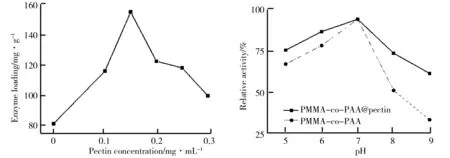
图5 果胶质量浓度对酶载量的影响图6 不同pH下改性前后纳米纤维固定化酶相对酶活的比较
(2)不同温度下改性前后纳米纤维固定化酶相对酶活的比较.不同温度下改性前后纳米纤维固定化酶相对酶活的比较如图7所示.由图7可以看出,30 ℃时固定化酶的相对酶活最高.在较低的温度下,如20 ℃时的相对酶活均保持在70%左右,这可能是因为较低温度下,酶的构象变化比较慢,催化活性较低.温度升高到40 ℃时,改性前后纳米纤维固定化酶的相对酶活都保持在80%左右,进一步提高温度,固定于PMMA-co-PAA上的脂肪酶迅速失活,60 ℃时的相对酶活仅保持45%,这可能是因为较高温度下,酶蛋白的高级结构被破坏;同样温度下,固定于PMMA-co-PAA@果胶上的脂肪酶相对酶活能保持78%,生物相容性载体的存在有效地保护了脂肪酶的二级结构,使得脂肪酶在较高温度下也能维持较高的活性.这使得脂肪酶有望应用于较高温度下的催化,拓展了酶的催化范围.
(3)50 ℃下改性前后纳米纤维固定化酶储存稳定性的比较.50 ℃时改性前后纳米纤维固定化酶储存稳定性的比较如图8所示.由图8可以看出,固定于PMMA-co-PAA@果胶上的脂肪酶处于较优的生存环境,因此其储存稳定性也会有所增强.随着储存时间的延长,固定化酶的相对酶活都呈现下降趋势,10 h后,固定在PMMA-co-PAA的脂肪酶相对酶活剩余20%,相比未改性的纳米纤维,固定在PMMA-co-PAA@果胶的脂肪酶的稳定性能有显著提高.同样时间长度下,脂肪酶的相对酶活保持在73%,这使得脂肪酶有望在较高温度下实现长时间催化,增加催化效果.

图7 不同温度下改性前后纳米纤维固定化酶相对酶活的比较 图8 50 ℃时改性前后纳米纤维固定化酶储存稳定性的比较
3 结论
基于静电纺丝制备稳定均一的PMMA-co-PAA纳米纤维,经果胶改性后得到生物相容性较好,且表面有大量功能性基团的纳米纤维,有效地提高了酶的固载量与稳定性,当果胶质量浓度在0.15 mg/mL时,固定化酶的酶载量最大,可达150 mg/g.该改性纤维有效克服了聚合物纤维生物相容性差的缺点,脂肪酶经过固定于改性纳米纤维之后,其pH稳定性、温度稳定性和较高温度下的储存稳定性都有显著提高.同时,载体的制备简单方便、成本低、重复性好,因此,酶的固定有望进一步提高其催化性能,拓展其催化范围.
[1] Q Y GAO,G C XU,H L CHEN,et al.Research progress of nanoparticles for immobilized enzymes[J].Biotechnology Bulletin,2013(6):20-24.
[2] M HARTMANN,X KOSTROV.Immobilization of enzymes on porous silicas-benefits and challenges[J].Chem.Soc.Rev.,2013,42(15):6 277-6 289.
[3] S DING,A A CARGILL,I L MEDINTZ,et al.Increasing the activity of immobilized enzymes with nanoparticle conjugation[J].Curr.Opin.Biotechnol.,2015,34:242-250.
[4] Z ZHOU,M HARTMANN.Progress in enzyme immobilization in ordered mesoporous materials and related applications[J].Chem.Soc.Rev.,2013,42(9):3 894-3 912.
[5] Y LV,X TAN,F SVEC.Preparation and applications of monolithic structures containing metal-organic frameworks[J].J.Sep.Sci.,2017,40(1):272-287.
[6] V ARAVINDAN,J SUNDARAMURTHY,P S KUMAR,et al.Electrospun nanofibers:a prospective electro-active material for constructing high performance Li-ion Batteries[J].Chem.Commun.,2015,51(12):2 225-2 234.
[7] G FRANCUCCI,E RODRIGUEZ.Processing of plant fiber composites by liquid molding techniques:an overview[J].Polym.Compos.,2016,37(3):718-733.
[8] M F BORISENKOV,L A BAKUTOVA,V V GOLOVCHENKO,et al.Impact of cabbage pectin-protein complex on microbial β-glucuronidase activity[J].J.Agric.Food.Chem.,2013,61(12):3 054-3 058.
[9] 张志涛,刘金生,许强,等.Bradford法测定牛奶中蛋白质含量[J].食品与机械,2011,27(5):128-130.
[10] GB/T 23535-2009,脂肪酶制剂[S].北京:中国标准出版社,2009.
