BOLD-MRI对高氧状态下胎盘氧合状况改变的初步探索
2018-03-27庞颖包雨微孙子燕李茜夏黎明
庞颖, 包雨微, 孙子燕, 李茜, 夏黎明
充足的氧气供应是胎儿生长和发育的必备条件,胎儿的氧气供给主要取决于母体子宫的血供及氧含量、胎盘的血流及氧灌注以及脐静脉的血流[1-2]。氧分子体积小且具有亲脂性,在细胞内外氧分压存在梯度时,很容易穿透胎盘的细胞膜[3-6]。
BOLD-MRI技术已经广泛应用于中枢神经系统,国外也有少量文献把BOLD-MRI用于宫内缺氧动物模型以及高氧状态下人类胎儿胎盘[7-9]。胎盘功能下降,导致母体氧气及养分向胎儿供应量的减少,是胎儿生长受限(fetal growth restriction,FGR)的重要原因之一。FGR的新生儿围生期死亡率及并发症发生率较高[10],童年期间较同龄儿体形小,成年后患高血压、冠心病及脑卒中的概率较正常人高[11],因此及时准确地评估胎盘的氧合功能对临床具有重要的指导意义,胎盘的氧运输功能可以通过脐穿刺获得脐血管的氧含量来评估,但是这种有创的检查存在风险,在临床上应用并不多。临床上主要通过多普勒胎心音检测及胎儿心电图的ST波分析来间接反映胎儿的宫内缺氧状态,目前尚无可以直接无创地检测胎盘及胎儿氧合状态的方法。本研究采用无创的BOLD-MRI技术去评估正常胎盘在高氧情况下氧合状态的改变,探讨BOLD-MRI成为潜在的胎盘功能检测方法的可能性,并为研究胎盘功能下降提供基础研究。
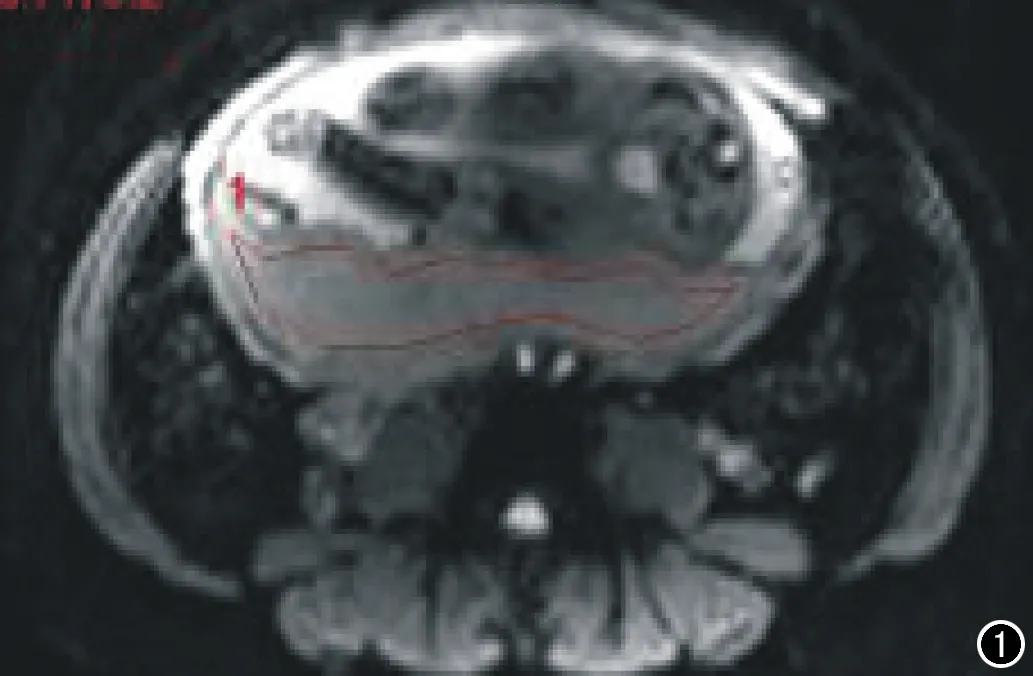
图1 红线为勾画的胎盘ROI曲线。
材料与方法
1.临床资料
2016年10月-2017年3月在本院行MRI检查的孕妇20例,20例均先行外院或本院超声检查,因胎儿畸形而非胎盘病变而就诊,胎儿体重及脐动脉、母体子宫动脉血流均正常范围。孕妇年龄21~34岁,孕周22周+1~37周+3,平均30周+3。本研究中所有检查孕妇和家属均签署知情同意书。
2.检查方法
采用Siemens Skyra 3.0T磁共振扫描仪和18通道腹部相控阵线圈。孕妇无需注射镇静剂及对比剂,采用仰卧位或侧卧位,无需屏气扫描,先以胎盘为中心行孕妇盆腔横轴面、矢状面和冠状面HASTE序列三平面定位扫描,观察胎盘的形态及信号状况,然后再行横轴面BOLD扫描。扫描前孕妇带好吸氧面罩,前3min吸入空气,后7min持续吸入纯度大于90%的氧气(流速12 L/min),边吸气边持续扫描10 min,采用T2*序列采集数据,10 min内总共采集75个动态周期。HASTE序列扫描参数:TR 1100 ms,TE 87 ms,层厚4 mm,间距4.8 mm,视野70 cm×40 cm,激励次数1。 BOLD序列扫描参数:TR 8000 ms,TE 30 ms,层厚6 mm,间距4.8 mm,视野220 cm×150 cm,激励次数1,反转角90°。
3.图像和数据分析
使用Siemens Syngo工作站对图像后处理,选取胎盘显示较好的层面,避开血管、血窦及胎盘出血、囊变区,选取比较信号比较均质的胎盘区域,勾画2个ROI(不同层面)并求取信号值(图1)。为了避免孕妇呼吸运动的干扰,依次根据每个动态周期适当调整ROI的位置,每个病例在不同层面勾勒两个ROI区域,测量对应的BOLD信号值,并求取两组数据的平均值。在扫描的10 min75个周期内,每个ROI会对应75个BOLD信号值 ,首先选取前3 min的平均值作为标准化的参考值(BOLDnormoxia),然后选取后7 min的平均值作为BOLDhyperoxia,最后计算出△BOLD,△BOLD=(BOLDhyperoxia-BOLDnormoxia)×100%,使用matlab画出时间-信号曲线图。
吸氧后的BOLDhyperoxia和吸氧前的BOLDnormoxia采用t检验进行统计学分析,以P<0.05为差异具有统计学意义。
结 果
所有孕妇前3 min吸入空气的BOLDnormoxia平均值为295.12 ,后7 min吸入氧气后的BOLDhyperoxia平均值为323.88,△BOLD=(BOLDhyperoxia-BOLDnormoxia)×100%=10.7%±1.4%。对吸氧前后的数值采用配对t检验进行统计学分析,差异有统计学意义(t=5.3471,P=0.00004)。 使用metlab画出时间-信号曲线图,吸氧后较吸氧前的△BOLD显著上升(图2)。
讨 论
目前,关于MRI对于胎盘的研究方向主要集中于诊断胎盘植入方面[12],功能磁共振研究相对较少。BOLD作为研究脑功能的传统序列之一,最近也有一些研究把其扩展应用于体内大血管及其它器官如肾脏、药物负荷状态下的心肌等氧合状态的评估,但是用于胎盘的研究较少。有研究对羊胎等给予不同氧浓度刺激,使用BOLD-MRI研究其在不同条件下的信号变化情况,证实了羊胎器官的氧合水平与BOLD信号之间具有紧密相关性。
高氧或低氧会引起胎盘和胎儿器官去氧血红蛋白和含氧血红蛋白含量的改变。去氧血红蛋白为顺磁性,含氧血红蛋白为抗磁性,高氧状态下,去氧血红蛋白浓度减少,延长了T2*的释放时间,BOLD信号增高。BOLD信号的绝对值除了受到脱氧血红蛋白所占比例的影响之外,还受到了多种因素的综合影响,比如物理学因素上如距离射频线圈的距离、磁场均匀性、序列参数尤其是回波时间,以及生理学因素如血红蛋白的浓度、血细胞比容、组织的血流量和血容量等,所以仅仅测量BOLD信号值,可重复性不高[9,13-14]。因此,不同孕妇胎盘的BOLD信号的绝对值变化较大,而且同一个孕妇不同时期测得的数值可能也会有所差别,但是勾勒同一个胎盘不同的ROI并计算求出的△BOLD可重复性比较好。

图2 吸氧前后胎盘△BOLD时间-信号曲线图。
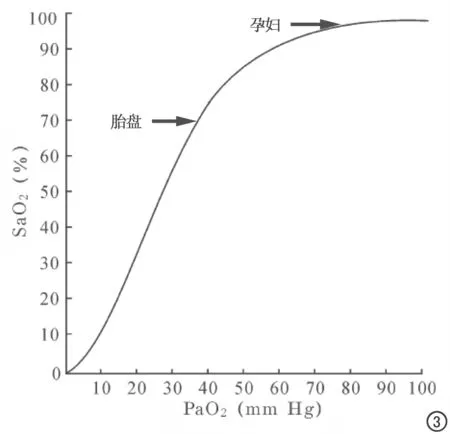
图3 正常人血红蛋白的氧离曲线。PaO2:氧分压,SaO2:血红蛋白氧饱和度。
母体的高氧状态会引起胎儿氧供的增加,前提是胎盘功能正常[15]。母体的高氧状态会引起母体绒毛间隙血液的氧分压增高,从而导致氧气穿透胎盘细胞膜由母体向胎儿方向扩散。正常状态下,母体的血氧饱和度大约为98%左右,接近饱和,而胎儿血的血氧饱和度只有约70%。对照氧解离曲线图[16](图3),胎儿的血样饱和度处于一个较低水平,且处于曲线较陡峭的部分,因此对供氧条件的改变更加敏感,氧分压一旦产生改变,胎儿及胎盘的△BOLD变化则更加明显[5,17]。
为了测量值准确,需要尽量保证ROI始终位于同一位置没有大的波动,扫描过程中孕妇始终保持同一姿势不变,在BOLD序列扫描之前即带好吸氧面罩,以避免造成对孕妇的打扰,吸氧过程中持续扫描不间断,对于孕妇呼吸运动造成的波动,在后处理过程中根据每个动态周期适当手动微调ROI的位置,尽量保证其始终位于胎盘的同一位置内。不同胎盘的△BOLD之间存在差异,分析原因除了个体生理学因素的差异之外,可能还和面罩未能完全紧贴孕妇口鼻,二者之间可能存在不同程度的空隙,引起不同量的空气混入氧气吸入体内引起氧分压的不同而造成。
Sorensen等[9]研究发现胎盘的胎儿面信号较暗的区域及母体面信号较亮的区域之间在高氧状态下的△BOLD值差异较大。同样的高氧状态下,胎儿面的胎盘组织BOLD值变化更明显,很可能是因为此区域富含胎盘绒毛,血供丰富。本研究在探索的初期,也曾尝试分别勾画母体及胎儿面胎盘ROI区,分别测量△BOLDmaternal和△BOLDfetal,但是测量的数值的可重复性较低。可能和二者之间解剖结构分解欠清晰有关,完全区分两者实际操作起来有一定难度。
胎盘功能正常的妊娠,脐静脉的氧分压和子宫静脉的氧分压非常接近,因此高氧状态下,胎盘的BOLD值增加也反应了由胎盘向胎儿的氧供应,因此可以用△BOLD去有效的评估胎盘功能状态,有了这个研究基础,此技术还可进一步用来评估胎盘功能不良的疾病如FGR。子宫-胎盘功能不全,导致母体氧气及养分向胎儿供应量的减少,是FGR的重要原因。脐穿刺显示生长发育受限的胎儿常表现为低氧状态及伴随的高碳酸血症以及酸中毒[18-19],但是脐穿刺具有一定的风险性,而且迄今临床上尚没有无创评估胎儿氧合状态的方法。
本研究证实了在母体高氧状态下,BOLD具有作为无创技术去实时评估胎盘的氧合状态的潜能,还可以同时用BOLD评估胎儿多个脏器如肝、脾、肾、脑等的氧合状态。有了正常胎盘氧合状态的研究基础,下一步笔者将会进一步将BOLD-MRI应用于FGR进行探索研究。对于比较严重的FGR胎儿做脐穿刺,如果在母体高氧状态下胎儿的血氧分压保持不变,那么意味着胎儿预后不良,需要考虑立即分娩[15],基于这个理论,如果母体高氧情况下,胎盘的BOLD-MRI信号不变或者有所下降,则提示胎盘功能受损及出生预后欠佳。检测FGR的胎盘及胎儿氧合状态,方便指导临床制定合适的治疗计划,减少FGR孕期风险,降低FGR并发症的发生,这将是笔者下一步的研究内容和方向。
[1] Goplerud JM,Delivoria-Papadopoulos M.Physiology of the placenta-gas exchange[J].Ann Clin Lab Sci,1985,15(4):270-278.
[2] Carter AM.Factors affecting gas transfer across the placenta and the oxygen supply to the fetus[J].J Dev Physiol,1989,12(6):305-322.
[3] Desforges M,Sibley CP.Placental nutrient supply and fetal growth[J].Int J Dev Biol,2010,54(2-3):377-390.
[4] Gill JS,Salafia CM,Grebenkov D,et al.Modeling oxygen transport in human placental terminal villi[J].J Theor Biol,2011,291:33-41.
[5] Carter AM.Factors affecting gas transfer across the placenta and the oxygen supply to the fetus[J].J Dev Physiol,1989,12(6):305-322.
[6] Schroder HJ.Comparative aspects of placental exchange functions[J].Eur J Obstet Gynecol Reprod Biol,1995,63(1):81-90.
[7] Wedegartner U,Kooijman H,Andreas T,et al.T2and T2*measurements of fetal brain oxygenation during hypoxia with MRI at 3T:correlation with fetal arterial blood oxygen saturation[J].Eur Radiol,2010,20(1):121-127.
[8] Wedegartner U,Tchirikov M,Schafer S,et al.Functional MR imaging:comparison of BOLD signal intensity changes in fetal organs with fetal and maternal oxyhemoglobin saturation during hypoxia in sheep[J].Radiology,2006,238(3):872-880.
[9] Sorensen A,Peter D,Frund E,et al.Changes in human placental oxygenation during maternal hyperoxia as estimated by BOLD MRI[J].Prenat Diagn,2013,33(2):141-145.
[10] Pryor J.The identification and long term effects of fetal growth restriction[J].Br J Obstet & Gynaecol,1997,104(10):1116-1122.
[11] Barker DJ.Growth in utero and coronary heart diseasep[J].Nutr Rev,1996,54(2 Pt II):S1-S7.
[12] 孔德会,刘翠芳,刘云,等.MRI多征象联合在胎盘植入中的诊断价值[J].放射学实践,2017,32(3):271-274.
[13] Nicolaides KH,Campbell S,Bradley RJ,et al.Maternal oxygen therapy for intrauterine growth retardation[J].Lancet,1987,1(8539):942-945.
[14] Sorensen A,Peters D,Simonsen C,et al.Changes in human fetal oxygenation during maternal hyperoxia as estimated by BOLD MRI[J].Prenatal Diagnosis,2013,33(2):141-145.
[15] Battaglia FC,Meschia G,Makowski EL,et al.The effect of maternal oxygen inhalation upon fetal oxygenation[J].J Clin Invest,1968,47(3):548-555.
[16] 罗凯,罗炎杰.氧离曲线的数学模式与临床意义[J].中国呼吸与危重监护杂志,2007,6(6):448-451.
[17] Meschia G.Fetal oxygenation and maternal ventilation[J].Clin Chest Med,2011,32(1):15-19.
[18] Soothill PW,Nicolaides KH,Bilardo K,et al.Utero-placental blood velocity resistance index and umbilical venous pO2,pCO2,pH,lactate and erythroblast count in growth-retarded fetuses[J].Fetal Therapy,1986,1(4):176-179.
[19] Nicolaides KH,Economides DL,Soothill PW.Blood gases,pH,and lactate in appropriate -and small-for-gestational-age fetuses[J].Am J Obstet Gynaecol,1989,161(4):996-1001.
