动物体内极长链多不饱和脂肪酸代谢及其生理功能
2018-03-20吴永保闻治国杨培龙闫海洁
吴永保,李 琳,闻治国,杨培龙,闫海洁
(中国农业科学院饲料研究所,农业部生物技术重点开放实验室,北京 100081)
极长链不饱和脂肪酸(Very-long-Chain Polyunsaturated Fatty Acids,VLC-PUFA),例如花生四烯酸(AA,C20:4 n-6)、二十碳五烯酸(EPA,C20:5 n-3)、二十二碳六烯酸(DHA,C22:6 n-3)等在人和动物体内起着重要的生理调节作用。对于婴幼儿,VLC-PUFA是其神经系统重要的组成部分,有利于婴幼儿脑部发育,提高智力、学习和记忆;还可以提高婴幼儿视觉的敏锐度、促进生长发育、提高认知能力[1]。对于成年人,VLC-PUFA可以降低血压、血脂以及胆固醇含量;抑制血栓的形成,防止心血管疾病发生[2]。对于老年人,VLC-PUFA可以预防和治疗预防神经性疾病(如预防老年痴呆、减缓躁郁症病情等)、延缓衰老、骨质疏松等方面都有明显的作用[1]。
动物组织中脂肪酸来源主要为饲粮中脂肪酸的沉积和脂肪酸的相互转化。在大多动物体内,不能在Δ9双键和末端甲基之间引入双键,因此,亚油酸(LA,C18:2 n-6)和α-亚麻酸(ALA,C18:3 n-3)为动物饲粮中必需脂肪酸,分别作为n-6和n-3 PUFA的合成前体[3],动物体自身无法合成VLC-PUFA,其大部分依靠这些前体转化。因此,本文将介绍VLC-PUFA在动物体内消化与转运、代谢与生物合成等方面的过程,同时阐述VLC-PUFA在动物及人体内的生理功能。
1 VLC-PUFA的定义
脂肪酸按照双键的个数可分为饱和脂肪酸(Saturated Fatty Acid,SFA)、单不饱和脂肪酸(Monounsaturated Fatty Acid,MUFA)和多不饱和脂肪酸(Polyunsaturated Fatty Acid,PUFA)。PUFA指含有2个或2个以上双键的长链脂肪酸。按照第1个双键距甲基端的碳原子数,可将PUFA分为n-3、n-6、n-7和n-9系列,即n-编号系统(也称ω-编号系统)。其中n-3和n-6系列不能从头合成,属于必需脂肪酸。n-3系列脂肪酸主要有ALA、EPA和DHA;n-6 PUFA主要有LA、AA,其双键都是顺式构型。相关报道将VLC-PUFA的碳链长度定义为大于18碳、大于20碳、大于22或24碳[4],目前还没有统一的规定。本文中VLC-PUFA主要是指1种n-6 PUFA(AA)、2种n-3 PUFA(EPA和DHA),以及更长链PUFA(C24~C38),它们在动物体内具有重要的生物学功能。
2 动物体内VLC-PUFA吸收与转运
饲粮中大多脂肪酸都是以三酰甘油或磷脂形式被摄入动物体内,在胰脂肪酶的作用下,生产1,2-二酰甘油或2-单酰甘油。与哺乳动物相比,家禽的腺胃和肌胃可在酸性条件下水解少量脂肪,其余消化道上段几乎不水解脂肪。
饲粮中脂肪酸以甘油三酯的形式进入小肠,在胰脂肪酶的作用下,分解成游离的脂肪酸,由小肠黏膜细胞吸收,在细胞中通过脂肪酸结合蛋白的协助,游离脂肪酸被转运到滑面内质网中,重新合成甘油三酯,然后进入高尔基体与载脂蛋白A-I(Apo-I)作用形成乳糜微粒,并经载脂蛋白B48(Apo-B48)的加工,乳糜微粒发生糖基化,使其成熟。成熟的乳糜微粒分泌到淋巴液,通过胸导管进入全身血管,在脂蛋白酯酶(LPL)的作用下释放出游离脂肪酸,可将脂肪酸介导进入脂肪细胞、心肌细胞、肌肉细胞等脂肪酸结合蛋白(FABP)等相应的组织中[5]。由于家禽小肠淋巴系统不发达,成熟的乳糜微粒可以通过胞吐的方式进入血液循环系统[6],乳糜微粒被直接转运到门静脉系统,因此称为门静脉微粒。进入到组织中的脂肪酸代谢途径主要有β-氧化,作为生物膜的结构物质,或进一步延长、脱饱和,或酶氧化反应,或生成三酰甘油。家禽体内在载脂蛋白的作用下可组装成极低密度脂蛋白(VLDL),重新进入血液循环,以胞吞的形式进入发育的卵泡细胞或者运输到机体各部位中沉积,供于机体各组织[6]。
3 动物体内AA和EPA代谢和生物合成过程
脂肪酸代谢与合成是一个复杂的过程,在各种延长酶、去饱和酶的作用下,可使碳链延长及去饱和,同时在此过程中还可以生成一些存留时间短暂的激素类代谢产物,对机体起重要作用(图1)。脂氧合酶(LOX)和环氧合酶(COX)是AA、EPA代谢过程的2种关键酶,在LOX和COX的催化作用下,AA、EPA可转化为类花生酸衍生物,例如前列腺素(PGE)、白三烯(LT)、血栓素(TX)、环氧化合物、氧脂素等[7],可调节机体炎症反应和血小板聚集等免疫反应,还可以促进细胞生长、分化[8]。在COX的催化下,AA、EPA可分别生成前列腺素2(PGE2、PGI2等)、前列腺素3(PGE3、PGI3等)[8],在哺乳动物及家禽排卵、受精、胚泡植入、蜕膜化、子宫平滑肌收缩、黄体退化及卵泡发育过程中起重要作用[9];在LOX的作用下,AA、EPA可分别生成白三烯 4(LTA4、LTB4、LTC4、LTD4等)、白三 烯 5(LTA5、LTB5、LTC5、LTD5等)[8],LTA4可激活中性粒细胞产生趋化作用,增强血管通透性,促进血管平滑肌发生迁移,使动脉发生强有力的收缩,可有效地抵抗各种炎症的发生[10]。在AA合成过程中,中间产物二高-γ-亚麻酸(DGLA,C20:3 n-6,图1)可与AA、EPA发生竞争,与LOX和COX结合,同样可生成前列腺素1、TX等,具有抗炎症、血管舒张和抗血栓的作用[11]。除了类花生酸衍生物之外,EPA在代谢过程中还可以生成消散素E(E1、E2等);在抗炎症反应中起着重要作用,消散素E1可降低体内炎症的发生,阻止体内嗜中性粒细胞跨内皮迁移,消散素E2可减少酵母多糖引发的中性粒细胞浸润[12]。
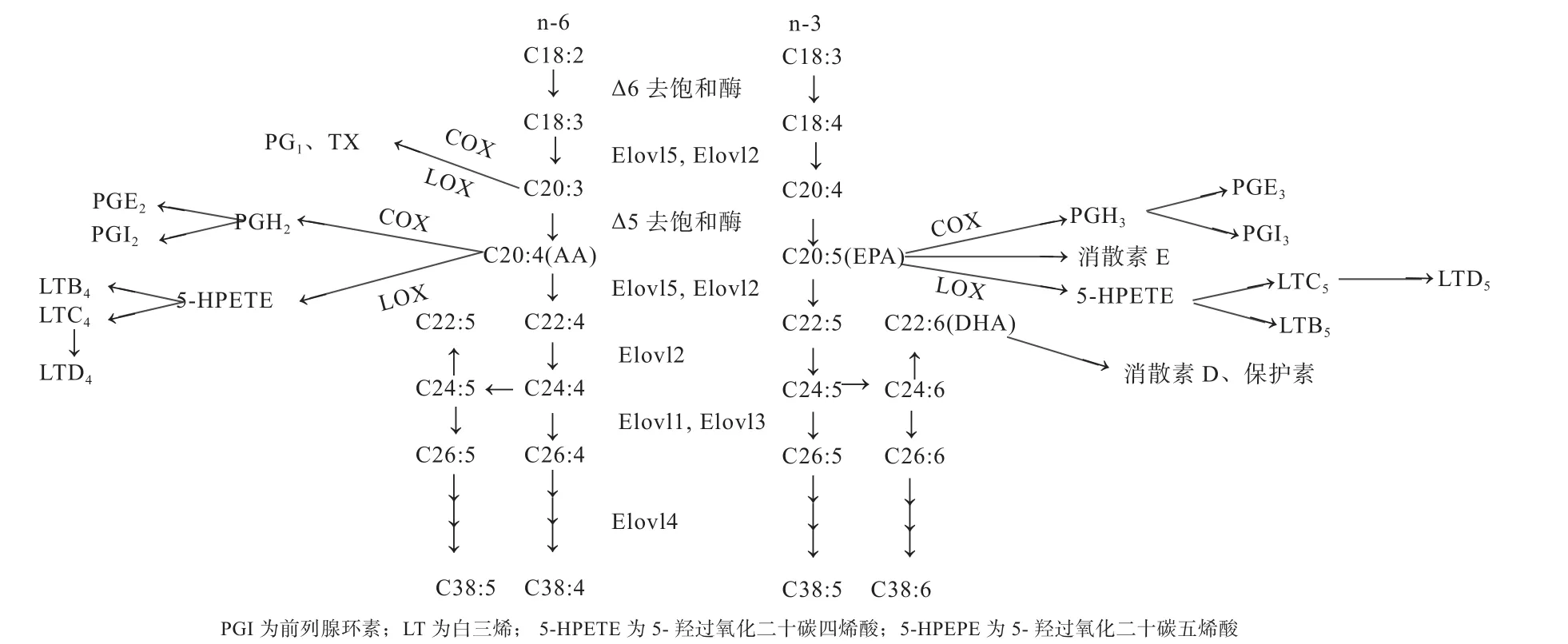
图1 动物体内VLC-PUFA合成与代谢过程[15]
PUFA可以发挥降低血压血脂、减少癌症发生机率等有益作用,其机制可能就是通过AA、EPA等PUFA的代谢产物实现的。n-3 PUFA可以与n-6 PUFA竞争相应的酶(COX或LOX)[13],当细胞内EPA含量升高时,AA的代谢产物也会受到抑制。临床试验表明,婴幼儿摄入过多EPA可抑制AA的吸收量,影响其生长发育;血小板少、凝血机制有问题、易出现出血现象的人群以及患自身免疫疾病的患者应慎用含EPA的产品[14]。
4 动物体内DHA代谢和生物合成过程
4.1 参与DHA生物合成关键酶 DHA的生物合成过程是在一系列前体脂肪酸(包括ALA和EPA等)的基础上,通过不断进行脂肪酸碳链延长和脂肪酸脱氢反应而获得。大量研究发现,在动物体内,与DHA生成相关性较大的脱饱和酶和延长酶分别有Δ-6去饱和酶和Elovl2延长酶[16]。
Elovl2延长酶是ELOVL(Elongation of Very Long Chain Fatty Acids)家族中的一种,可以延长碳链20~22碳和22~24碳,因此该延长酶可能参与调控动物体内的脂肪沉积[17]。在小鼠体内,Elovl2延长酶还能延伸18碳的不饱和脂肪酸,而在人体内Elovl2延长酶无此功能,这表明Elovl2基因在不同物种间存在一定的差异[16]。
Δ-6去饱和酶是一种膜结合脂肪酸脱饱和酶,它以NADH、细胞色素b5氧化还原酶和细胞色素b5作为电子供体,催化甘油脂中的脂肪酸脱氢;是动物脂肪酸生物合成的第一限速酶,与Δ-5脂肪酸去饱和酶相比,可催化18碳和24碳不饱和脂肪酸脱氢,在不饱和脂肪酸的C端第6个和第7个碳原子上特异性引入双键,形成更高的不饱和脂肪酸。这表明Δ-6去饱和酶具有催化Δ-6位脱氢反应的位置特异性。在Δ-6去饱和酶催化下,LA和ALA通过脱氢分别生成C18:3 n-6和C18:4 n-3,再通过其他去饱和酶和延长酶作用生成AA、EPA和DHA。
4.2 DHA代谢与生物合成过程 与EPA相似,在DHA代谢过程中,在LOX的作用下可以生成消散素D(D1~D4),在机体宿主防御及神经组织抗炎症方面起重要作用[12]。除此之外,DHA代谢过程中还有保护素的生成,DHA在LOX的作用下可生成含17S-氢氧化物的中间产物,此中间产物在白细胞中可快速转化为包含16(17)-环氧化物的产物,在特定酶的作用下,在白细胞中环氧被打开进一步转化为包含10,17-二羟基的分子,称为10,17-diHDHA,这些分子具有抗炎症的作用,因此称为保护素D1[18]。保护素D1可阻止体内T细胞的迁移,降低肿瘤坏死因子(TNF)和干扰素γ的分泌,还可以促进T细胞的凋亡[19]。
以前一直普遍认为,在Δ-4去饱和酶的作用下,动物体内C22:5 n-3和DHA可以由C22:4 n-3和C22:5 n-3转化而得到,直到1973年Ayala等[20]报道肝脏和睾丸微粒体中不能使C22:4 n-3去饱和,其本质归结于在动物体内缺乏Δ-4去饱和酶;随后,Sprecher[21]提出20碳链脂肪酸合成更长链的脂肪酸需要2个碳链连续延长步骤,1个Δ-6去饱和步骤,还有1个逆转化步骤(图1),因此称Sprecher途径。
在肝脏细胞和微粒体中研究发现,DHA合成不仅发生在线粒体中,也发生在过氧化酶体中,有氧化酶的参与(图2)。在动物细胞内质网,由ALA、EPA等前体合成的C22:5 n-3可以直接合成细胞膜磷脂,也可以通过进一步碳链延长合成DHA。DHA合成需经过生成C24:6 n-3过程,在过氧化酶体中C24:6 n-3主要发生部分氧化反应,未被氧化掉的部分生成DHA,而在线粒体中C24:6 n-3主要发生完全氧化反应,被降解掉不生成DHA[21]。
在动物体内,由ALA、EPA等前体合成DHA的效率极低[22],可能是与复杂的DHA合成步骤有关,需要过氧化酶体的参与。但是,在蛋鸡饲粮中添加富含EPA(无DHA)的微藻,结果发现蛋黄中DHA含量明显增加,但EPA几乎很少,这说明在蛋鸡肝脏、卵巢或某组织中EPA可高效率地转化为DHA[23]。因此,不同物种、组织中DHA的合成、氧化过程及合成效率存在一定的差异。
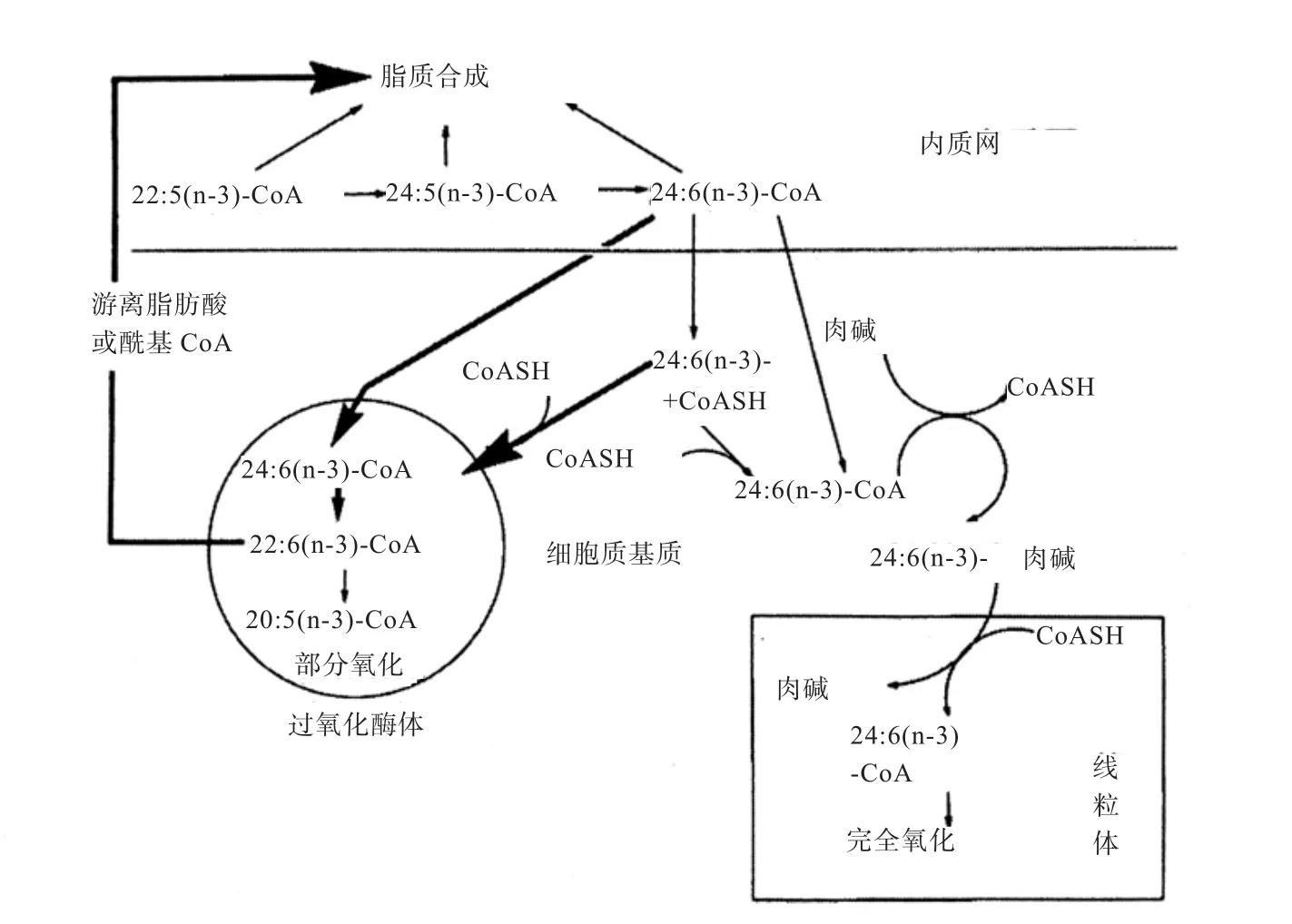
图2 动物组织细胞内DHA生物合成途径[21]
5 动物体内碳原子数大于24的VLC-PUFA生物合成和降解
5.1 碳原子数大于24的VLC-PUFA在动物体内分布及特性 碳原子数大于24的VLC-PUFA主要存在于动物大脑、视网膜、睾丸和精细胞等组织,以甘油糖脂、磷脂或由酰胺键连接的鞘脂、神经酰胺的形式[24]。在各个组织中,均由特定碳链长度的脂肪酸组成,表现出组织的特异性。在视网膜,尤其光感受体膜上,以甘油磷脂的形式存在,其sn-1位为C34:6 n-3,sn-2位为DHA。具有光传导功能的光感受器外节膜中含有丰富的VLCPUFA,其含量约为整个视网膜的2.5~3.0倍[25]。在睾丸和精细胞中,VLC-PUFA主要以鞘磷脂和神经酰胺的形式存在,并以C28:4 n-6和C30:5 n-6为主;大部分分布在精子的头部[26],这可能为精子运动提供了有利的条件。不同物种间VLC-PUFA类型存在一定的差异,在牛和羊睾丸中既有n-3又有n-6 VLC-PUFA的存在,而在人和猪睾丸中主要以n-6 VLC-PUFA存在[27],但在人睾丸中也有DHA的存在[28]。在人大脑中,VLC-PUFA主要以卵磷脂的形式存在,并以C34:4 n-6和C34:5 n-6为主。
5.2 碳原子数大于24的VLC-PUFA生物合成与降解 VLC-PUFA(大于24碳)的合成与PUFA(AA、EPA、DHA等)有所不同,VLC-PUFA(大于24碳)很少可以从饲粮中得到,主要依靠较短链PUFA(LA、ALA、AA、EPA等)的转化,在特定组织器官(大脑、视网膜、睾丸等)内质网中,延长酶复合体的作用下使碳链不断延长,每次可以延长2个碳单位(图3),形成 C24~C38 VLC-PUFA(图 1)。Rotstein等[29]利用同位素标记技术首次发现在牛科动物视网膜上可以合成VLC-PUFA(长达36碳),并证实了在视网膜上存在必要的场所和条件才能实现VLC-PUFA的转化。随后证实,Elovl4延长酶只能在视网膜、大脑、睾丸等特定组织中高效表达,其中在视网膜光感受器细胞表达量最高[30],在肝脏或其他组织中不能表达[31]。Elovl4延长酶可以参与n-3和n-6 VLC-PUFA的C28~C38延长的合成过程[32],在添加Elovl4基因的细胞中最主要的VLCPUFA产物是C32:5 n-3和C34:5 n-3[30]。Suh等[33]发现,尽管小鼠视网膜DHA含量很高,但合成的n-3 VLCPUFA主要还是由EPA转化而成。随着科学的进步,后来Yu等[15]在细胞水平上利用添加Elovl4基因的细胞模型与DHA和AA相比,证实了Elovl4延长酶可以优先选择EPA作为底物并将其延长成VLC-PUFA。
碳链每次延长都需要经过4步(图3):①Elovl延长酶参与的缩合反应,此步骤为整个过程的限速步骤;②β-酮脂酰-CoA还原酶和NAD(P)H参与的还原反应;③β-羟酰CoA脱水酶参与的脱水反应;④烯酰CoA还原酶参与的还原反应。转化得到的酰基CoA可能再经过一次或几次循环得到更长链的脂肪酸,也有可能释放到相应的细胞中被利用。VLC-PUFA还可以在过氧化酶体中通过β-氧化的方式被降解。在β-氧化降解之前,被活化的VLC-酰基CoA需要ATP结合转运蛋白(ABCD1)转运到过氧化酶体[34],β-氧化与合成互为逆过程,但需要的酶不同,每次β-氧化也都需要4步(图3):①酰基CoA氧化酶催化的氧化反应;②烯酰CoA水合酶参与的水合反应;③3-羟烷基CoA氧化酶参与的氧化反应;④3-酮脂酰CoA硫解酶作用的硫解反应。β-氧化后的产物可能会经历下一个β-氧化循环,或通过其他酶的作用转化为其他物质[35]。
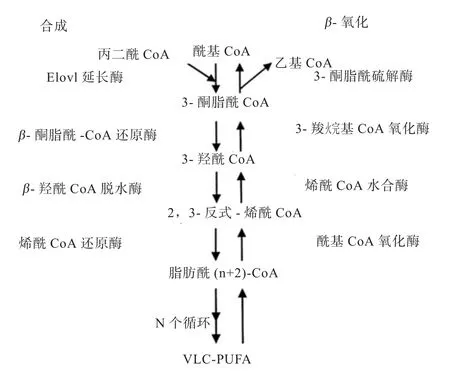
图3 动物体内VLC-PUFA生物合成和β氧化过程[34]
5.3 碳原子数大于24的VLC-PUFA生理功能 早在20世纪80年代VLC-PUFA已经被发现,但由于其结构不稳定和组织中低表达等原因,至今VLC-PUFA在这些特定组织中的具体功能还尚不明确。在哺乳动物睾丸生殖细胞的鞘磷脂和糖基化的神经节苷脂中发现有VLCPUFA的存在,其主要在精子发生和精子获能过程中发挥作用,含有VLC-PUFA的神经髓鞘首先出现在精母细胞减数第1次分裂前期的粗线期,精子成熟后,这些富含VLC-PUFA的神经鞘磷脂主要集中在精子头部,可以维护精子细胞膜的完整性[34]。另外,Furland等[36]发现,在正处于精子发生过程旺盛的成年小鼠睾丸神经酰胺和鞘磷脂中的VLC-PUFA含量不断增加,而老年小鼠相应组织中的VLC-PUFA含量不断降低。另外,利用不同的试验方法诱导处于精子发生过程的生殖细胞死亡,均发现在生殖细胞神经酰胺和鞘磷脂中VLCPUFA含量有一定程度的降低。这表明精子发生和精子成熟的进程与VLC-PUFA含量有密切的联系。
VLC-PUFA可以维持动物视网膜的正常结构和功能。与PUFA相比,VLC-PUFA可形成以特殊的磷脂双分子层,这有利于视杆细胞和视锥细胞的自我折叠弯曲,进而维持弯曲的视网膜结构的稳定[24]。3型Stargardt病(STGD3)是一种常染色体显性遗传的早发性黄斑营养不良性疾病,其主要由于Elovl4基因突变导致在视网膜细胞不能正常合成VLC-PUFA,目前仍无很好的治疗方法[37]。Kuny等[38]通过记录视网膜电流图、基底图像及分析脂肪酸等方法,利用敲除Elovl4基因的小鼠(Elovl4/TG1-2)建造了STGD3模型,发现2月龄时小鼠视网膜光感受器视杆细胞开始消退(18月龄完全消失),视锥细胞直到15月龄才开始退化。与野生型小鼠相比,尽管视网膜中VLC-PUFA含量有所降低,但VLC-PUFA还可以少量的合成,且在6~9月龄达到最高峰。这些研究结果表明,尽管VLC-PUFA对视网膜的生理功能起着重要作用,但STG3患者的视网膜光感受器细胞退化可能存在其他的机理,有待于深层次的研究。
在动物大脑中VLC-PUFA的具体功能作用机理也尚未明确报道,可能与高度灵敏的神经元有关,保证了其传导的速度。同样发现脑鞘磷脂VLC-PUFA含量随着生长阶段的不同而变化,整个生长阶段表现出先高后低的趋势[24],动物幼龄时期时最高,C34:4n-6和C34:5n-6含量最高,而到机体生长后期,VLCPUFA含量降低,并且C36:4n-6成为含量最高的VLCPUFA。这表明,人及动物随着机体的生长导致大脑生理功能的变化可能与VLC-PUFA组成及含量的变化有一定的关系。
6 小结与展望
在动物机体,脂肪酸(尤其VLC-PUFA)代谢与生物合成是一个复杂的过程,同时还可以生成一些存留时间短暂的激素类代谢产物,对机体起重要的调节作用。此外,主要存在于大脑、视网膜等组织的VLC-PUFA(大于24碳)在特定组织中发挥着重要的生物学作用,但其具体功能与作用机制尚不明确,有待于深入研究。
VLC-PUFA在人体健康状况中起着广泛的有益作用。目前,通过科学技术手段生产富含VLC-PUFA畜禽产品已成为世界各国畜牧行业的重要课题。提高畜禽产品中VLC-PUFA含量已成为研究者的热点;富含EPA、DHA等n-3 PUFA的微藻、鱼油、亚麻籽已成为富集高营养价值畜禽产品(肉蛋奶)的主要原料来源。近年来在此方面的研究中取得了很大进展,主要集中在AA、EPA和DHA上,但更长链的VLC-PUFA的富集研究还没有得到实质性的进展,因此,有待于寻求并开发富含更长链的PUFA功能原料(如海洋微藻、深海鱼油),利用其生产富集更长链PUFA的畜禽产品,证明其在养殖中的有效性、安全性及研究对畜禽产品中富集效果的影响。
[1] 陈殊贤, 郑晓辉. 微藻油和鱼油中DHA的特性及应用研究进展[J]. 食品科学, 2013(21): 439-444.
[2] Lorente-Cebrián S, Costa A G V, Navas-Carretero S,et al. Role of omega-3 fatty acids in obesity, metabolic syndrome, and cardiovascular diseases: a review of the evidence[J]. J Physiol Biochem, 2013, 69(3): 633-651.
[3] 刘则学. 亚麻籽中多不饱和脂肪酸在猪不同组织中的富集规律及对猪胴体品质的影响[D]. 武汉: 华中农业大学, 2006:11-14.
[4] 胡晓君, 张正斌, 刘文, 等. 植物表皮蜡质及极长链脂肪酸类物质的研究进展[J]. 安徽农业科学, 2013, 41(12): 5176-5178.
[5] Dutta-Roy A K. Fatty acid transport and metabolism in the fetoplacental unit and the role of fatty acid-binding proteins[J]. J Nutr Biochem, 1997, 8(10): 548-557.
[6] 陈伟, 林映才, 张罕星, 等. 家禽脂肪酸代谢及其在禽蛋中的沉积和营养调控[J]. 动物营养学报, 2012, 24(2): 204-211.
[7] O’Donnell V B, Maskrey B, Taylor G W. Eicosanoids: generation and detection in mammalian cells[J]. Methods Mol Biol, 2009,462: 5-23.
[8] Larsson S C, Kumlin M, Ingelman-Sundberg M,et al. Dietary long-chain n-3 fatty acids for the prevention of cancer: a review of potential mechanisms[J]. Am J Clin Nutr, 2004, 79(6): 935-945.
[9] 金艳梅. 前列腺素对禽类等级卵泡发育的影响[J]. 中国畜牧兽医, 2010(4): 138-142.
[10] 曾玉蓉, 谢青, 邓海波, 等. 白三烯与生物机体衰老[J]. 南昌大学学报: 医学版, 2015, 55(1): 80-83.
[11] Kapoor R, Huang Y. Gamma linolenic acid: an anti-inflammatory omega-6 fatty acid[J]. Curr Pharm Biotechnol, 2006, 7(6): 531-534.
[12] Serhan C N, Chiang N, Van Dyke T E. Resolving inflammation:dual anti-inflammatory and pro-resolution lipid mediators[J].Nat Rev Immunol, 2008, 8(5): 349-361.
[13] 王庆玲, 靳国锋, 刘纯友, 等. 禽蛋中多不饱和脂肪酸研究进展[J]. 中国家禽, 2013, 35(21): 44-48.
[14] 温雪馨, 李建平, 侯文伟, 等. 微藻DHA的营养保健功能及在食品工业中的应用[J]. 食品科学, 2010(21): 446-450.
[15] Yu M, Benham A, Logan S,et al. ELOVL4 protein preferentially elongates 20:5 n3 to very long chain PUFAs over 20:4 n6 and 22:6 n3[J]. J Lipid Res, 2012, 53(3): 494-504.
[16] 孙晓艳, 林艳丽, 熊福银, 等. 二十碳五烯酸和二十二碳六烯酸的生物合成途径研究进展[J]. 生物技术通讯, 2012,23(5): 755-758.
[17] Leonard A E, Kelder B, Bobik E G,et al. Identification and expression of mammalian long-chain PUFA elongation enzymes[J]. Lipids, 2002, 37(8): 733-740.
[18] Hong S, Gronert K, Devchand P R,et al. Novel docosatrienes and 17S-resolvins generated from docosahexaenoic acid in murine brain, human blood, and glial cells autacoids in antiinflammation[J]. J Biol Chem, 2003, 278(17): 14677-14687.
[19] Ariel A, Li P, Wang W,et al. The docosatriene protectin D1 is produced by TH2 skewing and promotes human T cell apoptosis via lipid raft clustering[J]. J Biol Chem, 2005,280(52): 43079-43086.
[20] Ayala S, Gaspar G, Brenner R R,et al. Fate of linoleic,arachidonic, and docosa-7,10,13,16-tetraenoic acids in rat testicles[J]. J Lipid Res, 1973, 14(3): 296-305.
[21] Sppercher H. Metabolism of highly unsaturated n-3 and n-6 fatty acids[J]. Biochim Biophys Acta, 2000, 1486(2): 219-231.
[22] Burdge G C, Calder P C. Conversion of alpha-linolenic acid to longer-chain polyunsaturated fatty acids in human adults[J].Reprod Nutr Dev, 2005, 45(5): 581-597.
[23] 吴永保, 杨凌云, 闫海洁, 等. 饲粮中添加微藻和亚麻籽提高鸡蛋黄中ω-3多不饱和脂肪酸含量对比研究[J]. 动物营养学报, 2015, 27(10): 3188-3197.
[24] Agbaga M, Mandal M N A, Anderson R E. Retinal very long-chain PUFAs: new insights from studies on ELOVL4 protein[J]. J Lipid Res, 2010, 51(7): 1624-1642.
[25] Poulos A. Very long chain fatty acids in higher animals-a review[J]. Lipids, 1995, 30(1): 1-14.
[26] Furland N E, Zanetti S R, Oresti G M,et al. Ceramides and sphingomyelins with high proportions of very long-chain polyunsaturated fatty acids in mammalian germ cells[J]. J Biol Chem, 2007, 282(25): 18141-18150.
[27] Poulos A, Sharp P, Johnson D,et al. The occurrence of polyenoic fatty acids with greater than 22 carbon atoms in mammalian spermatozoa[J]. Biochem J, 1986, 240(3): 891-895.
[28] Martinez Soto J C, Landeras J, Gadea J. Spermatozoa and seminal plasma fatty acids as predictors of cryopreservation success[J]. Andrology, 2013, 1(3): 365-375.
[29] Rotstein N P, Aveldano M I. Synthesis of very long chain (up to 36 carbon) tetra, penta and hexaenoic fatty acids in retina[J].Biochem J, 1988, 249(1): 191-200.
[30] Agbaga M, Brush R S, Mandal M N A,et al. Role of Stargardt-3 macular dystrophy protein (ELOVL4) in the biosynthesis of very long chain fatty acids[J]. Proc Natl Acad Sci, 2008,105(35): 12843-12848.
[31] Zadravec D, Tvrdik P, Guillou H,et al. ELOVL2 controls the level of n-6 28:5 and 30:5 fatty acids in testis, a prerequisite for male fertility and sperm maturation in mice[J]. J Lipid Res,2011, 52(2): 245-255.
[32] 余曼, 林伟, 陈波, 等. ELOVL4基因过表达对n3和n6超长链多不饱和脂肪酸生物合成效率的影响[J]. 国际眼科杂志,2014(8): 1386-1390.
[33] Suh M, Wierzbicki A A, Lien E L,et al. Dietary 20:4 n-6 and 22:6 n-3 modulates the profile of long-and very-long-chain fatty acids, rhodopsin content, and kinetics in developing photoreceptor cells[J]. Pediatr Res, 2000, 48(4): 524-530.
[34] Kihara A. Very long-chain fatty acids: elongation, physiology and related disorders[J]. J Biochem, 2012, 152(5): 387-395.
[35] Van Veldhoven P P. Biochemistry and genetics of inherited disorders of peroxisomal fatty acid metabolism[J]. J Lipid Res,2010, 51(10): 2863-2895.
[36] Furland N E, Zanetti S R, Oresti G M,et al. Ceramides and sphingomyelins with high proportions of very long-chain polyunsaturated fatty acids in mammalian germ cells[J]. J Biol Chem, 2007, 282(25): 18141-18150.
[37] 陆勤康, 吴佩蓓, 赵娜, 等. 3型Stargardt病及其致病基因ELOVL4的研究进展[J]. 中国眼耳鼻喉科杂志, 2015(6):441-444.
[38] Kuny S, Filion M, Suh M,et al. Long-Term retinal cone survival and delayed alteration of the cone mosaic in a transgenic mouse model of Stargardt-like dystrophy(STGD3) cone degeneration in STGD3 mouse[J]. Invest Ophthalmol Vis Sci, 2014, 55(1):424-439.
