沙棘叶绿体对葡萄酒中亚硫酸盐清除条件的 筛选及感官品质的影响
2018-03-02宋金秀韩舜愈李霁昕盛文军
李 敏,宋金秀,毕 阳,*,韩舜愈,李霁昕,盛文军
(1.甘肃农业大学食品科学与工程学院,甘肃兰州 730070;2.甘肃省葡萄与葡萄酒工程学重点实验室,甘肃兰州 730070)
SO2是葡萄酒生产中的重要添加剂,兼具杀菌与抗氧化等多种作用。然而葡萄酒中的亚硫酸盐会引发部分消费者哮喘和支气管痉挛[1],还会危害硫不耐症及高敏人群的健康。此外,酒中的硫化物也会在瓶储和陈酿过程中转化为H2S和硫醇,从而破坏葡萄酒的口感和香气[2]。因此,有效降低亚硫酸盐残留一直是葡萄酒安全领域的研究热点。
沙棘(HippophaerhamnoidesL.)为胡颓子科酸刺属,灌木或小乔木,别名酸刺、黑刺[3]。我国是世界最大的沙棘种植国,面积达140万hm2,约占世界总面积的95%[4]。沙棘在改良土壤、防止水土流失方面发挥了积极的生态作用[5-6]。浆果是沙棘可被加工利用的主要部分[7-9],大量沙棘枝叶尚未进行有效开发。因此,充分挖掘沙棘枝叶的功能是沙棘产业发展中亟待解决的问题。植物叶绿体具有氧化亚硫酸盐的功能[10],其氧化能力与叶绿体提取方法[11],以及反应溶液的pH、温度、时间、光照、氧气等有关[12-13],氧气[14]、光照[15-16]及叶绿体内的自由基[17-18]共同参与了该反应过程。叶绿体也可氧化葡萄酒中的亚硫酸盐,Lin等[19]采用小麦叶绿体脱除了干红葡萄酒中93%的亚硫酸盐。黄国平等[20]采用菠菜叶绿体脱除了干白葡萄酒中99%的亚硫酸盐。pH、反应温度和叶绿体浓度等因素对脱除效果具有较大影响。沙棘叶片具有面积小、含水量低、叶绿体含量高、光饱和点高、光合效率高等优点[21]。作为药食两用资源,沙棘叶的应用目前仅局限于茶剂,其叶绿体对葡萄酒中亚硫酸盐的清除研究还未见报道。
本研究在前期实验基础上,从小麦草、葡萄叶和沙棘叶三种植物中选取对葡萄酒感官品质影响最小的沙棘叶,通过高速冷冻离心提取叶绿体,研究沙棘叶绿体浓度、反应时间、反应温度、pH、乙醇浓度、光照等因素对模拟酒中亚硫酸盐清除率的影响,通过响应面法优化清除条件,并通过比较沙棘叶绿体在干型、甜型、红色、白色不同葡萄酒中的亚硫酸盐清除率及其对感官品质的影响,评估葡萄酒被饮用前利用沙棘叶绿体清除其中亚硫酸盐的应用潜力,以期为葡萄酒中亚硫酸盐的脱除提供方法及理论依据。
1 材料与方法
1.1 材料与仪器
中国沙棘(Hippophaerhamnoidesssp. sinensis) 成熟叶片于2016年7月采自甘肃省农科院兰州秦王川沙棘实验田,选择大小、色泽基本一致,无机械伤和病虫伤的叶片,瓦楞箱包装,当天运至实验室;葡萄酒 赤霞珠干红、霞多丽干白、美乐冰红、白比诺冰白均由甘肃莫高实业发展股份有限公司提供;碘标准液[c(1/2 I2=0.02 mol/L)]、淀粉指示剂(10 g/L)、氢氧化钠、磷酸氢二钾、磷酸二氢钾、硫酸、无水乙醇、酒石酸、苹果酸、乙酸、葡萄糖、果糖、氯化钠、(NH4)2SO4、K2HPO4、MgSO4·7H2O、MnSO4·H2O、K2S2O5均为国产分析纯。
10 S紫外-可见分光光度计 美国Thermo公司;160350 D乙醇测定仪 法国Dujardin Salleron公司;SL-1001电子天平 上海民桥公司;1810 D超纯水机 重庆摩尔公司;移液器 德国Eppendorf公司;SPX-150-II生化培养箱 上海跃进公司;JJ-2高速组织破碎机 上海南荣公司;H2050 R台式高速冷冻离心机 长沙湘仪公司;NRY-200空气恒温摇床 上海南荣公司;GZX-GF101-II 电热恒温鼓风干燥箱 上海跃进公司。
1.2 实验方法
1.2.1 叶绿体的提取 参考Lin等[19]的方法略做修改。叶片用去离子水清洗,高速组织破碎机破碎匀浆,三层纱布过滤除去粗纤维,所得滤液于4 ℃ 10000 r/min离心10 min,收集含叶绿体的沉淀,用去离子水配制成所需浓度。
1.2.2 模拟酒配制 参考Rowe等[22]的方法。称取酒石酸5.00 g,苹果酸2.50 g,乙酸0.20 g,葡萄糖2.00 g,果糖2.00 g,NaCl 0.20 g,(NH4)2SO41.00 g,K2HPO42.00 g,MgSO4·7H2O 0.20 g,MnSO4·H2O 0.05 g溶于1000 mL水中,用无水乙醇调整乙醇浓度为12%,用1 mol/L NaOH调整pH为3.4,4 ℃避光储存待用。
1.2.3 SO2溶液配制与测定 参考李华[23]的方法。称取122 mg K2S2O5溶于 1000 mL去离子水中,获得60 mg/L SO2溶液,避光密封待用。参考国标GB/T 15038-2006[24]采用直接碘量法测定总SO2,待测样中总SO2=碘标准溶液浓度mol/L×(样品消耗的碘标准溶液体积mL-空白实验消耗的碘标准溶液体积mL)×32 g/mol×1000/25 mL。亚硫酸盐清除率(%)=(未处理前样品总SO2-处理后样品总SO2)/未处理前样品总SO2×100。
1.2.4 叶绿体对模拟酒中亚硫酸盐清除的单因素筛选 在酒精浓度12%、pH3.4的模拟酒中,固定反应时间5 h,反应温度25 ℃,自然光照条件下,考察不同叶绿体浓度(11、13、15、17、19、21 mg/mL)对亚硫酸盐清除率的影响;固定叶绿体浓度11 mg/mL,反应温度25 ℃,自然光照,考察不同反应时间(1、2、3、4、5、6、7 h)对亚硫酸盐清除率的影响;固定叶绿体浓度11 mg/mL,反应时间5 h,自然光照,考察不同反应温度(5、10、15、20、25 ℃)对亚硫酸盐清除率的影响;为尽量避免叶绿体对葡萄酒感官品质的不利影响,在预实验基础上并结合Lin S C方法[19],固定叶绿体浓度11 mg/mL,反应时间5 h,反应温度25 ℃,考察乙醇浓度(5%、10%、15%、20%、25%)、pH(3、4、5、6、7、8)、光照(自然光照、避光)对亚硫酸盐清除率的影响。
1.2.5 叶绿体对模拟酒中亚硫酸盐清除的响应面实验设计 采用Design-Expert 软件进行响应面中心组合设计(CCD),在单因素实验基础上选取叶绿体浓度11 mg/mL、反应时间5 h、自然光照条件,以温度X1,pH X2,乙醇浓度X3为自变量,亚硫酸盐清除率为响应值,进行三因素三水平实验设计。因素水平和编码如表1所示。
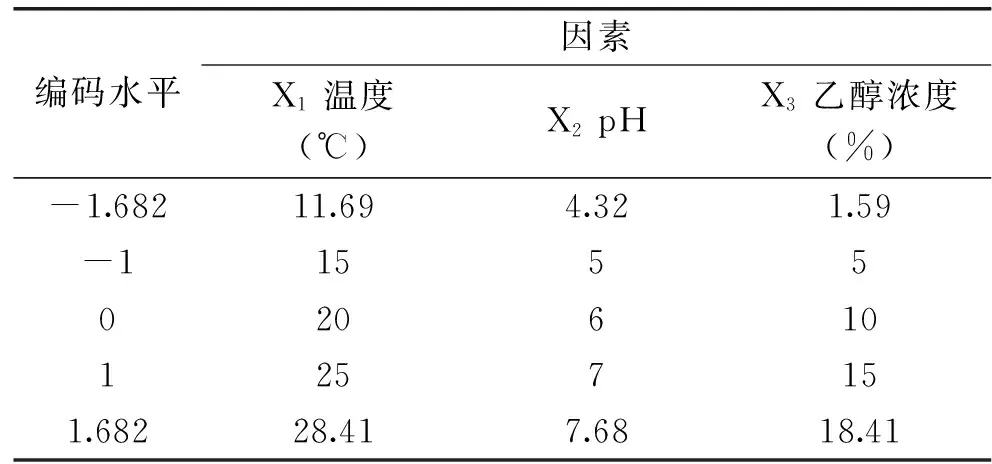
表1 响应面实验设计因素水平和编码Table 1 Level and code of independent variable used for response surface analysis
1.2.6 沙棘叶绿体清除4种葡萄酒中的亚硫酸盐实验 参考国标GB/T 15038-2006[24],测定4种葡萄酒中的总二氧化硫含量并以此为对照,分别测定4种葡萄酒经响应面实验优化参数处理后的亚硫酸盐的含量。
1.2.7 沙棘叶绿体对4种葡萄酒感官品质的影响
1.2.7.1 感官分析 品尝小组由20名经过葡萄酒品尝训练的葡萄酒专业师生组成,年龄21~40岁。参考国标GB 15037-2006[26]中不同类型葡萄酒的感官要求,从色泽(20分)、澄清度(20分)、香气(20分)、滋味(20分)、典型性(20分)对样品打分。
参考李华[25]的方法进行三角品尝。采用X2分布进行差异分析。X2>3.85即为差异显著。
1.2.7.2 色度与色调测定 参考李华等[25]的方法。分别测定酒样在420、440和520 nm处的吸光度值,色调红/白=OD420 nm/OD520 nm,色度红酒=OD420 nm+OD520 nm,色度白酒=OD440 nm。
1.3 数据分析
所有实验均重复3次。采用Design-Expert V.8.05进行响应面实验设计与数据分析,全部数据采用Excel 2010计算平均值与标准偏差,采用SPSS 22.0进行差异显著性分析。
2 结果与分析
2.1 单因素实验
2.1.1 叶绿体浓度对模拟酒中亚硫酸盐清除率的影响 沙棘叶绿体具备良好的亚硫酸盐清除能力,当浓度为11 mg/mL时,就可清除41.67%的亚硫酸盐,随着浓度的增加清除率显著升高,当浓度为17 mg/mL时达到最大,与初始的11 mg/mL相比,清除率提高了45.00%。随着浓度的进一步增加,清除率并没有显著升高(图1)。表明17 mg/mL已到达叶绿体氧化反应的饱和浓度,此时氧化能力达到最大,该结果与前人报道基本一致[11,19]。考虑到高浓度叶绿体添加会对葡萄酒的色泽产生较大影响,故选取11 mg/mL进行后续实验。
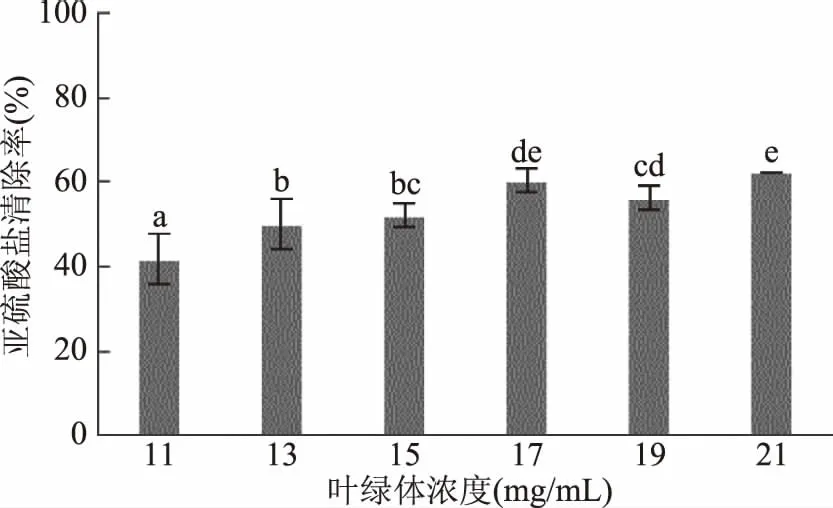
图1 叶绿体浓度对模拟酒中亚硫酸盐清除率的影响Fig.1 Effect of the chloroplast concentration on clearance rate of sulfite in model wine注:不同字母代表差异显著(p<0.05);图2~图6同。
2.1.2 反应时间对模拟酒中亚硫酸盐清除率的影响 随着反应时间的增加清除率显著升高,1 h即可清除41.67%的亚硫酸盐,5 h时清除率达到最大,与初始的1 h相比,清除率提高了25.00%。随着时间的进一步增加,清除率并未显著升高(图2)。这表明叶绿体对亚硫酸盐的生物氧化是个缓慢的过程。值得注意的是1 h处理时沙棘叶绿体也已具有较高的清除率。
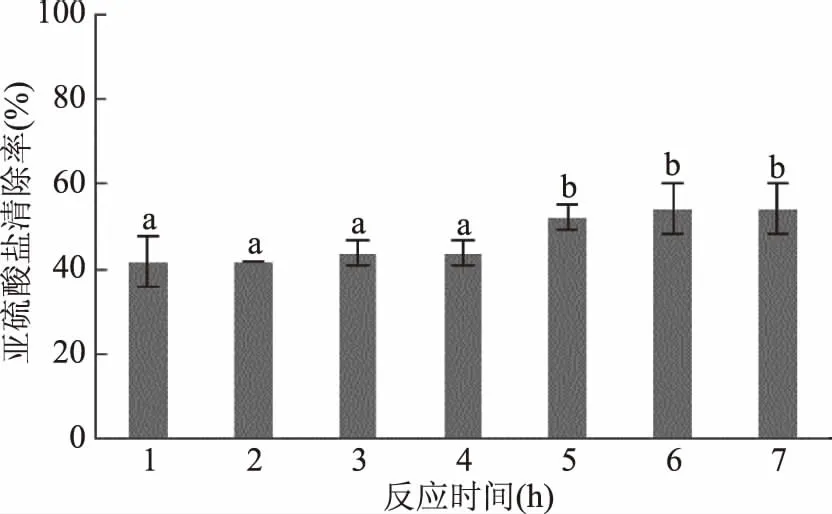
图2 反应时间对模拟酒中亚硫酸盐清除率的影响 Fig.2 Effect of the reaction time on clearance rate of sulfite in model wine
2.1.3 反应温度对模拟酒中亚硫酸盐清除率的影响 反应温度的升高也会抑制叶绿体对亚硫酸盐的清除作用,当温度为5 ℃时,清除率可达到最高值43.75%,随着反应温度的增加清除率显著降低,当温度为10 ℃时清除率降至最低,比5 ℃时降低了19.05%,随着温度的进一步升高清除率略有增加,并从15 ℃起不再发生显著变化(图3)。低温会引起叶绿体膨胀,类囊体腔膨大,基粒片层消失,被膜破坏[30],叶绿体内活性氧代谢失衡,因此5 ℃累积的大量活性氧有利于亚硫酸盐的清除[31]。但考虑到葡萄酒在低温下易产生酒石沉淀,同时也不利于香气物质释放,因此选择20 ℃进行后续实验。
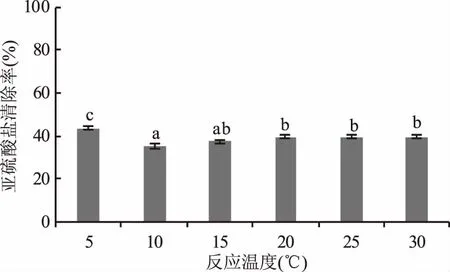
图3 反应温度对模拟酒中亚硫酸盐清除率的影响Fig.3 Effect of the reaction temperature on clearance rate of sulfite in model wine
2.1.4 乙醇浓度对模拟酒中亚硫酸盐清除率的影响 乙醇会抑制叶绿体对亚硫酸盐的清除作用,当浓度为5%时,清除率可达到56.25%,随着浓度的增加清除率显著降低,当浓度为25%时降至最低,与初始的5%相比,清除率降低了14.82%(图4)。表明乙醇破坏了叶绿体类囊体膜结构[27],促进了叶绿体中的离子泄漏[28],使叶绿体的氧化能力降低,该结果与前人报道基本一致[20]。因此,叶绿体对低醇葡萄酒(酒精度1%~7%)中亚硫酸盐的清除效果要高于利口葡萄酒(酒精度15%~22%)。
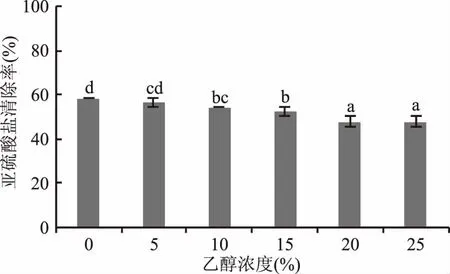
图4 乙醇浓度对模拟酒中亚硫酸盐清除率的影响Fig.4 Effect of the alcohol concentration on clearance rate of sulfite in model wine
2.1.5 pH对模拟酒中亚硫酸盐清除率的影响 pH对清除率的影响表现为先上升后下降,当pH<6时,清除率随pH增加而逐渐升高,当pH为6时达到峰值77.08%,与初始pH3相比,清除率提高了27.58%。随着pH继续增加清除率逐渐降低,pH为8时的清除率与pH3时相同(图5)。说明叶绿体在其正常pH范围时的氧化能力最强[29],该结果与前人研究结果[16]相同。而在葡萄酒的pH范围3.2~4.0内,尽管清除率并未达到峰值,但也已高于60%。
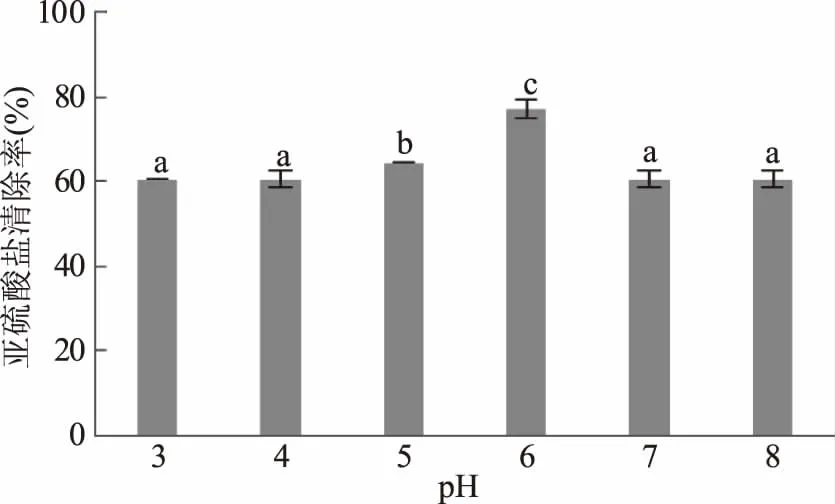
图5 pH对模拟酒中亚硫酸盐清除率的影响Fig.5 Effect of the pH on clearance rate of sulfite in model wine
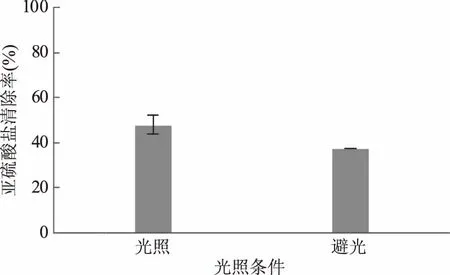
图6 光照条件对模拟酒中亚硫酸盐清除率的影响Fig.6 Effect of the light condition on clearance rate of sulfite in model wine
与小麦叶绿体[19]相比,沙棘叶绿体表现出在低浓度、低温、酸性、低醇及普通葡萄酒酒精度(7%~15%)条件下快速降低亚硫酸盐的能力。通过单因素实验表明反应温度、pH、乙醇浓度对亚硫酸盐清除率有较大影响,同时考虑到应添加尽量少的植物叶绿体以降低其对葡萄酒感官品质的影响,因此选择叶绿体浓度11 mg/mL、反应时间5 h、光照条件下进行响应面实验。
2.2 响应面实验
2.2.1 响应面实验设计方案及结果 响应面中心组合设计(CCD)实验方案及实验结果见表2。
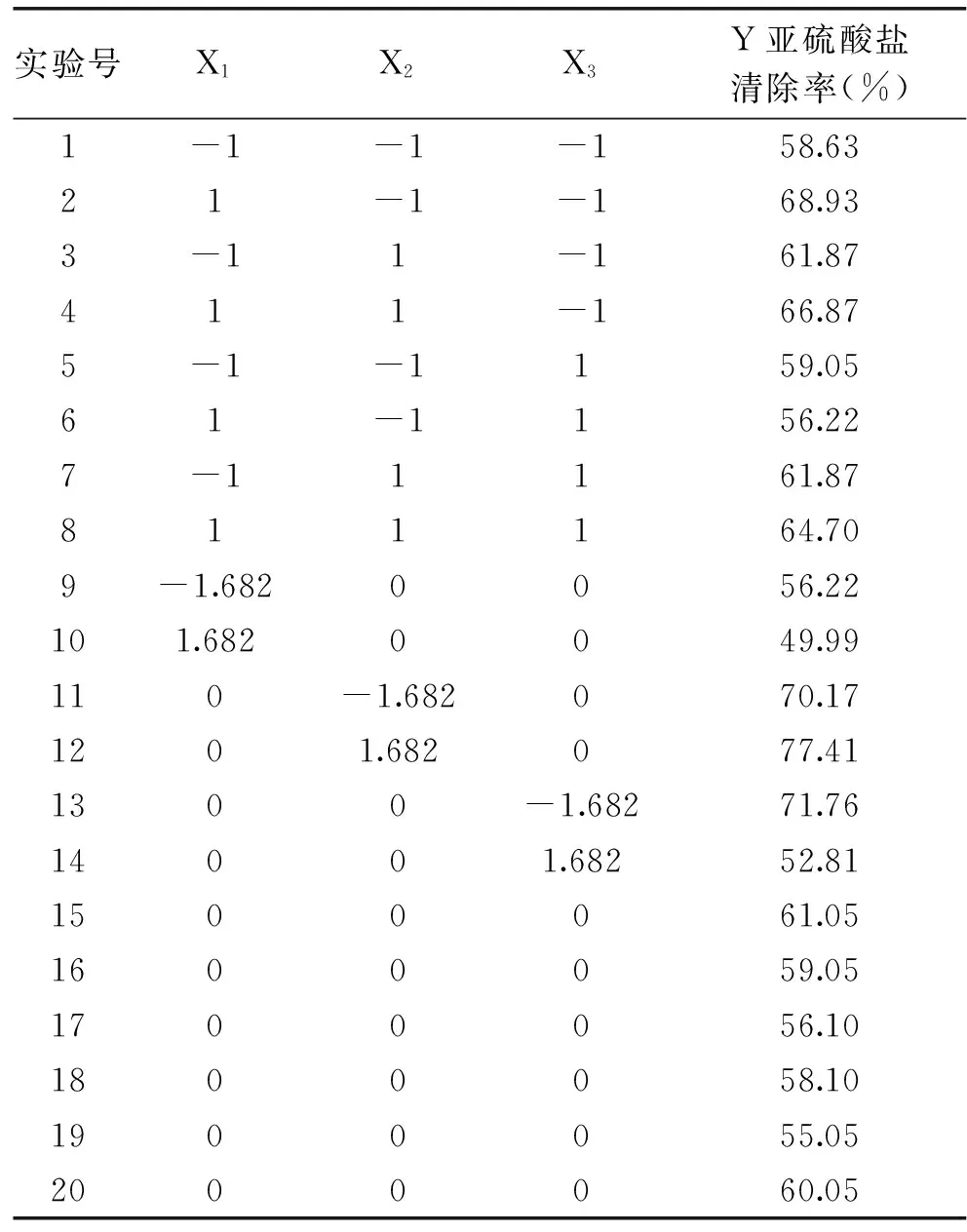
表2 响应面实验设计及亚硫酸盐清除率Table 2 RSM design and the sulfite clearance rate
2.2.2 回归方程拟合及方差分析 回归分析结果见表3,反应温度(X1),pH(X2),乙醇浓度(X3)三因素经回归拟合后得到沙棘叶绿体对模拟酒中亚硫酸盐清除率的二次回归方程:
Y=58.28+0.38X1+1.81X2-3.39X3+0.045X1X2-1.91X1X3+1.27X2X3-2.08X12+5.27X22+1.21X32
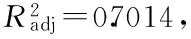
表3 回归模型及方差分析结果Table 3 Regression model analysis of mean square deviation for experiment data
注:p<0.01表示该指标极显著。
2.2.3 响应面图交互作用分析 图7为当固定反应温度、pH、乙醇含量中任意一个因素为零水平时,其余两个因素的交互作用对亚硫酸盐清除率的影响。当pH相同时,反应温度对清除率的影响表现为先上升后下降,15 ℃时清除率最低,随着温度的升高清除率逐渐增加,于20 ℃左右达到最高清除率,随后清除率再次降低;当反应温度相同时,pH对清除率的影响表现为先下降后上升,pH7时的清除率最高,随着酸度的增加清除率逐渐降低,当pH约为5.8时清除率降至最低,之后随着酸度的增加清除率再次缓慢升高(图7A)。随着乙醇含量的升高清除率迅速下降,温度越高这种变化越明显(图7B)。当pH相同时,清除率随酒精度的增加而降低,酸度越高这种变化越明显;当酒精度相同时,pH对清除率的影响表现为先下降后上升,但随着酒精度的增加,清除率随着pH的降低而降低(图7C)。与方差分析结果相符。
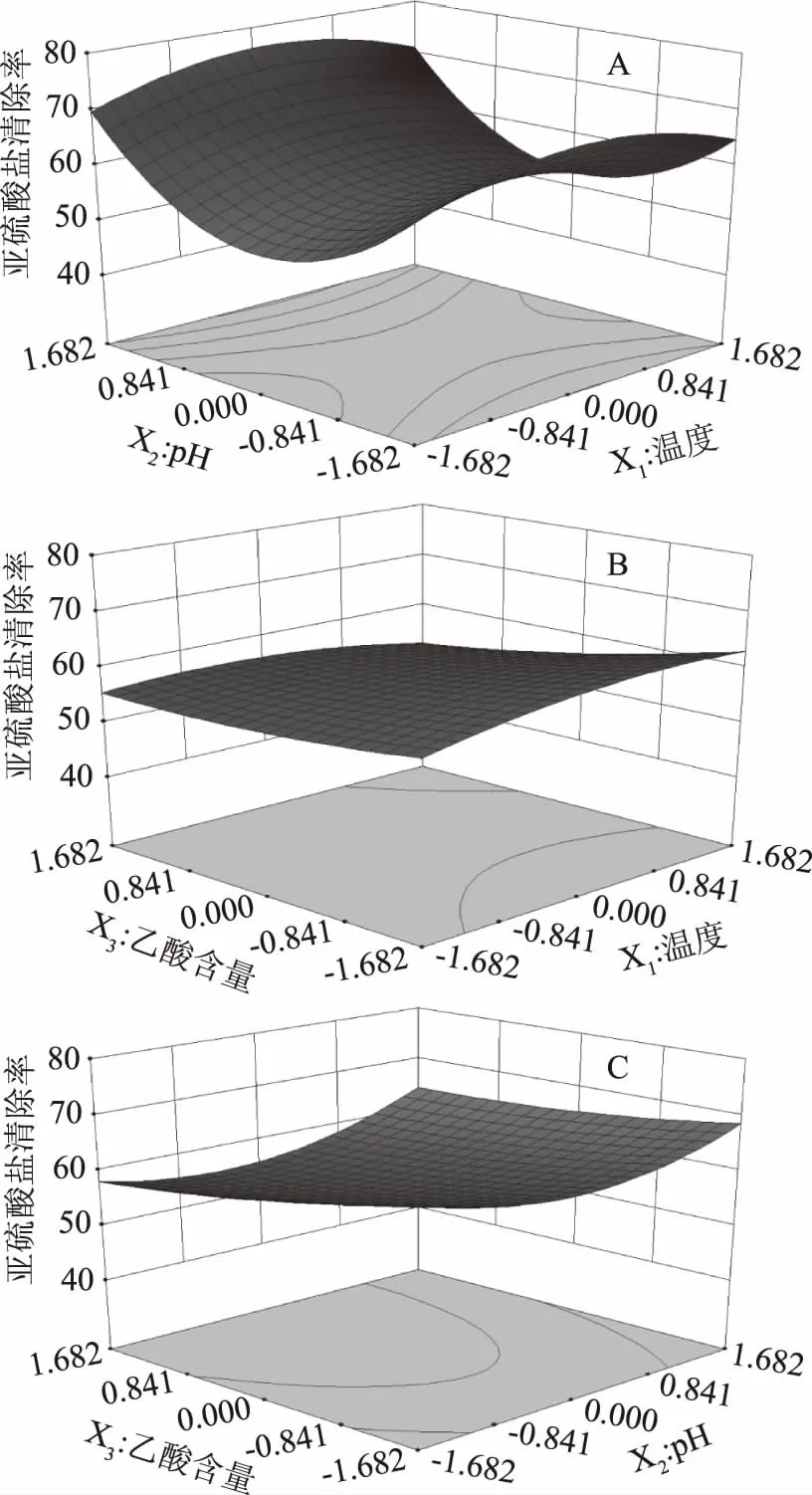
图7 两因素的交互作用对亚硫酸盐清除率的影响Fig.7 Response surface plots of variable parameters on the sulfite clearance rate
2.2.4 验证实验 对回归方程求解即获得亚硫酸盐清除率达到最大时的反应条件。当温度24.65 ℃,pH5.00,乙醇浓度15.00%,沙棘叶绿体的清除率为55.02%;根据实际情况优化为温度25 ℃,pH5,乙醇浓度15%条件下进行验证实验,测得亚硫酸盐清除率为55.45%,与预测值误差小于1%,证明响应面法可有效优化模拟酒中亚硫酸盐的清除条件。
2.2.5 响应面优化条件对4种葡萄酒中亚硫酸盐的清除实验 供试的4种葡萄酒pH为3.33~3.69,酒度为11%~12%。沙棘叶绿体可显著降低葡萄酒中的亚硫酸盐(图8)。清除率依次为干白(51.90%)>冰白(46.00%)>冰红(42.57%)>干红(30.14%)。较高的清除率表明沙棘叶绿体可作为亚硫酸盐的生物氧化剂,并适应特殊的葡萄酒环境。同时沙棘叶绿体在冰白、冰红两种甜型冰酒中较高的清除率具有实际意义,因为甜酒为了抑制酵母菌二次发酵,硫的添加量是干红的近4倍[23]。
2.3 沙棘叶绿体对4种葡萄酒感官品质的影响
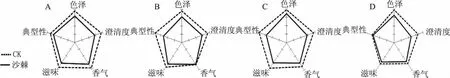
图9 沙棘叶绿体对冰白(A)、冰红(B)、干白(C)、干红(D)葡萄酒感官品质的影响Fig.9 Effects of seabuckthorn chloroplast on sensory quality of white icewine(A),red icewine(B),dry white wine(C)and dry red wine(D)
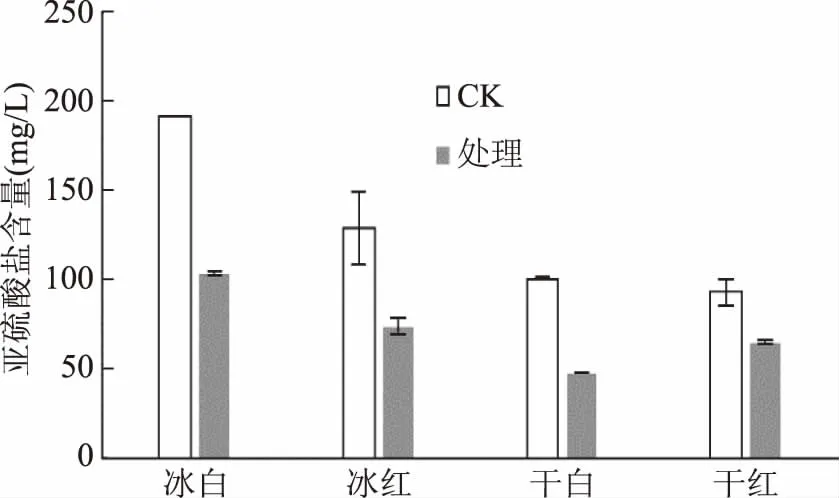
图8 沙棘叶绿体的响应面优化条件 对四种葡萄酒中亚硫酸盐含量的影响Fig.8 Effect of seabuckthorn chloroplasts at optimum conditions on sulfites contents in four kinds of wine
2.3.1 添加沙棘叶绿体后葡萄酒的感官评分 沙棘叶绿体对冰白(A)、干白(C)葡萄酒影响较大,5个指标得分均低于原酒,表明白葡萄酒的感官品质整体下降,而冰红(B)除了香气外,其它指标得分也有所降低(图9)。虽然沙棘叶绿体也影响干红(D)葡萄酒的颜色,但是香气和滋味的变化较小,也几乎不影响其口感的典型性,这是由于干红葡萄酒口感较复杂,单宁等苦涩物质、乙醇以及果皮中的植物性香气掩盖了微量叶绿体对口感的影响。
2.3.2 三角品尝实验 经品尝小组打分并计算,冰红、冰白、干白葡萄酒X2=13.23>3.85,均与原酒存在差异显著;干红葡萄酒X2=3.03<3.85,即添加沙棘叶绿体对干红酒样口感的影响不显著(p<0.05))。该结果与感官评分结果一致。
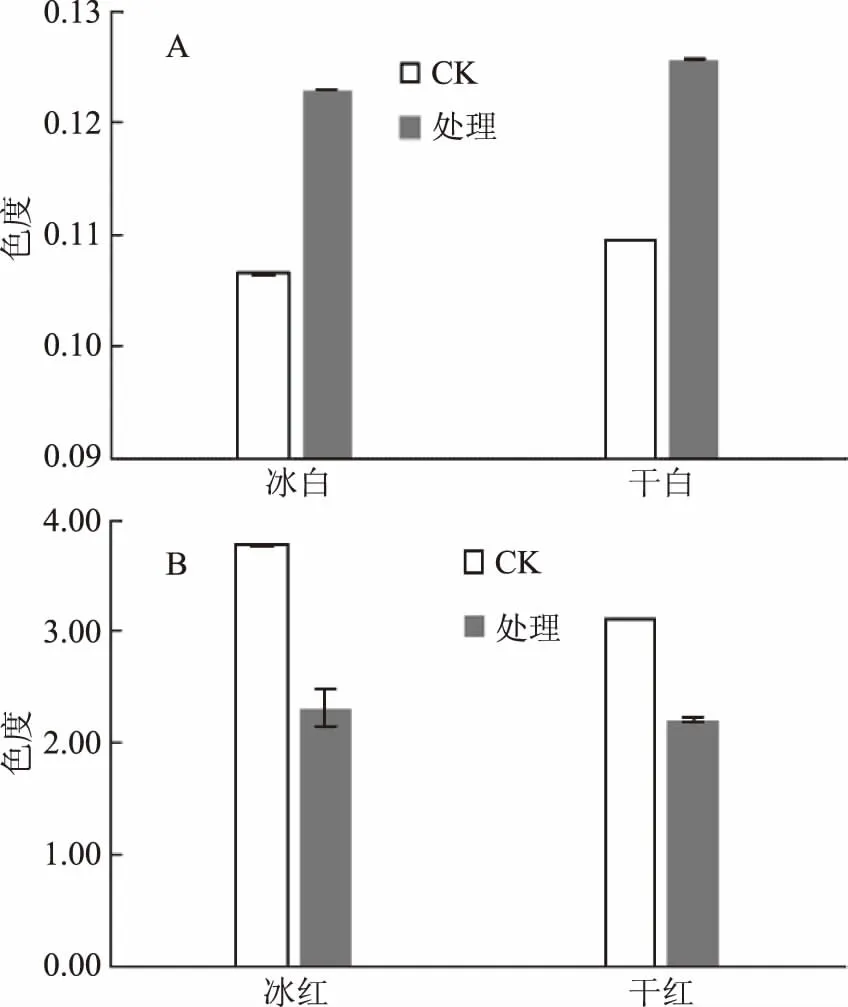
图10 沙棘叶绿体对白葡萄酒(A) 和红葡萄酒(B)色度的影响Fig.10 Effect of seabuckthorn chloroplasts on the color depth of white(A)and red wines(B)
2.3.3 沙棘叶绿体对4种葡萄酒颜色的影响 在白葡萄酒中加入沙棘叶绿体会使干白和冰白的色度分别增加16.44%和15.49%(图10A)。这表明叶绿体略微增加了酒液的黄绿色,从叶绿体自身的绿色也可得以印证。在红葡萄酒中添加沙棘叶绿体则会降低酒的色度(图10B),干红和冰红分别降低28.84%和38.89%,而色调分别增加11.23%和1.75%(图11)。由此表明酒液的紫红色损失较多,可能是由于花色素被叶绿体氧化所致,同时叶绿体自身的绿色使酒液的黄绿色略有增加。该结果与感官评分一致,四种酒的颜色都发生劣变。
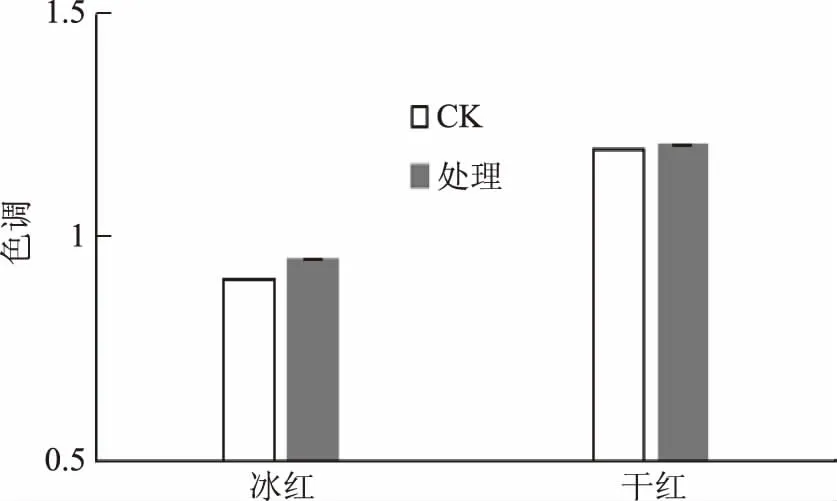
图11 沙棘叶绿体对两种红葡萄酒色调的影响Fig.11 Effect of seabuckthorn chloroplasts on the hue of red wines
3 结论
沙棘叶绿体可清除模拟葡萄酒中的亚硫酸盐。单因素实验表明叶绿体浓度、反应时间、反应温度、pH、乙醇浓度、光照条件均影响清除率,其中乙醇浓度、pH和反应温度的影响最为显著。对三个影响显著因素的响应面实验获得亚硫酸盐最佳清除率的回归模型,经计算最佳清除条件为反应温度25 ℃,pH5,乙醇浓度15%,此条件下沙棘叶绿体对模拟葡萄酒中亚硫酸盐的平均清除率为55.54%,在4种葡萄酒中的清除率分别为干白(51.90%)>冰白(46.00%)>冰红(42.57%)>干红(30.14%)。感官实验表明添加沙棘叶绿体对干红的口感影响最小。由此表明,沙棘叶绿体可通过体外氧化反应有效清除葡萄酒中的亚硫酸盐,具有清除率高,反应时间短,适应干红葡萄酒环境的优点,具有深度开发的价值。
[1]Vally H,Thompson P. Allergic and asthmatic reactions to alcoholic drinks[J]. Addiction Biology,2003,8(8):3-11.
[2]魏阳吉,马丽艳,李景明. 葡萄酒中硫化氢检测方法的研究[J]. 酿酒科技,2010(2):109-111.
[3]张丽霞,康健,吴桐. 新疆沙棘籽油提取工艺研究[J]. 食品科技,2011(8):196-201.
[4]臧茜茜,邓乾春,从仁怀,等. 沙棘油功效成分及药理功能研究进展[J]. 中国油脂,2015,40(5):76-81.
[5]Ali H. Nitrogen fixation by non leguminous plant seabuckthorn in semi arid cliamatic conditions of Gilgit-Baltistan[J]. Pakistan Journal of Weed Science Research,2013,19(4):305-314.
[6]陈云明,刘国彬,侯喜录. 黄土丘陵半干旱区人工沙棘林水土保持和土壤水分生态效益分析[J]. 应用生态学报,2002,13(11):1389-1393.
[7]Alexandrakis Z,Kyriakopoulou K,Katsaros G,et al. Selection of process conditions for high pressure pasteurization of seabuckthorn juice retaining high antioxidant activity[J]. Food and Bioprocess Technology,2014,7(11):3226-3234.
[8]范兆军,牛广财,朱丹,等. 响应面法优化沙棘果酒发酵条件的研究[J]. 食品与机械,2009,25(1):58-62.
[9]Ting H C,Hsu Y W,Tsai C F,et al. Theinvitro,andinvivo,antioxidant properties of seabuckthorn(HippophaerhamnoidesL.)seed oil[J]. Food Chemistry,2011,125(2):652-659.
[10]Jolivet P,Bergeron E,Zimierski A,et al. Metabolism of elemental sulphur and oxidation of sulphite by wheat and spinach chloroplasts[J]. Phytochemistry,1995,38(1):9-14.
[11]黄国平,姚玉静,陈黎斌. 叶绿体脱除亚硫酸盐效果研究[J]. 食品科学,2010,31(4):21-23.
[12]王向丽,丁力,黄国平,等. 叶绿体催化脱除二氧化硫的研究[J]. 现代食品科技,2009,25(10):1140-1143.
[13]黄国平,王向丽,胡飞. 叶绿体的提取方法与其脱除二氧化硫的活性[J]. 食品科技,2011(7):211-214.
[14]任家荣,刘霁欣,李瑞年,等. 气体放电法氧化高浓度亚硫酸盐[J]. 物理化学学报,2004,20(6):656-658.
[15]Covello P S,Thompson J E. Spin trapping evidence for formation of the sulfite radical anion during chloroplast-mediated oxidation of bisulfite ion[J]. Biochimica et Biophysica Acta(BBA)-General Subjects,1985,843(1-2):150-154.
[16]Bharali B,Bates J W. Detoxification of dissolved SO2(Bisulfite)by Terricolous Mosses[J]. Annals of Botany,2006,97(2):257-263.
[17]Li B,Xing D,Zhang L. Involvement of NADPH oxidase in sulfur dioxide-induced oxidative stress in plant cells[J]. Photochemical and Photobiological Sciences,2007,6(6):628-634.
[18]李永裕,潘腾飞,余东,等. 模拟酸雨对龙眼叶片PSⅡ反应中心和自由基代谢的影响[J]. 生态学报,2012,32(24):7866-7873.
[19]Lin S C,Georgiou. A biocatalyst for the removal of sulfite from alcoholic beverages[J]. Biotechnology and Bioengineering,2005,89(1):123-127.
[20]黄国平,刘岩,陈黎斌. 叶绿体清除白葡萄酒中二氧化硫效果研究[J]. 安徽农业科学,2013(2):804-806.
[21]金争平,温秀凤,张吉科. 沙棘叶生理年龄与源库功能转化的关系[J]. 国际沙棘研究与开发,2012,10(2):22-27.
[22]Rowe J D,Harbertson J F,Osborne J P,et al. Systematic identification of yeast proteins extracted into model wine during aging on the yeast lees[J]. Journal of Agricultural and Food Chemistry,2010,58(4):2337-2346.
[23]李华. 葡萄酒工艺学[M]. 北京:科学出版社,2007.
[24]中华人民共和国质量监督检验检疫总局,中国国家标准化管理委员会. GB/T 15038-2006 葡萄酒、果酒通用分析方法[S]. 北京:中国标准出版社,2007.
[25]李华. 葡萄酒品尝学[M]. 北京:科学出版社,2006.
[26]中华人民共和国质量监督检验检疫总局,中国国家标准化管理委员会. GB 15037-2006 葡萄酒[S]. 北京:中国标准出版社,2007.
[27]卫瑾,汤小仪,李有则. 乙醇对菠菜叶绿体的光合作用的影响[J]. 植物生理学报,1982(2):51-57.
[28]韩俊华,周君一,牛天贵,等. 乙醇对鲜切西兰花抗氧化酶及叶绿体超微结构的影响[J]. 食品科学,2008,29(3):283-287.
[29]周文彬,邱保胜. 植物细胞内pH的测定[J]. 植物生理学报,2004,40(6):724-728.
[30]焦雨歆,赵琦,王雪英,等. 环境因子对植物叶绿体结构的影响[J]. 生物技术通报,2008(2):5-10.
[31]黎明,杨芳绒,商卫卫. 低温对宜昌润楠生理指标及叶片超微结构的影响[J]. 西北林学院学报,2010,25(4):19-22.
[32]王荣,杜红波,秦艳芬,等. 两种亚硫酸氢盐对“红富士”叶片光合色素含量的影响及其原因探析[J]. 昭通学院学报,2013(5):52-55.
