转化生长因子β对体外成熟猪卵子成熟率的影响
2018-01-06陈静波张响英金彩莲李腾腾沈鸣扬杨二军尹最难
陈静波+张响英+金彩莲+李腾腾+沈鸣扬+杨二军+尹最难
摘要: 在猪卵子的体外生产方面,关于卵子的体外成熟和体外受精技术目前还存在着不足,特别是猪的受精卵体外生产方面存在复杂的细胞质成熟、多精子侵入率较高以及前核形成受到抑制等问题。为改善猪卵子体外成熟体系,将转化生长因子β(transforming growth factor-β,简称TGFβ)添加到体外成熟的培养液中,研究TGFβ对裸卵和卵丘卵母细胞复合体成熟率的影响。在没有添加TGFβ的体外成熟培养液中,裸卵和卵丘卵母细胞复合体被成熟培养24 h,结果没有卵子达到M-Ⅱ时期,但是在添加TGFβ的体外成熟培养液中,观察到有卵子达到M-Ⅱ时期。另一方面,当卵丘卵母细胞复合体在体外成熟培养时,将TGFβ添加到不同培养阶段(0~24 h或24~48 h)的培养液时,卵子的成熟率没有差别。对裸卵在体外成熟培养 24 h 时,当在前半期添加TGFβ时(0~24 h),卵子的成熟率为59%;当在后半期添加TGFβ时(24~48 h),卵子的成熟率为57%。同样在裸卵组中,当在全期添加TGFβ时(0~48 h),卵子的成熟率为27%;当无添加TGFβ时,卵子的成熟率为38%。前2组与后2组相比,卵子成熟率有显著差异。
关键词: 转化生长因子β;体外成熟;体外受精;猪卵子;卵丘卵母细胞
中图分类号: S828.3 文献标志码: A
文章编号:1002-1302(2017)22-0176-03
哺乳动物卵子的成熟发生在胎儿时期并且停止于前I期的双线期,这个时期将一直持续到排卵前期[1]。在这段休止期卵子是无法完成受精的。卵子具有受精能力是在完成减数分裂到达M-Ⅱ时期,释放第一极体的时候。哺乳动物卵子的生长必须要有外围包裹着的卵丘细胞才能成熟。卵子在排卵之前都会保持GV期(germinal vesicle)卵母细胞状态,在促性腺激素的作用下引起生理上的反应完成排卵。卵子开始恢复细胞核的成熟,主要表现在卵母细胞发生生发泡破裂(germinal vesicle breakdown,简称GVBD)、同源染色体的分离、第一极体的排出。在细胞质成熟过程中,胞浆内积累多种蛋白质和稳定的mRNA,线粒体会发生有效重排[2]。到排卵时,包裹着卵子的卵丘细胞已经完全膨胀,卵子已经达到了 M-Ⅱ 时期。这是因为在促黄体生成素(luteinizing hormone,简称LH)的作用下,使卵子恢复了减数分裂以及卵丘细胞的膨胀[3]。然而发生这些变化的原因也可能是在排卵之前,其他分子参与控制这些机制作用而导致卵子发生变化。
最近研究表明,在某些动物的卵丘卵母细胞复合体和由卵泡包裹的卵子中,减数分裂的恢复是由表皮生长因子(epidermal growth factor,简称EGF)、转化生长因子α(transforming growth factor-α,简称TGFα)、转化生长因子β(transforming growth factor-β,简称TGFβ)所引起的[4-6]。TGFβ是一种多功能的细胞活化素并且具有多种形式。它们属于一个大的基因家族,在细胞生长方面扮演着许多角色,比如分化、迁移以及细胞外基质的形成、细胞表面分子表达的调节。对不同的基因,TGFβ也有许多种类。据报道,1985年已经克隆出来人类的TGFβ的cDNA序列,现在称之为TGFβ-1[7]。 1987年从牛骨头里分离出1种多肽物质,能合成胶原蛋白,与TGFβ-1表现出71%的同源性,后来被命名为 TGFβ-2。第3种TGFβ被命名为TGFβ3,与TGFβ-1和TGFβ-2 相比,分别表现出76%和80%的同源性。在哺乳动物的细胞里3种TGFβ都能得以表达。TGFβ-1是由390个氨基酸组成的。实际上所有的细胞都具有TGFβ-1接受体,它们能控制细胞的许多功能。据报道有9个膜蛋白和TGFβ相结合。
调解卵子成熟的主要是卵丘细胞。据报道,卵丘细胞提供给卵子营养和其他物质,以及完成相互通信是通过缝隙连接完成的。卵丘细胞和卵子之间缝隙连接对于细胞间的相互作用,特别是对旁分泌和内分泌的调节是非常重要的。因此,本研究主要探讨TGFβ对与体外成熟培养的卵子以及卵丘卵母细胞复合体成熟率的影响。
1 材料与方法
1.1 卵子的准备
猪的卵巢取自江苏省泰州市城郊屠宰场,放入35~37 ℃的085%生理盐水中带回实验室。试验人员在显微镜下用嘴吸住特制吸管,将存在于TALP缓冲液(Tyrodes Albumin Lactate Pyruvate:红细胞裂解液,含0.1%的聚乙烯醇)的卵丘卵母细胞吸出。每15个卵子放进100 μL不含牛血清的NCSU23培养液中。此培养液中含有10%的猪卵泡液、0.6 mmol/L 半胱氨酸、10 IU/mL人体绒毛促性腺激素、10 IU/mL 孕馬血清促性腺激素,培养液小滴被矿物油所覆盖,在 38.5 ℃、5% CO2培养箱中培养24~48 h。
1.2 试验设计
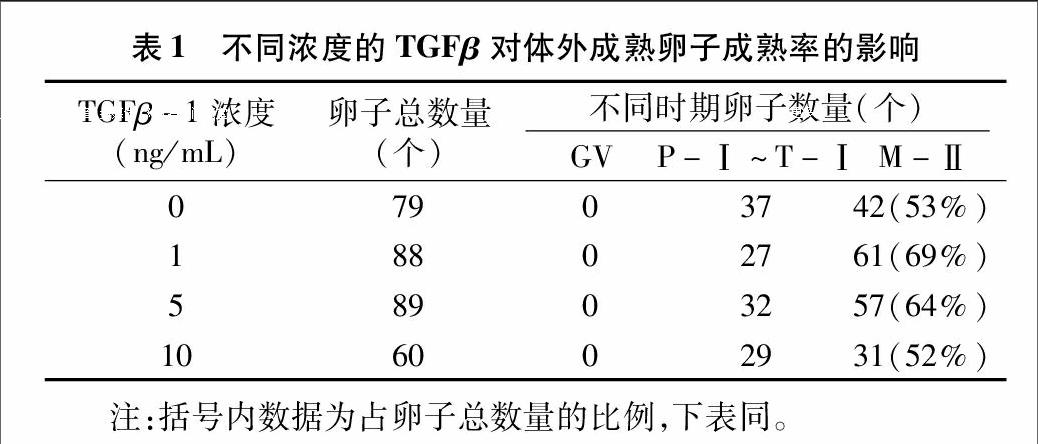
在第1个试验中,将不同浓度的TGFβ-1(0、1、5、 10 ng/mL)添加到成熟培养液中,评定卵丘卵母细胞的成熟率。
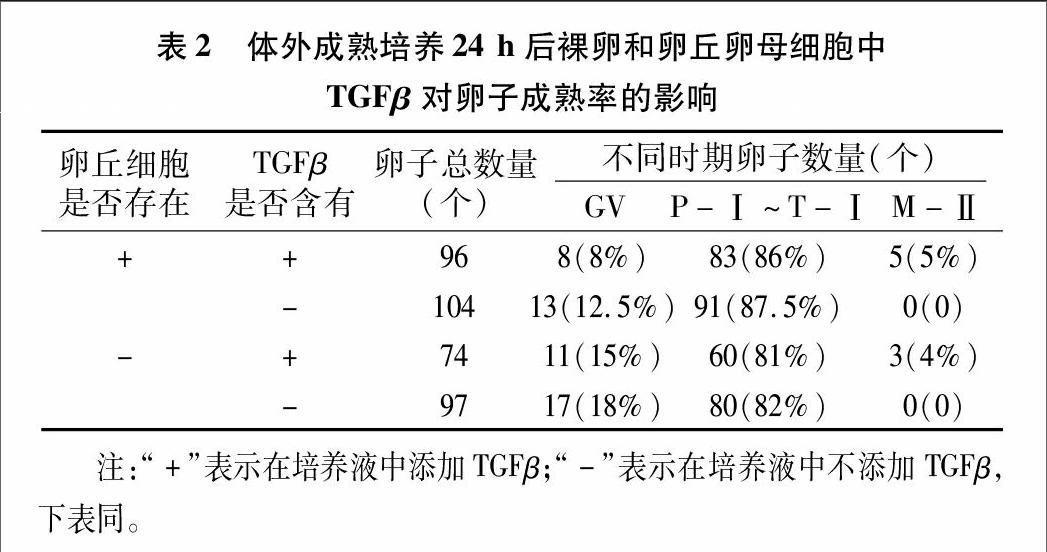
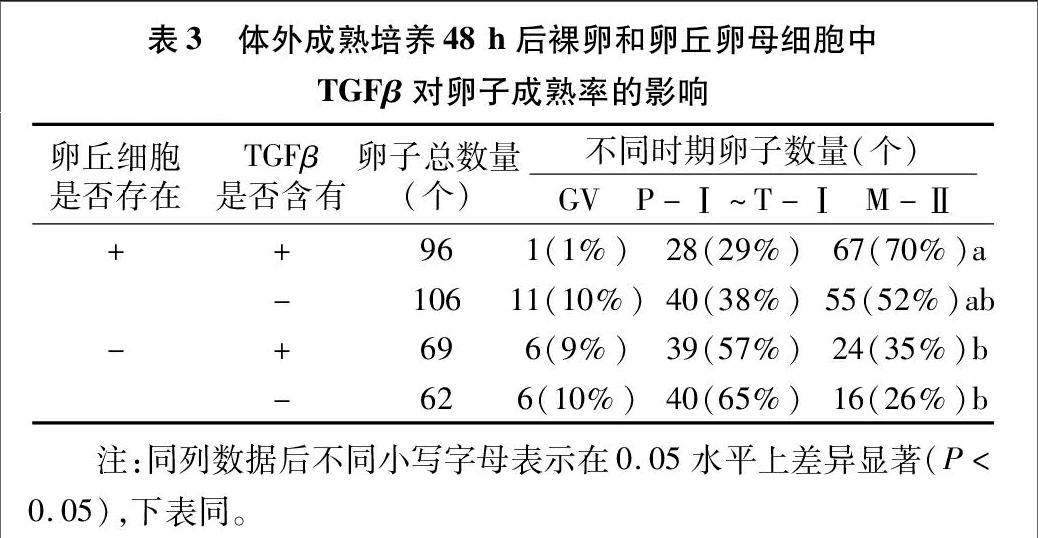
在第2个试验中,将裸卵和卵丘卵母细胞保存在含有和不含有TGFβ-1(1 ng/mL)的培养液中24、48 h后,评定裸卵和卵丘卵母细胞的成熟率。
在第3个试验中,将裸卵或卵丘卵母细胞复合体培养在含有或者不含有TGFβ-1(1 ng/mL)的培养液中。将 TGFβ-1添加到培养液中的时间段分别是体外培养0~24 h、24~48 h、0~48 h。
1.3 卵子成熟的评估
试验最后,用吸管反复去除卵丘细胞,把裸卵放在载玻片的中心,盖上盖玻片。将载玻片放入25%的醋酸中浸泡2~3 d,加1%的苔红素染色,浸泡在45%的醋酸中。用酰基甘油除去多余的染料,并放在倒位相位差显微镜下,放大200~400倍观察。endprint
卵子被分为GV期(germinal vesicle)、P-Ⅰ期(prophase- Ⅰ)、M-Ⅰ期(metaphase-Ⅰ)、T-Ⅰ期(telophase-Ⅰ)和M-Ⅱ期(metaphase-Ⅱ)。
1.4 统计分析
采用SAS软件对数据进行整理与分析,应用ANOVA作方差分析(α=0.05)。
2 结果与分析
在第1个试验中,当将卵丘卵母细胞复合体培养在添加不同浓度的TGFβ-1培养液时,卵丘卵母细胞复合体到达 M-Ⅱ时期的比例分别是53%(42/79)、69%(61/88)、64%(57/89)、52%(31/60)(表1)。
为检测TGFβ和卵丘细胞对卵子体外成熟率的影响,将裸卵和卵丘卵母细胞复合体体外成熟培养24 h,在裸卵和卵丘卵母细胞复合体中,一组在培养液中添加TGFβ,而另一组不在培养液中添加TGFβ。结果表明,无论是裸卵还是卵丘卵母细胞复合体,在培养液中添加TGFβ的组中,卵丘卵母细胞复合体和裸卵的成熟率分别是5%、4%,而没有添加TGFβ的培养液中,卵丘卵母细胞复合体和裸卵的成熟率均是0(表2)。
然而在体外成熟培养48 h后,在添加TGFβ、未添加TGFβ组中卵丘卵母细胞复合体达到M-Ⅱ成熟阶段的比例分别是70%、52%;裸卵组中的成熟率分别是35%、26%,卵丘卵母细胞组的成熟率比裸卵组的成熟率有所提高(表3)。
在第3个试验中,将卵子培养在含有或不含有TGFβ(1 ng/mL)的各个时间段培养液中。在卵丘卵母细胞组中,卵子的成熟率无显著差异。然而,当卵子处于裸卵状态时,与TGFβ暴露在培养液的时间是0~24 h、24~48 h时(卵子成熟率为27%),以及在这2个时间段中均无添加TGFβ的培养液(卵子的成熟率38%)相比,当TGFβ暴露在培养液的时间分别是0~24 h(卵子成熟率为59%)、24~48 h(卵子成熟率为57%)时,后2组卵子成熟率有显著提高(表4)。
3 结论与讨论
卵子为受精做准备,不仅要发生减数分裂而且细胞质也要经历极重要的变化,包括卵子将获得支持精子染色质的去凝缩作用和随后的雄性前核形成的能力。尽管在体外卵子核的成熟能够自发地完成,但是体外成熟的卵子可能缺少使精子去凝缩和雄性前核形成的能力。Yoshida等认为卵丘细胞在细胞质成熟方面扮演了一个重要的角色[4]。Zheng等认为,当被卵丘细胞包裹的卵子在含有卵泡液和卵泡膜细胞的培养液中培养时,会加强细胞质的成熟[5]。这些结果表明,卵泡细胞能通过旁分泌和自分泌来分泌一些能够调节细胞质成熟的因子。生长因子类似转化生长因子(TGFβ),已经被證实能够刺激或加强卵子细胞核的成熟。最近的研究主要集中在解释TGFβ-1的信号传播途径方面。据证明,Type-Ⅰ和Type-Ⅱ受体依靠TGFβ-1形成了1个异侧的复合体。TGFβ-1连接Type-I和Type-Ⅱ受体的复合体触发了 Type-Ⅱ组的丝氨酸和苏氨酸蛋白激酶区域。这些蛋白激酶的活性是刺激磷脂酸C(phospholipase C,简称PLC)来打断细胞膜的纤维醇磷脂从而形成纤维醇三磷酸盐(inositol phosphate three,简称IP3)[6]。钙的浓度对维持抑制哺乳动物的卵子减数分裂具有重要的作用。在小鼠的裸卵及仓鼠的裸卵和卵丘卵母细胞中,细胞外高浓度的钙会使抑制卵子减数分裂的作用消失。然而卵子减数分裂的发展进程依靠于细胞外部钙的浓度,最近研究表明主要集中在细胞内部钙的运用和减数分裂的恢复。表明这种关系非直接的证据是运用新霉素,一种假定的磷酸肌醇逆转率抑制剂,在猪和牛的卵子中它能阻止卵母细胞发生生发泡破裂。这就意味着纤维醇三磷酸盐(IP3)可能与引发减数分裂恢复有关。
本研究探讨TGFβ对卵子和卵丘细胞成熟的作用效果。然而,将卵丘卵母细胞复合体添加到不同浓度的TGFβ-1的培养液时,卵子的成熟率没有差别(表1)。在其他研究中表明,TGFβ能刺激大鼠和小鼠的成熟。TGFβ能在结构和功能上调节EGF,一种能在体外刺激猪卵母细胞成熟的激素。
TGFβ能因物种、培养条件以及被评估的类固醇不同而刺激或者抑制细胞的生长或者分化。TGFβ抑制细胞生长的能力应该与细胞的分化状态有关。体外培养4 d后,牛卵丘细胞在细胞周期功能上的分化、形态上的改变以及生成类固醇应答等方面的弱化,可能反映出牛卵丘细胞上TGFβ受体缺乏或者其对TGFβ敏感性的减弱。
结果表明,TGFβ不会影响体外成熟培养24 h的裸卵和卵丘卵母细胞复合体的成熟率(表2)。然而,当体外培养 24 h 后,TGFβ对裸卵和卵丘卵母细胞复合体恢复减数分裂具有一种有效的刺激作用。相反,缪勒管抑制物质能关闭对于TGFβ的同源性,抑制大鼠卵子的自然成熟。尽管TGFβ单独对于大鼠的自发卵子成熟没有作用,但是它能在体外抑制LH引导的卵子成熟。
卵丘卵母细胞复合体是由卵丘细胞和卵子构成的,二者之间在形态和功能上的连接是通过异种间的缝隙连接完成的。据报道,卵丘细胞和卵子之间通过缝隙连接进行双向的信息交换。对于缝隙连接关于减数分裂成熟的关系有2种解释。第1种理论认为,缝隙连接作为一种媒介可以从卵丘细胞传送抑制物质给卵子。第2种理论认为,由于激素的作用会对卵丘细胞产生刺激,这种刺激又是通过缝隙连接传给卵子而刺激其成熟。由于TGFβ不能直接支持裸卵或者卵丘卵母细胞复合体的自发成熟,这一结果似乎更接近于第2种理论假设。
本研究结果表明,当将TGFβ添加到培养液的不同阶段时,TGFβ能促进体外成熟培养时猪裸卵的成熟(表4)。由于TGFβ和卵丘细胞间的相互作用,TGFβ在猪卵子体外成熟培养时需要24 h,免疫组织化学的研究表明,TGFβ存在于大鼠和牛的荚膜细胞、细胞间质细胞中以及大鼠排卵之前的卵泡中。
综上所述,TGFβ能刺激猪卵子细胞核的成熟。这些结果意味着对体外成熟的猪卵子,卵丘细胞是关键的,但是TGFβ能促进裸卵的成熟。endprint
本研究主要探讨TGFβ和卵丘细胞对猪卵子体外成熟的影响。将卵母细胞放在不同浓度的TGFβ培养液中体外成熟培养时,不同浓度的TGFβ对卵子的成熟率没有差异。当体外成熟培养24 h后,在添加TGFβ的培养液中,裸卵发展到 M-Ⅱ阶段。在添加TGFβ组中,裸卵和卵丘卵母复合体中,体外成熟培养48 h后,卵子的成熟率分别为35%、70%;在不添加TGFβ组中,裸卵和卵丘卵母细胞复合体的成熟率分别是26%、52%。当将TGFβ添加到不同培养阶段的培养液中体外成熟培养时,卵丘卵母细胞复合体的成熟率在添加TGFβ不同阶段时,成熟率达到了54%~71%。在裸卵组中,当添加TGFβ在0~24 h时,卵子的成熟率为59%,当添加TGFβ在24~48 h时,卵子的成熟率是57%。在裸卵中,0~48 h阶段均未添加TGFβ,裸卵的成熟率为38%,可见,添加TGFβ组的裸卵的成熟率(57%和59%)与0~48 h阶段均未添加TGFβ的组(38%)相比,差异显著。总之,TGFβ能促进猪卵子细胞核的成熟,卵丘细胞对卵子成熟起到关键作用,同时TGFβ能促进裸卵的成熟。
参考文献:
[1] Knobil E,Neill J D. The Physiology of Reproduction[M]//Wassarman P M. The mammalian ovum. New York:Ravan Press,69-102.
[2]张 莉. 猪卵母细胞体外成熟培养及孤雌发育研究[D]. 北京:中国农业科学院,2005.
[3]Tsafriri A,Dekel N,Bar-Ami S. The role of oocyte maturation inhibitor in follicular regulation of oocyte maturation[J]. Journal of Reproduction and Fertility,1982,64(2):541-551.
[4]Yoshida M,Ishizaki Y,Kawagishi H,et al. Effects of pig follicular fluid on maturation of pig oocytes in vitro and on their subsequent fertilizing and developmental capacity in vitro[J]. Journal of Reproduction and Fertility,1992,95(2):481-488.
[5]Zheng Y S,Sirard M A. The effect of sera,bovine serum albumin and follicular cells on in vitro maturation and fertilization of porcine oocytes[J]. Theriogenology,1992,37(4):779-790.
[6]Okragly A,Balwit J M,Haak-Frendscho M,et al. Transforming growth factor β-1(TGF-β-1):a biological prardox[J]. Promega Notes Magazine,1994(10):1-7.
[7]徐夢思,黄 涛,马 亮,等. 猪TGFβ1和TGFβRⅠ 基因多态性与产活仔数的关联分析[J]. 江苏农业科学,2016,44(2):38-41.endprint
