杜梨bHLH转录因子家族两成员的序列特征及对非生物胁迫的转录响应
2018-01-06李晓刚李慧杨青松蔺经常有宏
李晓刚+李慧+杨青松+蔺经+常有宏
摘要: 为探索杜梨(Pyrus betulaefolia Bunge)bHLH转录因子家族的序列特征及表达特点,以8叶期杜梨幼苗为材料,克隆获得2个bHLH转录因子bHLH122-1和bHLH122-2,采用qPCR方法研究它们在非生物胁迫下的表达情况。结果表明,bHLH122-1和bHLH122-2开放阅读框为1 302 bp和1 251 bp,编码的蛋白分别含433个和416个氨基酸残基,分别与苹果的MdbHLH122的同源性最高(83.49%和93.51%)。bHLH122-1和bHLH122-2主要在叶中表达,盐、干旱以及渗透胁迫均能诱导PbbHLH122-1和PbbHLH122-2的表达,但它们对ABA处理并无转录响应。此外,PbbHLH122-2对上述逆境的应答要早于PbbHLH122-1,而PbbHLH122-1的表达量大于PbbHLH122-1。综上所述,bHLH122-1和bHLH122-2均参与杜梨叶片对非生物胁迫的防御机制,该机制不受ABA信号调控,并且PbbHLH122-1和PbbHLH122-2在逆境条件下发挥的作用可能略有不同。
关键词: 杜梨;bHLH122转录因子;非生物胁迫;表达特征
中图分类号: S661.201 文献标志码: A
文章编号:1002-1302(2017)22-0040-06
bHLH(basic Helix-Loop-Helix,堿性-螺旋-环-螺旋)转录因子是真核生物中广泛存在的一大类转录因子,通过特定的氨基酸残基与靶基因相互作用,进而调节相关基因的表达[1]。bHLH转录因子家族成员在植物中数量众多,为仅次于MYB类转录因子的第二大基因家族[2]。例如,bHLH转录因子在拟南芥(Arabidopsis thaliana)基因组中为147个[3-4],在水稻(Oryza sativa)中有167个[5],菜豆中为155个[6]。bHLH转录因子广泛参与植物叶片花青素合成[7]、光周期对花期的调控[8]、果实的发育成熟[9-10],以及缺铁条件下根的应激反应[1,11]等多种生命活动。除此之外,研究表明bHLH基因家族中部分成员在植物适应逆境过程中发挥重要作用,例如,拟南芥的AtbHLH122表达受干旱、高盐、渗透等非生物胁迫强烈诱导,超量表达AtbHLH12可显著提高转基因植株的抗逆能力[12];在野生稻(Oryza rufipogon)Dongxiang中过量表达OrbHLH001,可显著提升植株耐盐和耐寒能力[13];分析菜豆155个bHLH转录因子在高盐条件下的表达情况发现,其中16个基因在根部和叶片中的表达量均有显著升高[6]。
杜梨(Pyrus betulaefolia Bunge)具备良好的耐旱、耐寒、耐涝等特性,为梨生产中广泛选用的砧木之一,其抗逆分子机制已成为目前的研究热点之一[14-17],但bHLH转录因子在杜梨抗逆机制中的研究尚未见报道。本研究选取杜梨幼苗为材料,克隆获得2条与拟南芥AtbHLH122同源的PbbHLH122-1和PbbHLH122-2的DNA和cDNA序列,并用定量PCR分析2条基因在不同非生物胁迫条件下的表达情况,探明杜梨PbbHLH122-1和PbbHLH122-2对非生物胁迫的转录响应,从而为进一步研究它们在杜梨逆境响应过程中的功能提供理论依据。
1 材料与方法
1.1 材料
供试杜梨的成熟种子采集于山东泰安,试验所用材料为8叶龄杜梨幼苗。脱落酸(ABA)、氯化钠(NaCl)、聚乙二醇(PEG-6000)和甘露醇(Mannitol)购自Sigma公司,RNA plant plus Reagent和Pfu DNA Polymerase购自天根生化科技(北京)有限公司,SMARTerTM RACE cDNA Amplification Kit、PowerScript ⅡTM反转录酶和SYBRPremix ExTaqTMⅡ购自宝生物工程(大连)有限公司,AxyPrep DNA凝胶回收试剂盒购自爱思进生物技术(杭州)有限公司,所有引物均由上海英骏生物技术有限公司合成。
1.2 方法
1.2.1 PbbHLH122-1和PbbHLH122-2的克隆 取经 100 mmol/L NaCl处理6 h的杜梨8叶龄幼苗,叶片总RNA 用RNA plant plus Reagent提取,基因组DNA采用CTAB法提取。按照PowerScript ⅡTM反转录酶和SMARTerTM RACE cDNA Amplification Kit说明书将总RNA反转录为cDNA第一 链。采用Liu等报道的在逆境处理中表达量显著提高的拟南芥(Arabidopsis thaliana)转录因子(NCBI 登录号:NP_564583.1) 作为模板[12],通过tblastN方法在NCBI数据库中(将Organism限定为Pyrus)搜索获得2条与其高度同源的梨属植物白梨(Pyrus×bretschneideri)基因LOC103967841和LOC103963544 。根据上述2条基因序列,分别设计引物 7841-F(5′-ATGGAATCGGATCTTCAGCAGCAT-3′)/7841-S(5′-CTACTGCTGCTTGTTTGAACAGGT-3′)和3544-F(5′-ATGGAATCAGATCATCAGCAGCAT-3′)/3544-S(5′-CTACTGCTGCTTGTTTGAGCAAGT-3′)用Pfu DNA Polymerase扩增编码区的cDNA和DNA序列。PCR反应体系为:buffer 2 μL、cDNA 2 μL上下游引物各0.8 μL、ddH2O 14.2 μL,Pfu DNA Polymerase 0.2 μL,总计20 μL。PCR反应参数为:94 ℃ 5 min; 94 ℃ 30 s,60 ℃ 30 s,72 ℃ 2 min,30个循环;72 ℃ 10 min。PCR特异产物用AxyPrep DNA凝胶回收试剂盒回收,连接、转化并PCR验证阳性菌株后,送上海英骏生物技术有限公司进行序列测定。endprint
1.2.2 PbbHLH122-1和PbbHLH122-2的生物信息学分析 PbbHLH122-1和PbbHLH122-2的核苷酸翻译采用BioXM软件,利用Gene StructureDisplay Server(http://gsds.cbi.pku.edu.cn/index.php)分析内含子和外显子组成[18]。使用ExPaSy-ProtparamTool(http://web.expasy.org/protparam/)分析氨基酸基本理化特性。氨基酸序列比对采用DNAMAN软件完成,Conserved Domains Search Service(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析保守域。用PSORT(http://psort.ims.ut-okyo.ac.jp /form.html)进行亚细胞定位预测。MEGA 5.0构建系统进化树。SOPMA SECONDARY STRUCTURE PREDICTION METHOD(http://nhjy.hzau.edu.cn/kech/swxxx/jakj/dianzi/Bioinf7/Expasy/Expasy8.htm)预测蛋白的二级结构,SWISS-MODEL(http://swissmodel.expasy.org/interactive)预测并繪制三维立体结构。所用序列均来自NCBI((http://www.ncbi.nlm.nih.gov)。
1.2.3 PbbHLH122-1和PbbHLH122-2表达研究 选择长势健壮、大小一致的杜梨8叶龄幼苗分别置于含100 mmol/L NaCl、10% PEG-6000、180 mmol/L Mannitol或20 μmol/L ABA的1/4改良MS营养液中,处理0、0.5、1、3、6、9、12 h后,分别收集叶片和根,保存于-70 ℃冰箱待用。以各处理或对照样品的2 μg总RNA逆转录成cDNA第一链,利用PbbHLH122-1和PbbHLH122-2跨内含子特异性引物 7841-E-F(5′-GAGCTTGTACCGAACATGGACAAG-3′)/7841-E-S(5′-CTACTGCTGCTTGTTTGAACAGG-3′)和 3544-E-F(5′-AGCTTGTACCAAACATGGACAAG-3′)/3544-E-S(5′-CTACTGCTGCTTGTTTGAGCAAG-3′),在Bio-rad荧光定量CFX96TM PCR仪进行实时定量PCR。选用PbActin基因引物qPBactS(5′-AACGGACATCAAGCCAAAAA AA-3′)/qPBactA(5′-CAGTTAGCACGCAATTCAGCCA-3′)为内参。反应体系为:SYBR荧光染料10 μL、cDNA 2 μL、上下游引物各0.8 μL、ddH2O 6.4 μL,总计20 μL。反应条件为95 ℃ 30 s;95 ℃ 20 s、58 ℃ 30 s、72 ℃ 10 s,40个循环。按照2-ΔΔCT法计算出待测基因相对表达量,应用Excel 2003整理试验数据并作图。
2 结果与分析
2.1 PbbHLH122-1和PbbHLH122-2 基因特征
以经100 mmol /L NaCl处理6 h的杜梨8叶龄幼苗叶片cDNA为模板,以7841-F/7841-S为引物,克隆获得1条长度为1 302 bp的cDNA序列,编码1条含有433个氨基酸的多肽,命名为PbbHLH122-1;以3544-F/3544-S为引物,克隆获得1条长度为1 251 bp的cDNA序列,编码1条含有416个氨基酸的多肽,命名为PbbHLH122-2。以DNA为模板,以7841-F/7841-S为引物,克隆获得1条长度为 2 105 bp 的DNA序列;以3544-F/3544-S为引物,克隆获得1条2 056 bp的DNA序列。对扩增得到的cDNA序列和对应的DNA进行分析发现:PbbHLH122-1和PbbHLH122-2基因均由6个外显子和5个内含子组成(图1)。序列比对表明杜梨的PbbHLH122-1与白梨(Pyrus × bretschneideri)的
LOC103967841序列完全一致,而PbbHLH122-2与白梨的LOC103963544序列完全一致,因此不再登陆新的基因序列。
2.2 PbbHLH122-1和PbbHLH122-2的生物信息学特征
运用ExPaSy-Protparam Tool对PbbHLH122-1和PbbHLH122-2编码蛋白的理化性质进行了预测。PbbHLH122-1分子式C2 014H3 180N612O669S19,分子量 47.29 ku,预测的等电点(pI)为6.27,亲水性为-0.775,表明此蛋白为亲水性蛋白,脂溶性较差。PbbHLH122-2分子式C1 926H3 028N580O645S19,分子量45.23 ku,预测的等电点(pI)为5.86,亲水性为-0.758,表明此蛋白为亲水性蛋白,脂溶性较差。由表1可见,PbbHLH122-1和PbbHLH122-2所编码的多肽相似性为84.63%。PbbHLH122-1和PbbHLH122-2分别与苹果的MdbHLH122的同源性最高(83.49%和9351%)。利用DNAman对拟南芥(NP_564583)、苹果(XP_008352410)、大豆(XP_003540708),芝麻(XP_015571362)、枣子(XP_015876019)的bHLH122基因编码的蛋白进行多序列比对分析,发现PbbHLH122-1和PbbHLH122-2与拟南芥等其他植物的bHLH122转录因子在C端存在着明显的保守区域。利用Conserved Domains Search Service(CD Search)对PbbHLH122-1和PbbHLH122-2进行保守结构域的分析,PbbHLH122-1在C端366~417位氨基酸(PRSIAERV RRTRISERMRKLQELVPNMDKQTNTSDMLDLAVEYIKDLQTQV Q)存在1个HLH结构域,而PbbHLH122-2在C端349~400位氨基酸(PRSIAERVRRTRISERMRKLQELVPNMDKQA HTSDMLDLAVE YIKDLQTQVQ)也存在1个HLH结构域,结果如图2所示。endprint
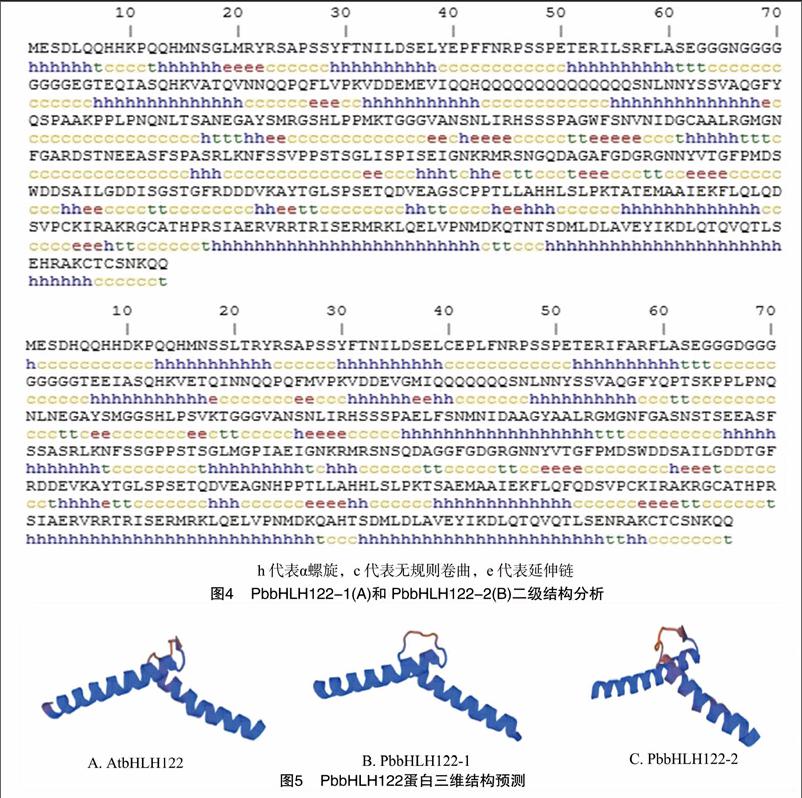
系统进化分析结果表明,PbbHLH122-1和PbbHLH122-2与苹果的MdbHLH122的亲缘关系最近,与豆科的大豆以及苜蓿的bHLH122也处于同一个进化分支上,表明它们有较近的亲缘关系(图3)。二级结构分析表明(图4),PbbHLH122-1 中α螺旋占27.94%,无规则卷曲占68.59%,延伸链占 3.46%,而PbbHLH122-2中α螺旋占 30.53%,无规则卷曲占66.11%,延伸链占3.37%。PbbHLH122-1和PbbHLH122-2在C端均有明显的连续α螺旋,与保守结构域的分析完全一致。利用SWISS-MODEL自由匹配模板,预测拟南芥AtbHLH122、PbbHLH122-1和PbbHLH122-2的C端保守域的3维结构(图5),可以看到三个蛋白C端保守域均含有1个螺旋-环-螺旋结构,仅在“环”位置上有微小差异,根据结构决定功能的原理,推测PbbHLH122-1和PbbHLH122-2与拟南芥AtbHLH122会有相似的功能。
2.3 PbbHLH122-1和PbbHLH122-2的表达特点
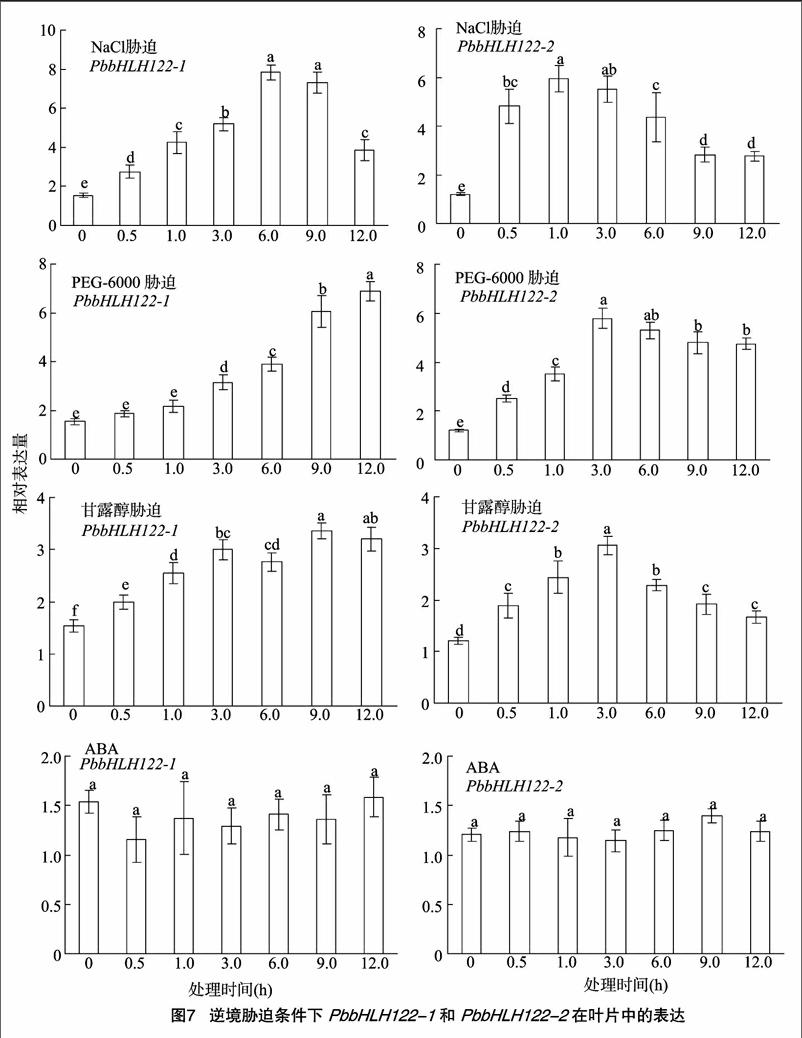
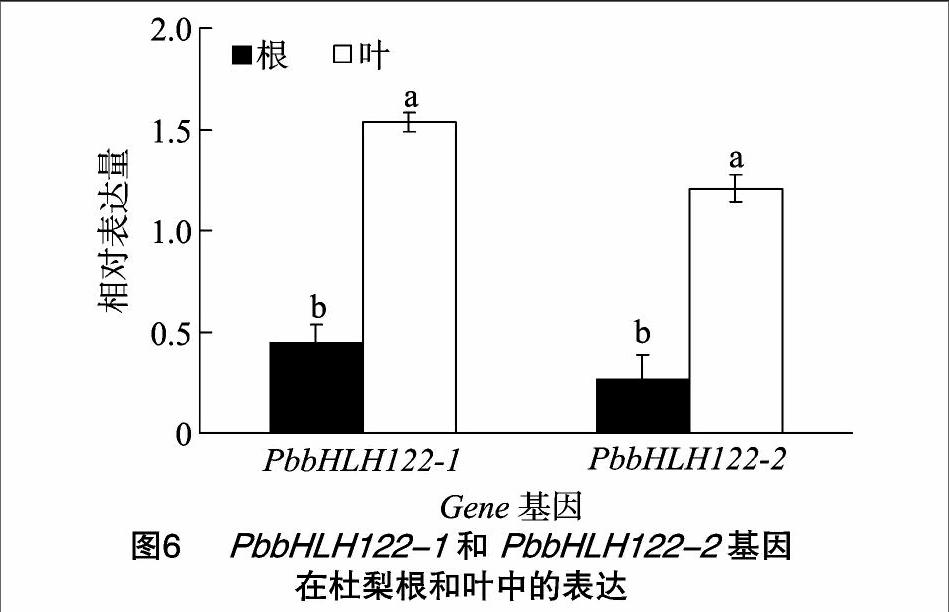
正常生长条件下,PbbHLH122-1和PbbHLH122-2在杜梨的根和叶中都有表达,其中叶中的相对表达量显著高于根部,而PbbHLH122-1 的表达量略高于PbbHLH122-2(图6)。盐胁迫条件下,PbbHLH122-1 在6 h后达到表达高峰(图7-A), 而PbbHLH122-2 的表达高峰在1 h之后便已出
现 (图7-B);PEG-6000模拟干旱胁迫条件下,PbbHLH122- 1直至12 h才出现表达高峰(图7-C),而PbbHLH122-2 在 3 h 出现高峰(图7-D);甘露醇处理条件下,PbbHLH122-1 于处理9 h后出现表达高峰(图7-E),而PbbHLH122-2 仍是在3 h就出现表达高峰(图7-F);ABA处理条件下,PbbHLH122-1和PbbHLH122-2 的表达量在12 h内均无显著变化(图7-G、图7-H)。综上所述,盐、干旱以及渗透胁迫均能提高PbbHLH122-1和PbbHLH122-2的表达量,PbbHLH122-2的相对表达量虽然不及PbbHLH122-1,但是其[CM(25]到達表达峰值的时间均比PbbHLH122-1 早,由此表明,2 个基因在杜梨应对非生物胁迫过程中所发挥的作用可能有所区别,并且它们所参与的信号途径不受ABA调控。
3 讨论
bHLH转录因子家族成员蛋白质C端都具有螺旋-环-螺旋的碱性保守功能域,该区域由2个含有疏水性氨基酸的偶极性α螺旋组成,第一个α螺旋也称识别螺旋,与识别蛋白结合特异的DNA序列有关;第二个α螺旋位于第一个α螺旋之上,基本上平行于双螺旋链,这种结构有利于氢键形成和范德华力作用,对于DNA结合至关重要[19]。这2个bHLH蛋白通过结合到下游基因的启动子上来调控下游基因的表达。本研究中克隆获得的2个杜梨bHLH转录因子,生物信息学分析发现它们所编码的蛋白在C端都具有螺旋-环-螺旋保守功能域。然而,并不是所有的bHLH基因家族成员只[CM(25]在蛋白质C端拥有保守结构域,例如云南红皮梨的1;个bHLH转录因子(HM622265) 除了在C端具有螺旋-环-螺旋保守功能域外,在N端也拥有bHLH-MYC保守结构域[20]。不同的结构决定不同的功能,云南红皮梨bHLH转录因子(HM622265) 主要参与了果实成熟过程中对果皮着色的调控作用,而PbbHLH122-1和PbbHLH122-2 则极有可能只参与植株对逆境条件的响应。
bHLH家族基因在逆境条件下被诱导表达的条件差异很大。例如,棉花的GhbHLH130 在逆境胁迫条件下,显著受高盐、干旱、ABA、低温胁迫的迅速诱导,而GhbHLH1 能够迅速响应ABA处理和干旱胁迫,却不受高盐和低温的影响[21]。本研究中,PbbHLH122-1和PbbHLH122-2 同源性为 84.63%,在C端都具有螺旋-环-螺旋保守功能域,表明其具有相似的功能,其表达规律也相似。然而,其在对逆境响应的过程中仍然具有一些差异。在高盐、干旱以及渗透胁迫条件下,PbbHLH122-2在1~3 h内即可达到表达峰值,而PbbHLH122-1通常需要6~12 h才能达到表达峰值。然而,从表达量上来看,PbbHLH122-1在上述条件下的相对表达量要略高于PbbHLH122-2。由此表明,PbbHLH122-1和PbbHLH122-2在逆境条件下发挥的作用可能略有不同。
在植物中,转录信号的级联在植物激素ABA和非生物胁迫的信号通路之间组成了一个复杂的信号网络,转录因子在其中发挥了重要作用[22-23]。然而,拟南芥中AtbHLH122显著受高盐、干旱和甘露醇的诱导,而ABA则不能诱导其表达,表明其可能直接调控逆境响应基因,而并不是通过ABA代 谢途径参与植株抗逆活动[12,24]。本研究中无论是PbbHLH122-1 还是PbbHLH122-2均对ABA胁迫无响应,表明与AtbHLH122具有相似的功能特点。
[HS2][HT8.5H]参考文献:
[1] Li X L,Zhang H M,Ai Q,et al. Two bHLH transcription factors,bHLH34 and bHLH104,regulate Iron homeostasis in Arabidopsis thaliana[J]. Plant Physiology,2016,170(4):2478-2493.
[2]Xu W D,Lepiniec L. Transcriptional control of flavonoid biosynthesis by MYB-bHLH-WDR complexes[J]. Trends in Plant Science,2015,20(3):176-185.endprint
[3]Bailey,C P. Update on the basic helix-loop-helix transcription factor gene family in Arabidopsis thaliana[J]. Plant Cell,2003,15(11):2497-2501.
[4]Toledo-Ortiz G H,Quail P H. The Arabidopsis basic/helix-loop-helix transcription factor family[J]. Plant Cell,2003,15(8):1749-1770.
[5]Li X X,Duan X P,Jiang H X,et al. Genome-wide analysis of basic/helix-loop-helix transcription factor family in rice and Arabidopsis[J]. Plant Physiology,2006,141(4):1167-1184.
[6]Kavas M,Baloglu M C,Atabay E S,et al. Genome-wide characterization and expression analysis of common bean bHLH transcription factors in response to excess salt concentration[J]. Molecular Genetics and Genomics,2016,291(1):129-143.
[7]Outchkourov N S,Carollo C A,Gomez-Roldan V,et al. Control of anthocyanin and non-flavonoid compounds by anthocyanin-regulating MYB and bHLH transcription factors in Nicotiana benthamiana leaves[J]. Frontiers in Plant Science,2014,5:519.
[8]Ito S,Song Y H,Josephson-Day A R,et al. FLOWERING BHLH transcriptional activators control expression of the photoperiodic flowering regulator CONSTANS in Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America,2012,109(9):3582-3587.
[9]Tani E. The study of a SPATULA-like bHLH transcription factor expressed during peach(Prunus persica) fruit development[J]. Plant Physiology and Biochemistry,2011,49(6):654-663.
[10] Groszmann M P,Smyth D R. Functional domains of SPATULA,a bHLH transcription factor involved in carpel and fruit development in Arabidopsis[J]. Plant Journal,2008,55(1):40-52.
[11]Ling H Q,Bauer P,Bereczky Z,et al. The tomato fer gene encoding a bHLH protein controls iron-uptake responses in roots[J]. Proceedings of the National Academy of Sciences of the United States of America,2002,99(21):13938-13943.
[12]Liu W W,Tai H H,Li S S,et al. bHLH122 is important for drought and osmotic stress resistance in Arabidopsis and in the repression of ABA catabolism[J]. New Phytologist,2014,201(4):1192-1204. [HJ1.76mm]
[13]Li F,Guo S Y,Zhao Y,et al. Overexpression of a homopeptide repeat-containing bHLH protein gene (OrbHLH001) from Dongxiang wild rice confers freezing and salt tolerance in transgenic Arabidopsis[J]. Plant Cell Reports,2010,29(9):977-986.
[14]王 宏. 耐鹽杜梨蛋白磷酸酶基因PbPP2C 的克隆及表达分析[J]. 江苏农业学报,2014,30(6):1464-1471.
[15]韩金龙. 杜梨CBL1和CBL7基因对非生物逆境的响应[J]. 果树学报,2014(4):529-535.
[16]李 慧. 杜梨PbPEAMT的克隆、序列分析及表达特征[J]. 植物生理学报,2012(5):449-455.
[17]李 慧,丛 郁,常有宏,等. 杜梨CPI基因的克隆、序列分析及表达[J]. 江苏农业学报,2011,27(5):1070-1077.
[18]Hu B,Jin J P,Guo A Y,et al. GSDS 2.0:an upgraded gene feature visualization server[J]. Bioinformatics,2015,31(8):1296-1297.
[19]Ding W N,Yu Z M,Tong Y L,et al. A transcription factor with a bHLH domain regulates root hair development in rice[J]. Cell Research,2009,19(11):1309-1311.
[20]孟富宣,周 军,辛培尧,等. 云南红皮梨bHLH转录因子的生物信息学分析[J]. 基因组学与应用生物学,2013(5):652-659.
[21]光杨其,宋桂成,张金凤,等. 1个新棉花bHLH类基因GhbHLH130 的克隆及表达分析[J]. 棉花学报,2014,26(4):363-370.
[22]许园园,李晓刚,李 慧,等. 梨CDPK基因家族全基因组序列鉴定分析[J]. 江苏农业学报,2015,31(3):659-666.
[23]田 鹏,苏艳丽,康保珊,等. 两个红梨品种花色苷合成相关基因及转录因子MYB10表达模式分析[J]. 江苏农业学报,2015,31(1):166-171.
[24]刘文文. bHLH122提高植物抗逆能力的分子机制初探[D]. 北京:中国农业科学院,2013.endprint
