汀棠湖轮虫主要食性功能群及其优势种群的周年动态对水环境变化的响应
2018-01-04温新利席贻龙
温新利,谢 萍,周 俊,席贻龙
安徽师范大学生命科学学院,安徽省高校生物环境与生态安全省级重点实验室,皖江城市带退化生态系统的恢复与重建安徽省协同创新中心,芜湖 241000
汀棠湖轮虫主要食性功能群及其优势种群的周年动态对水环境变化的响应
温新利,谢 萍,周 俊,席贻龙*
安徽师范大学生命科学学院,安徽省高校生物环境与生态安全省级重点实验室,皖江城市带退化生态系统的恢复与重建安徽省协同创新中心,芜湖 241000
为探讨轻度富营养湖泊中轮虫主要食性功能群及其优势种群的动态对水环境响应的生态机理,于2011年7月至2012年6月每月4次采集了芜湖市汀棠湖水体中的浮游动物样品,同步测定了水温、水体透明度、pH值、水体叶绿素a含量和氮磷含量,利用相关分析和多元线性回归分析方法分析了轮虫主要食性功能群及其优势种群的密度与非生物因子(如水温等)、食物资源(以粒径大小不同的藻类中的叶绿素a含量作为指标)及生物因子(枝角类、桡足类和晶囊轮虫等轮虫潜在竞争者和捕食者的密度)间的关系。结果显示:(1)汀棠湖中,掠食性轮虫的优势轮虫为针簇多肢轮虫(Polyarthratrigla);滤食性轮虫的优势种包括裂足臂尾轮虫(Brachionusdiversicornis)、长三肢轮虫(Filinialongiseta)和裂痕龟纹轮虫(Anuraeopsisfissa);(2)主成分分析表明,水温、叶绿素a含量、枝角类、桡足类及其无节幼体和晶囊轮虫的密度是影响与汀塘湖轮虫群落结构有关的变动最大的水环境因子。水温和藻类叶绿素a总含量分别对滤食性轮虫和掠食性轮虫总密度的周年变动的影响最大,而轮虫的潜在竞争者和捕食者对它们的负面影响均不大;(3)轮虫的潜在竞争者和捕食者对于轮虫优势种群密度动态的负面影响也不大。水温、藻类叶绿素a总含量及小型藻类叶绿素a含量(经孔径为25 μm的筛绢过滤后水样中的叶绿素a含量(Chl-a<25 μm))均与滤食性裂足臂尾轮虫和长三肢轮虫的密度间呈现显著或极显著的正相关关系。仅小型藻类的叶绿素a含量对裂足臂尾轮虫和长三肢轮虫密度的周年变动的影响最大。水温是影响滤食性裂痕龟纹轮虫密度动态的主要因子;(4)两食性功能群中的优势轮虫种群的卵率均未与其潜在竞争者和捕食者密度间呈现显著的负相关性。裂足臂尾轮虫、长三肢轮虫和针簇多肢轮虫种群卵率的变动受水温的影响最大,且它们之间均分别呈现显著的负相关性。研究结果表明,水温和食物资源可能是影响汀塘湖中滤食性轮虫和掠食性轮虫密度变动的重要的生态因子。
轮虫;食性功能群;优势种群;动态;环境因子
种群的时空变动及其调节机制始终是种群生态学研究的核心问题。在此研究领域中,作为浮游动物中的重要成员,轮虫因具备个体小、繁殖速率快和对水环境变化较为敏感等特性已被列入模式生物之一[1]。随着水生生物功能群的应用越来越受到人们的重视,有关基于轮虫功能群而开展的群体生态学的研究报道也日益增加。
食物资源是影响轮虫种群数量变动的一个重要因素,这已经在实验种群和自然种群的研究中得到了证实。自然水体中可供轮虫利用的食物资源是多样的,但不同种类轮虫偏好选择不同类型的食物资源[2]。有学者根据轮虫间食性的差异将轮虫划分成了两大功能群[3]。一种是以细菌-腐殖悬浮物和微型浮游生物(nanoplankton, ≤20 μm) 作为部分或专性食物的,被称为“微型滤食性轮虫(microfilter-feeders)”,包括裂痕龟纹轮虫(Anuraeopsisfissa)、螺形龟甲轮虫(Keratellacochlearis)、矩形龟甲轮虫(K.quadrata)和长三肢轮虫(Filinialongiseta)等;另一种是“大型滤食性轮虫(macrofilter-feeders)”,此类轮虫主要是以网藻、丝状藻或甲藻为食,有时也把微型浮游生物(nanoplankton)作为食物,甚至可食用直径为20—50 μm的浮游动物,这一类包括异尾轮虫(Trichocerca)、多肢轮虫(Polyarthra)、疣毛轮虫(Synchaeta)、无柄轮虫(Ascomorpha)和腹尾轮虫(Gastropus)等。根据轮虫口器类型和所摄食的食物粒径大小,有研究在此基础上将轮虫划分为6个功能群[4]:(1)微细颗粒滤食型轮虫(fine particle sedimentators),摄食颗粒粒径<5 μm,包括螺形龟甲轮虫、长刺盖式轮虫(Kellicottialongispina)、三肢轮虫(Filinia)和角突臂尾轮虫(Brachionusangularis);(2)小型颗粒滤食型轮虫(small particle sedimentators),摄食颗粒粒径可达到10 μm,如矩形龟甲轮虫和萼花臂尾轮虫(B.calyciflorus)等;(3)小型掠食性轮虫(small raptors),诸如针簇多肢轮虫(P.triga),主要以金藻、隐藻和硅藻为食;(4)大型掠食性轮虫(large raptors),像疣毛轮虫,可以摄食较大的食物颗粒≥ 50 μm;(5)捕食性轮虫(predators),如卜式晶囊轮虫(Asplanchnabrightwelli);(6)吮吸性轮虫(suckers),如异尾轮虫。上述这些不同的轮虫食性功能群间往往存在着个体大小和生活史特征或运动频率和速度的差异[5]。一般认为,相比体积较大的轮虫而言,小个体的轮虫具有较低的食物浓度阈值,导致其往往在资源竞争中占据优势地位[6-7];但是这种大小不同的轮虫间的资源竞争格局受到温度的影响[7]。
在自然水体中也有多种类型的轮虫的潜在捕食者,包括剑水蚤及某些肉食性轮虫(如晶囊轮虫)[8-9]等。有研究表明,这些捕食者对猎物轮虫的摄食具有选择性,与猎物轮虫的个体大小有关[10]。当水体中存在着较高的捕食压力时,轮虫会采取多样化的反捕食策略。有些轮虫会通过快速运动、形成反捕食的结构和低种群增长率等防御策略,而有些轮虫会采取高繁殖率的适应对策[10-11]。由于食性功能群不同的轮虫间的个体大小或生活史特征具有差异,因而猎物轮虫的种群数量受捕食作用的影响程度就有可能不同。
为探讨食性功能群及食性不同的优势轮虫种群的数量变动对水温、食物资源和捕食作用等水环境因子的响应,本文以安徽省芜湖市的汀棠湖为基地,比较分析了湖水中的各食性功能群及其轮虫优势类群的数量变动及其影响因素,旨在为轮虫种群变动及调节机制的研究提供参考。
1 材料与方法
1.1 采样点的设置、样品的采集与水体理化因子的测定
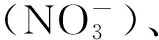
1.2 浮游动物样品的采集、鉴定、计数及轮虫食性功能群的划分
对包括轮虫在内的浮游动物的采集和计数的具体方法见同文献[12]。实验室显微镜下观察时,同步统计样品中臂尾轮虫、龟甲轮虫、三肢轮虫和龟纹轮虫等雌体携带的卵数(包括休眠卵)和脱落的卵数,用来计算优势种群的卵率;根据相关文献进行轮虫、枝角类和桡足类的鉴定[5, 13-15]。在对样品的观察中发现,汀棠湖中多肢轮虫的类型较为单一,仅在个别样品中出现极低密度的长肢多肢轮虫(P.dolichpotera),为便于分析,根据文献将其合并成针簇多肢轮虫(P.trigla)[5]。
1.3 数据的处理与分析
优势轮虫种类的确定见文献[12],其种群卵率的计算参照公式卵率(Egg ratio, E)=非混交卵的总数量/非混交雌体的总数量[16]。应用PAST软件筛选出与影响水体中轮虫群落变化相关的变动最大的水环境因子[17]。在SPSS 16.0统计软件中,首先利用One-sample Kolmogrov-Smirnov程序对浮游动物的密度和水环境变量进行数据正态性分析,对不符合正态分布的数据进行对数转换;然后,对优势轮虫种群的密度和其卵率及各轮虫食性功能群的总密度分别与筛选后的水体理化因子及生物因子(包括枝角类、桡足类、无节幼体密度以及晶囊轮虫的密度)进行相关分析。假定有多个水环境因子同各类型轮虫密度呈现显著的相关关系,在SPSS 16.0软件中利用向前多元线性回归分析法分析影响其密度和卵率动态的主要环境因子。
2 结果与分析
2.1 影响汀棠湖中轮虫群落结构季节变动的水环境因子的主成分分析
根据各汀棠湖水环境因子的年度变化值,对可能影响其中的轮虫群落结构变化的水环境因子进行主成分分析见图1。结果显示,前两主成分解释了水环境因子年度变化量的90.18%(F1:70.91%,F2:19.27%)。在主成分1(F1)和主成分2(F2)方向上,影响水环境因子变动最主要的因素包括非生物因子水温、水体叶绿素a 含量、晶囊轮虫、枝角类、桡足类及其无节幼体的密度等生物因子(图1)。
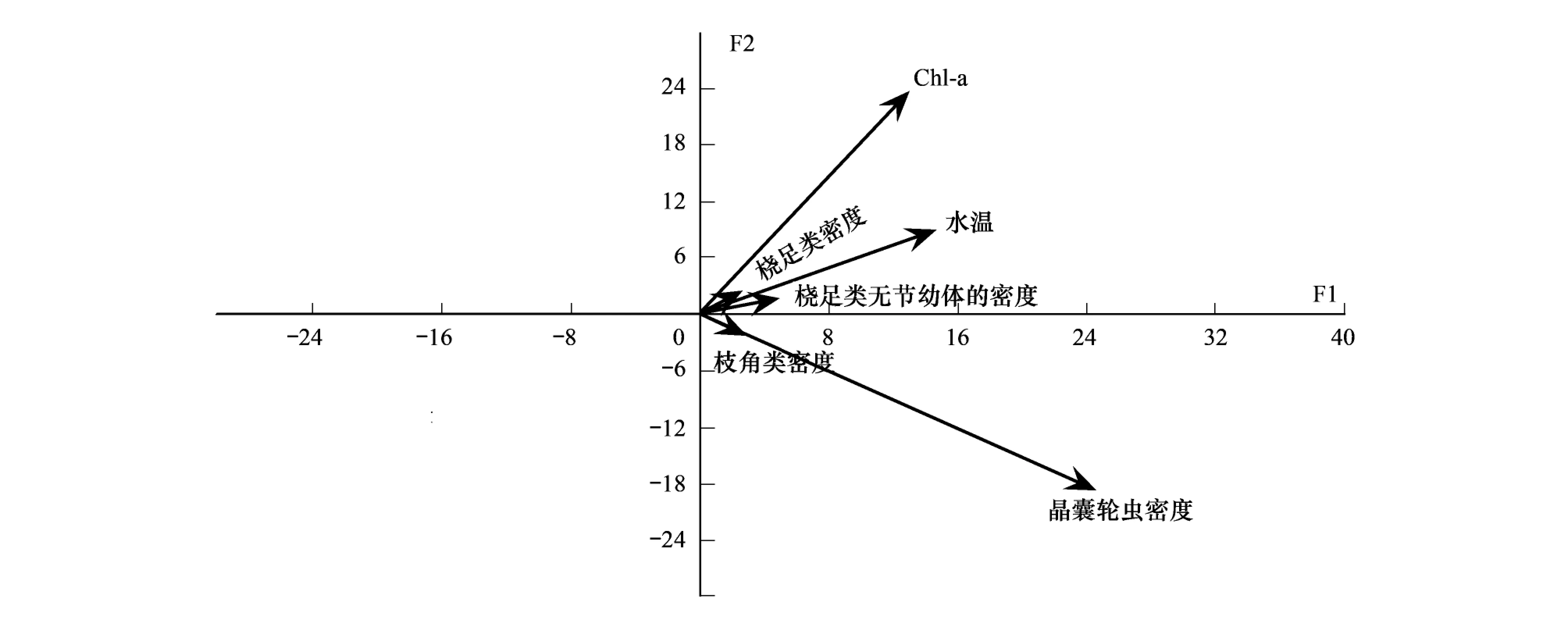
图1 影响汀棠湖中轮虫群落结构变化的水环境因子年度值的主成分分析 Fig.1 Principal component analysis of the annual variation values of the environmental factors affecting rotifer community structure in Lake Tingtang
2.2 轮虫食性功能群及其优势种群的年均密度
根据本文对轮虫食性功能群的划分标准,结合它们的年均密度,汀棠湖中的轮虫的主要食性功能群包括滤食性轮虫和掠食性轮虫两类。吮吸性轮虫因其年均密度很低,故在本研究中未做具体分析。
在滤食性轮虫中,轮虫的优势种群包括裂足臂尾轮虫(B.diversicornis)、裂痕龟纹轮虫和长三肢轮虫,其年均密度分别为18.2、54.6 个/L和56.4 个/L;而掠食性轮虫的优势种群为针簇多肢轮虫,其年均密度为136.3 个/L。
2.3 各轮虫食性功能群及其优势种群密度的周年变动和影响因素分析
汀棠湖的滤食性轮虫和掠食性轮虫的优势类群密度最高峰值均在8月初出现,分别为1330.0、1422.0个/L;这两类食性不同的轮虫的数量变化趋势也较一致,均在7—9月份维持较高的密度(图2)。
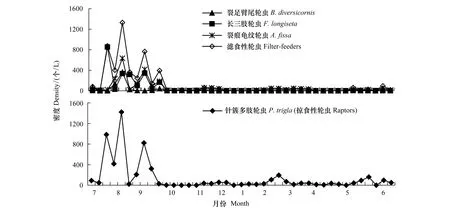
图2 汀棠湖中各轮虫食性功能群及其优势种群密度的周年变化Fig.2 Annual dynamics of each rotifer functional group and its dominant population in Lake Tingtang
汀棠湖中捕食性晶囊轮虫年平均密度为6.5 个/L,其在7月下旬达到最高峰值,为44.0 个/L。枝角类年均密度也较低,仅为0.9 个/L。桡足类成体(主要是剑水蚤)密度最高峰值出现在6月中旬,但仅有5.3 个/L;桡足类无节幼体的密度最高峰出现在7月中旬,为15.3 个/L;但从10月份以后其密度变得极低,直到次年五月份时其密度才相对较高(图3)。
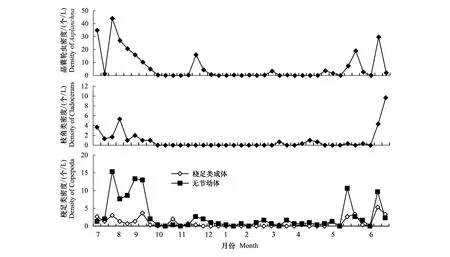
图3 汀棠湖中轮虫的潜在捕食者和竞争者密度的周年变化Fig.3 Annual dynamics of the densities of potential competitors and predators of rotifers in Lake Tingtang
相关性分析显示,汀棠湖中,水温同滤食性轮虫和掠食性轮虫的总密度及3种滤食性轮虫的优势种群(裂足臂尾轮虫、裂痕龟纹轮虫和长三肢轮虫)的密度间均呈显著的正相关关系(P<0.05)(表1);藻类叶绿素a总含量除与裂痕龟纹轮虫以外的轮虫密度都呈极显著的正相关关系(P<0.05);小型藻类的叶绿素a含量(Chl-a<25 μm)与滤食性轮虫的总密度、滤食性的裂足臂尾轮虫和长三肢轮虫的密度间均呈显著的正相关性(P<0.05)(表1)。
晶囊轮虫的密度与滤食性轮虫的总密度、掠食性轮虫的总密度、裂痕龟纹轮虫的密度间均呈极显著的正相关性(P<0.01);无节幼体的密度与滤食性轮虫的总密度、掠食性轮虫的总密度、裂痕龟纹轮虫和长三肢轮虫的密度间也均呈极显著的正相关性(P<0.01)(表1)。
3种优势轮虫的种群密度与滤食性轮虫的总密度间均呈现极显著的正相关关系(P<0.01)(表1)。滤食性轮虫和掠食性轮虫的总密度间也呈极显著的正相关性(P<0.01)(表1)。
多元线性回归显示,水温和藻类叶绿素a总含量分别对滤食性轮虫和掠食性轮虫的总密度的周年变动的影响最大(表2,图4)。在滤食性轮虫的优势种群中,小型藻类的叶绿素a 含量(Chl-a<25 μm)对裂足臂尾轮虫和长三肢轮虫的周年变动的影响最大(表2)。
表1汀棠湖中各轮虫食性功能群及其优势种群的密度与水体理化因子及轮虫的潜在竞争者和捕食者密度间的相关分析(浮游动物密度经过log转换)
Table1PearsoncorrelationcoefficientsbetweenthedensitiesofeachrotiferfunctionalfeedinggroupsanditsdominantpopulationsandeachoftheenvironmentalfactorsaswellasthedensitiesofpotentialcompetitorsandpredatorsinLakeTingtang(The densities of zooplankton were log transformed)
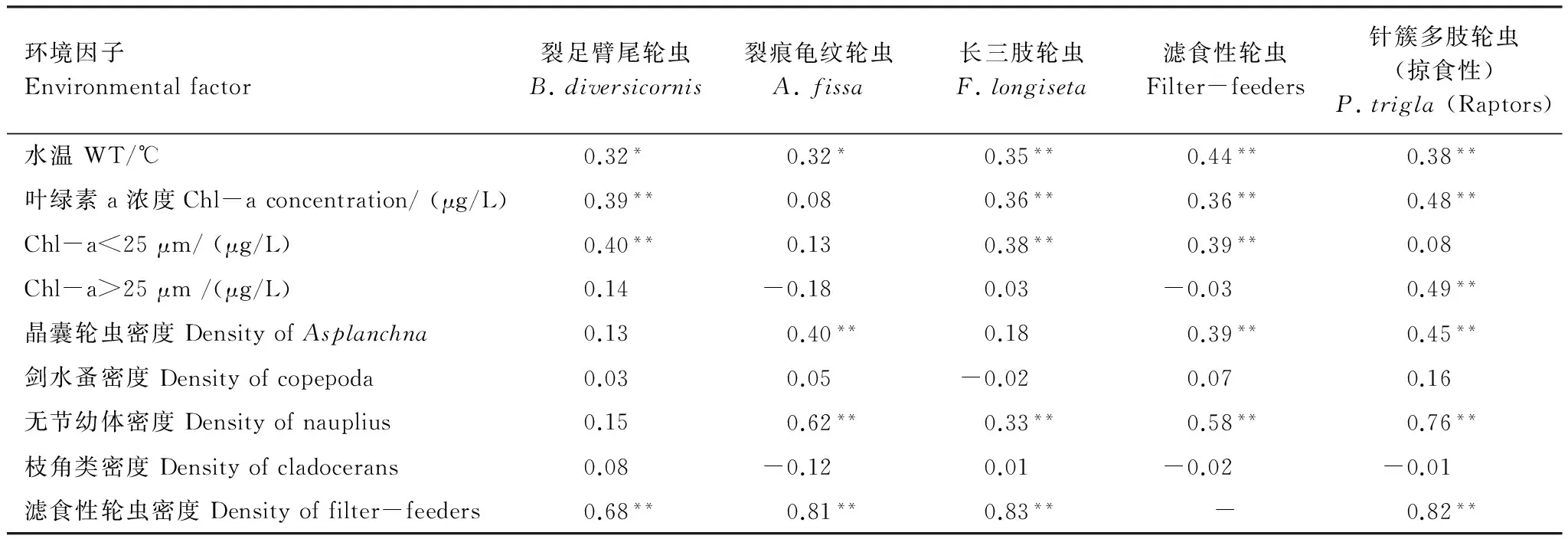
环境因子Environmentalfactor裂足臂尾轮虫B.diversicornis裂痕龟纹轮虫A.fissa长三肢轮虫F.longiseta滤食性轮虫Filter-feeders针簇多肢轮虫(掠食性)P.trigla(Raptors)水温WT/℃0.32*0.32*0.35**0.44**0.38**叶绿素a浓度Chl-aconcentration/(μg/L)0.39**0.080.36**0.36**0.48**Chl-a<25μm/(μg/L)0.40**0.130.38**0.39**0.08Chl-a>25μm/(μg/L)0.14-0.180.03-0.030.49**晶囊轮虫密度DensityofAsplanchna0.130.40**0.180.39**0.45**剑水蚤密度Densityofcopepoda0.030.05-0.020.070.16无节幼体密度Densityofnauplius0.150.62**0.33**0.58**0.76**枝角类密度Densityofcladocerans0.08-0.120.01-0.02-0.01滤食性轮虫密度Densityoffilter-feeders0.68**0.81**0.83**-0.82**
表中浮游动物的密度单位均为个/L;*P<0.05; **P<0.01
表2汀棠湖中各轮虫食性功能群及轮虫优势种群的密度和卵率的周年动态与水环境因子间的多元线性回归分析
Table2MultiplelinearregressionanalysesbetweenthedensitiesofeachrotiferfunctionalfeedinggroupanditsdominantpopulationandenteredphysicochemicalvariablesbasedonthePearson′correlation

因素源Source轮虫Rotifer被选择的因子Enteredvariable标准化偏回归系数Betacoefficient方程决定系数R2密度Density掠食性Chl-a0.48**0.23**滤食性水温0.44**0.20**裂足臂尾轮虫Chl-a<25μm0.40**0.16**长三肢轮虫Chl-a<25μm0.38**0.14**卵率Eggratio针簇多肢轮虫水温-0.60**0.36**
**:P<0.01
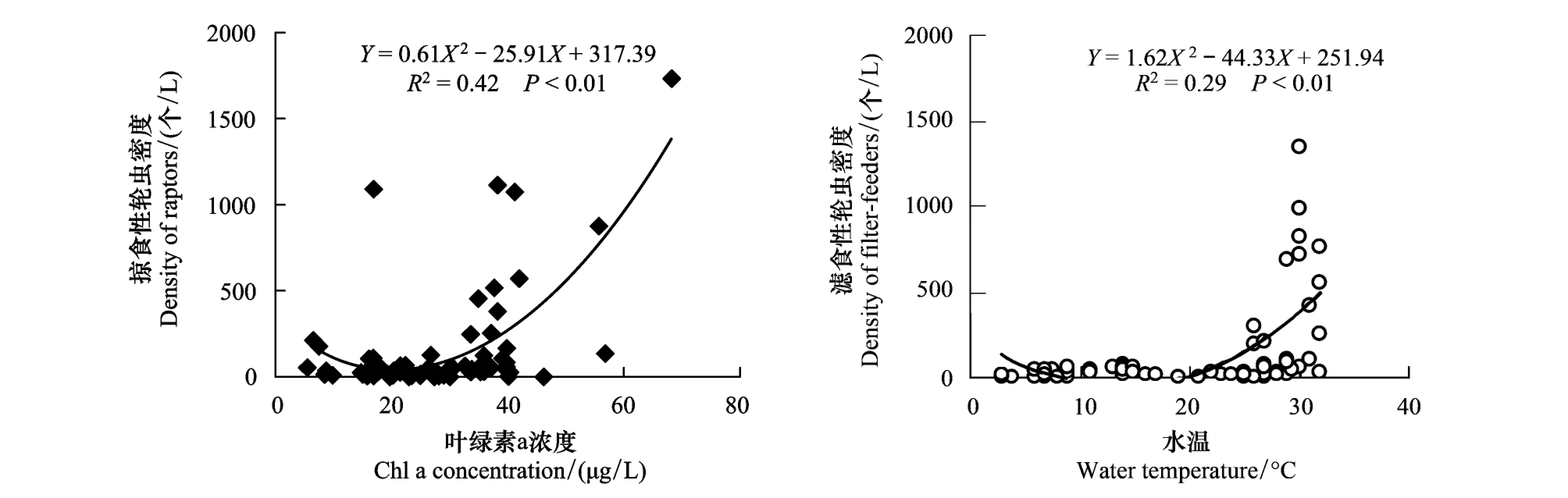
图4 汀棠湖中滤食性轮虫和掠食性轮虫的总密度与水体叶绿素a 含量及水温间的关系Fig.4 Regression relationships between the rotifer densities of filter-feeders and raptors and chl-a concentration as well as water temperature
2.4 食性不同的轮虫优势种群卵率的变动和影响因素分析
汀棠湖中,裂足臂尾轮虫、裂痕龟纹轮虫、长三肢轮虫和针簇多肢轮虫等四种轮虫的卵率均在0—2.0之间波动(图5)。在各轮虫的发生期内,裂痕龟纹轮虫的卵率相对较高(图5)。裂足臂尾轮虫的卵率最高峰出现在11月下旬,为1.0;裂痕龟纹轮虫和针簇多肢轮虫的卵率均在11月中旬同时出现最高峰值,峰值分别为1.07和0.20;长三肢轮虫的卵率在1月份出现最高峰(峰值为2.0),之后逐步下降(图5)。
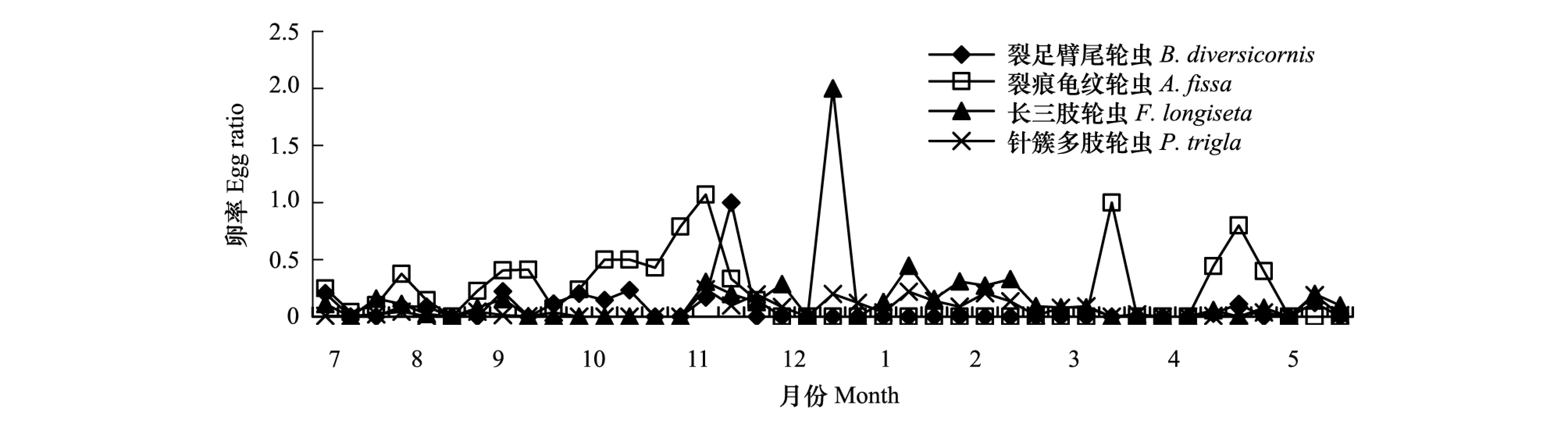
图5 汀棠湖中四种轮虫卵率的周年变化Fig.5 Annual dynamics of egg ratios of four rotifer species in Lake Tingtang
相关性分析显示,汀棠湖中,水温与除裂痕龟纹轮虫外的其他3种轮虫(裂足臂尾轮虫、长三肢轮虫和针簇多肢轮虫)的卵率均呈现显著的负相关关系(P<0.05)(表3)。Chl-a与 Chl-a < 25 μm 均与针簇多肢轮虫的卵率呈极显著负相关关系(表3)。多元线性回归分析结果显示,水温对针簇多肢轮虫的卵率的影响最大(表3;图6)。
4种轮虫的卵率同其潜在的竞争者和捕食者密度间均不存在显著的负相关关系(表3)。
表3汀棠湖中四种轮虫的卵率与水环境因子间的相关分析
Table3PearsoncorrelationcoefficientsbetweentheeggratiosoffourrotiferspeciesandeachoftheenvironmentalfactorsinLakeTingTang
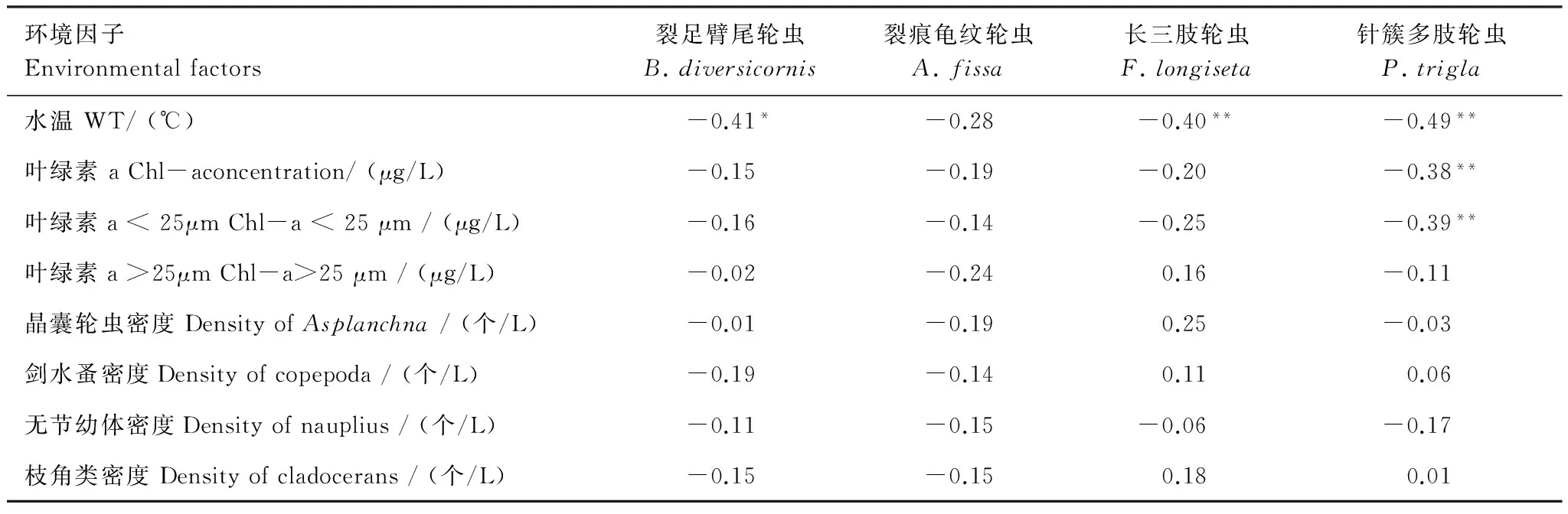
环境因子Environmentalfactors裂足臂尾轮虫B.diversicornis裂痕龟纹轮虫A.fissa长三肢轮虫F.longiseta针簇多肢轮虫P.trigla水温WT/(℃)-0.41*-0.28-0.40**-0.49**叶绿素aChl-aconcentration/(μg/L)-0.15-0.19-0.20-0.38**叶绿素a<25μmChl-a<25μm/(μg/L)-0.16-0.14-0.25-0.39**叶绿素a>25μmChl-a>25μm/(μg/L)-0.02-0.240.16-0.11晶囊轮虫密度DensityofAsplanchna/(个/L)-0.01-0.190.25-0.03剑水蚤密度Densityofcopepoda/(个/L)-0.19-0.140.110.06无节幼体密度Densityofnauplius/(个/L)-0.11-0.15-0.06-0.17枝角类密度Densityofcladocerans/(个/L)-0.15-0.150.180.01
*P<0.05; **P<0.01
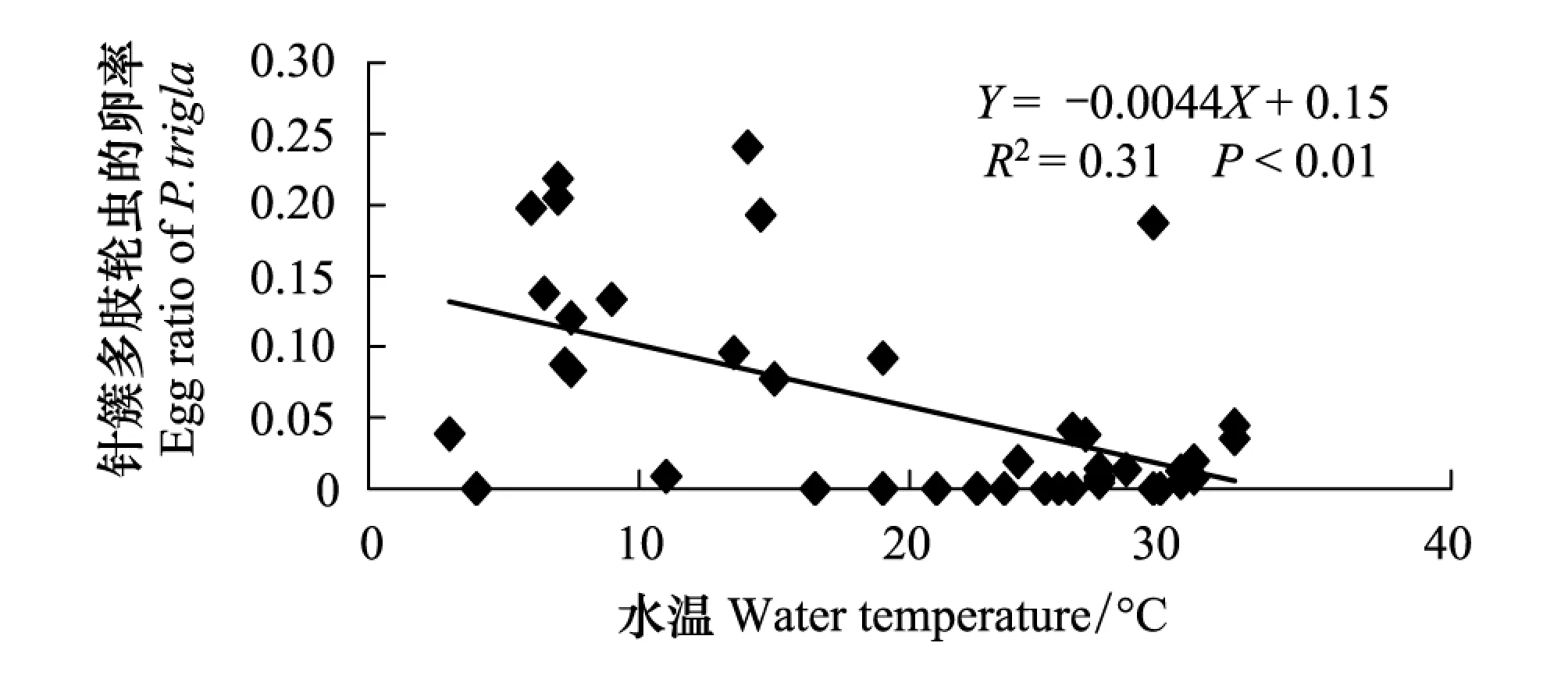
图6 汀棠湖中针簇多肢轮虫的卵率与水温间的关系 Fig.6 Regression relationship between the egg ratio of P. trigla and water temperature
3 讨论
3.1 汀棠湖中轮虫主要食性功能群及其优势种群周年动态的影响因素
枝角类与轮虫间的竞争、轮虫的捕食者(桡足类和肉食性晶囊轮虫等)对猎物轮虫的捕食作用在很大程度上影响着轮虫群落的多样性及种群动态[18]。在自然水体中,食物生态位相近的浮游动物种群密度间呈现显著的负相关性,则意味着它们之间存在强烈的竞争[1]。本研究中,汀棠湖中的枝角类密度均较低,且与各轮虫食性功能群的密度间也未呈现显著的负相关性,说明枝角类对两湖泊中轮虫种群密度的影响很小。而且,食物生态位存在重叠的轮虫优势种群密度与掠食性轮虫总密度间均不存在负相关性,这也说明这些轮虫之间不存在强烈的竞争关系。上述结果说明,种间竞争对于汀棠湖轮虫食性功能群及优势种群密度的季节变动的影响很小。
汀棠湖中的第一密度轮虫优势种为掠食性的针簇多肢轮虫。除此之外,轮虫优势种则还包括滤食性的裂足臂尾轮虫、裂痕龟纹轮虫和长三肢轮虫。针簇多肢轮虫和长三肢轮虫均具有的较长的身体附属结构可以有效抵御捕食者的猎杀[10,19];裂痕龟纹轮虫具备较小的体型和快速的游泳速度亦可有效降低捕食压力[10,20]。因此,这些轮虫所具备的形态特征、行为特征或者生活史特征削弱了捕食因素的影响,从而使它们成为水体中的优势轮虫。除此之外,上述这些优势轮虫的密度均没有同轮虫的潜在捕食者密度间呈现显著的负相关关系,暗示了捕食压力对两湖泊中优势轮虫种群密度动态的影响也不大。
除了竞争和捕食压力外,诸如水体pH值、溶解氧含量、水体透明度、氮磷浓度等这些水体理化因子在轮虫群落和种群变动的研究中也较受关注。浅水湖泊中的溶氧也被认为不大可能是影响轮生存和繁殖等的限制因子[21],汀棠湖是浅水湖泊,且其水体pH值呈弱碱性且季节间变化小[12],再加上本研究中的水体pH值和溶氧对汀棠湖水环境季节变动的贡献率均很低,故它们没有采纳到具体分析中。就水体氮磷浓度而言,其在浮游动物群落结构空间变动的研究中较受关注[12,22]。氮磷浓度一般首先影响浮游植物的种类组成和群落演替[23-24],继而间接影响浮游动物的存活等生活史特征。本研究中已经就浮游植物的结构组成通过对分级过滤后的水样中的叶绿素a含量的测定而加以间接反映,且在主成分分析中也发现氮磷含量对汀棠湖水环境变化的贡献率很低,因此它们并未在本研究的具体分析中予以采用。
水温不仅是影响轮虫种类发生和季节演替的一个关键性理化因子[21],也与水体中轮虫密度的变化息息相关[25- 27]。本研究发现,水温分别与汀棠湖中滤食性轮虫的总密度及其3种优势轮虫(裂足臂尾轮虫、裂痕龟纹轮虫和长三肢轮虫)的种群密度间呈现显著或极显著的正相关关系。这说明水温是影响汀堂湖中滤食性轮虫及其优势种群密度变动的重要的生态因子。
食物资源也是影响轮虫密度变动的重要生态因子[28]。水体叶绿素a含量可用来间接反映水体中藻类及其伴生的其他可供轮虫摄取的食物资源的多寡[29]。本研究中,汀棠湖水体中的滤食性轮虫的总密度与水体中藻类叶绿素a总含量(以Chl-a为指标)和小型藻类的叶绿素a含量(Chl-a<25 μm)间均分别呈现显著的正相关关系,说明食物资源是影响以小型藻类为食物资源的滤食性轮虫总密度动态的另一重要因子。
尽管水温和食物资源对汀棠湖水体中滤食性轮虫密度动态的影响均较大,但本研究的分析发现仅水温是影响滤食性轮虫总密度动态的最主要因子。由于出现在汀棠湖中的滤食性轮虫的3个优势种群偏向于出现于暖水中[30],在水温较低的季节,其密度较低,因而相比食物资源而言,水温在调控滤食性轮虫总密度动态方面具有更重要的意义。
本研究发现,掠食性的针簇多肢轮虫与水温、藻类叶绿素a总含量(Chl-a)及较大型藻类叶绿素a总含量(Chl-a >25 μm)间均呈现极显著的正相关性,并且其密度动态受藻类叶绿素a总含量的影响最大。本研究中关于掠食性轮虫密度动态影响因素可从两个角度得到较好的解释。其一,由于多肢轮虫偏好以较大型藻类为食物,因而与滤食性轮虫相比,掠食性多肢轮虫与小型藻类的叶绿素a含量(Chl-a<25 μm)的关系并不明显,而与较大型藻类叶绿素a总含量(Chl-a >25 μm)间呈现极显著的正相关性;其二,鉴于多肢轮虫可耐受的温度幅较广[30],且其不仅偏好以较大型藻类为食物,也可以小型藻类作为辅助食物资源[3],因而相比水温而言,食物资源(以藻类叶绿素a总含量为指标)对其密度动态的影响更大。
然而,在汀棠湖的优势轮虫种群中,只有裂痕龟纹轮虫的种群密度与粒径大小不同的藻类叶绿素a 含量(Chl-a、Chl-a<25 μm和Chl-a >25 μm)间均未呈现显著的关系,而仅与水温间呈现显著的正相关性。值得关注的是,关于裂痕龟纹轮虫与叶绿素a 含量间没有显著的关系的结果并不是个例[31]。一般认为,裂痕龟纹轮虫偏好以自然界中的腐殖质或者细菌作为食物[7],而非以藻类作为首选食物,从而可能导致了汀棠湖水体中裂痕龟纹轮虫的种群密度仅受水温的影响较大,而与藻类生物量间的关系反而并不密切。
3.2 汀棠湖中轮虫密度优势种群卵率的变动和影响因素
轮虫的卵率可以用来反映其潜在的繁殖能力。相对实验种群,轮虫的野外种群的卵率更接近其实际的繁殖力[32]。由于吮吸性的异尾轮虫通常是将其卵产到其他类型浮游生物的体上,自身很少携带产出的卵[32],而且它们的平均密度在汀棠湖中很低,故在本研究中未探讨其卵率的变动。
本研究显示,掠食性的针簇多肢轮虫的卵率、滤食性的裂足臂尾轮虫和长三肢轮虫的卵率均与水温间呈现显著的负相关性,且它们的较高密度出现在水温高的夏季。研究发现,轮虫的各主要发育阶段历时均随着温度的升高而缩短[33]。那么,在汀棠湖水温较高的季节中,这些轮虫所产出的卵的发育速度加快,从而降低了它们的卵率,但提高了其种群密度。汀棠湖中的掠食性针簇多肢轮虫的卵率除了与水温间存在着显著的负相关性外,也与水体叶绿素a含量存在极显著的负相关关系。类似的研究同样也发现了这个现象[34]。
竞争和捕食是影响池塘和湖泊中浮游动物卵率的重要因素[35]。由于桡足类和肉食性的晶囊轮虫选择性地捕食带卵轮虫,因而会造成轮虫的卵率和其捕食者密度之间有时会呈现显著的负相关关系[36]。但在本研究中,由于湖泊中的这些密度优势轮虫具备了反捕食的形态、行为或者生活史对策,从而降低了其种群密度和卵率受捕食因素的影响程度,致使两湖泊中的密度优势轮虫的卵率与其潜在的捕食者密度间均未呈现出显著的负相关关系。
3.3 富营养化程度不同的湖泊中调控两类轮虫食性功能群密度动态的影响因素的探讨
湖泊富营养化是现阶段我国长江中下游地区湖泊面临的重大环境问题。研究发现,随着湖泊富营养化程度的加剧,水体中的浮游轮虫存在着小型化的趋势[20],浮游藻类除了多样性呈现下降的趋势,而且小型细胞的浮游藻类可能成为优势群体[37],且重度富营养化的水体中藻类的生长潜力也较高[38]。由于小型轮虫中的多数类型可以归类为滤食性轮虫,因此随着湖泊营养水平的上升,滤食性轮虫的相对比例增加。基于小型的滤食性轮虫往往具备较为理想的反捕食策略[11,20],因而捕食压力对其密度动态的影响可能并不大。伴随着湖泊富营养化程度的上升,小型藻类所占比例和藻类的生长潜力可能均在增加[37-38],食物资源很可能会满足这些小型滤食性轮虫数量增长的需求。考虑到滤食性轮虫中很多种类偏向出现在温度较高的水体中,温度较高,其整体发生频率越高,卵的发育速度加快,使其种群密度增加,反之则其密度下降。综合考虑,我们推测即使在营养水平比本研究中的汀棠湖还要高的水体中,水温很可能还是调控滤食性轮虫密度动态最重要的生态因子。
但是,在与汀塘湖营养水平不同的水体中,掠食性轮虫的密度动态是否受藻类总体生物量的影响最大却值得推敲。在本研究中,掠食性轮虫主要是针簇多肢轮虫,但这种食性功能群的轮虫种类中还包括疣毛轮虫等。由于疣毛轮虫并不具备坚硬的背甲而常常容易被捕食[19],因此如果水体中疣毛轮虫等易被捕食的掠食性轮虫比例较高时,捕食压力很可能是影响其密度动态的重要的生态因子。
[1] Yoshida T. Toward the understanding of complex population dynamics: planktonic community as a model system. Ecological Research, 2005, 20(5): 511- 518.
[2] Pourriot R. Food and feeding habits of rotifera. Archiv für Hydrobiologie, Beiheft Ergebnisse der Limnologie, 1977, 8: 243- 260.
[4] Virro T, Haberman J, Haldna M, Blank K. Diversity and structure of the winter rotifer assemblage in a shallow eutrophic northern temperate Lake Võrtsjärv. Aquatic Ecology, 2009, 43(3): 755- 764.
[5] 王家楫. 中国淡水轮虫志. 北京: 科学出版社, 1961.
[6] Stemberger R S, Gilbert J J. Body size, food concentration, and population growth in planktonic rotifers. Ecology, 1985, 66(4): 1151- 1159.
[7] Stelzer C P. Population growth in planktonic rotifers. Does temperature shift the competitive advantage for different species? Hydrobiologia, 1998, 387- 388: 349- 353.
[8] de Bernardi R, Giussani G, Manca M. Cladocera: predators and prey. Hydrobiologia, 1987, 145(1): 225- 243.
[9] Kulikov A S, Shkut A O, Polishchuk, L V. Feeding in juvenileLeptodorakindti(Focke). Soviet Journal of Ecology, 1992, 22: 202- 205.
[10] Gilbert J J. Escape response of the rotiferPolyarthra: a high-speed cinematographic analysis. Oecologia, 1985, 66(3): 322- 331.
[11] Sarma S S S, Nandini S. Small prey size offers immunity to predation: a case study on two species ofAsplanchnaand three brachionid prey (Rotifera). Hydrobiologia, 2007, 593(1): 67- 76.
[12] 谢萍, 席贻龙, 温新利, 周俊, 李瑶, 牛翔翔, 王爱民, 王金霞. 两湖泊轮虫群落结构的时空动态对水体氮磷含量及“下行效应”的响应. 生态学报, 2015, 35(14): 4763- 4776.
[13] Koste W. Rotatoria: Die Rädertiere Mitteleuropas. Berlin: Gebrüder Borntraeger, 1978.
[14] 蒋燮治, 堵南山. 中国动物志——淡水枝角类. 北京: 科学出版社, 1979.
[15] 沈嘉瑞. 中国动物志——节肢动物门——甲壳纲——淡水桡足类. 北京: 科学出版社, 1979.
[16] Edmondson W T. Reproductive rate of planktonic rotifers as related to food and temperature in nature. Ecological Monographs, 1965, 35(1): 61- 109.
[17] Hammer Ø, Harper D A T, Ryan P D. PAST: paleontological statistics software package for education and data analysis. Palaeontologia Electronica, 2001, 4(1): 1- 9.
[18] 杨宇峰, 黄祥飞. 浮游动物生态学研究进展. 湖泊科学, 2000, 12(1): 81- 89.
[19] Brandl Z. Freshwater copepods and rotifers: predators and their prey. Hydobiologia, 2005, 546(1): 475- 489.
[20] Shao Z J, Xie P, Zhu G Y. Long-term changes of planktonic rotifers in a subtropical Chinese lake dominated by filter-feeding fishes. Freshwater Biology, 2001, 46(7): 973- 986.
[21] Herzig A. The analysis of planktonic rotifer populations: a plea for long-term investigations. Hydrobiologia, 1987, 147: 163- 180.
[22] Wen X L, Xi Y L, Qian F P, Zhang G, Xiang X L. Comparative analysis of rotifer community structure in five subtropical shallow lakes in East China: role of physical and chemical conditions. Hydrobiologia, 2011, 661(1): 303- 316.
[23] Smith V H. Low nitrogen to phosphorus ratios favor dominance by blue-green algae in lake phytoplankton. Science, 1983, 221(4611): 669- 671.
[24] 周敏. 惠州西湖浮游植物群落特征及其与氮、磷营养盐关系的研究[D]. 广州: 暨南大学, 2012.
[25] Stenseth N C, Mysterud A, Ottersen G, Hurrell J W, Chan K S, Lima M. Ecological effects of climate fluctuations. Science, 2002, 297(5585): 1292- 1296.
[26] 温新利, 席贻龙, 张雷, 陆星家. 芜湖市镜湖轮虫群落结构分析及水质的生态学评价. 水生生物学报, 2006, 30(2): 152- 158.
[27] 陈立婧, 刘樵, 彭自然, 胡忠军, 薛俊增, 王武. 阳澄湖养蟹网围内外轮虫群落结构的变化及分析. 水产学报, 2011, 35(8): 1247- 1257.
[28] 杨家新, 黄祥飞. 淡水轮虫繁殖生物学研究进展. 水产学报, 1999, 23(3): 290- 295.
[29] Auer B, Elzer U, Arndt H. Comparison of pelagic food webs in lakes along a trophic gradient and with seasonal aspects: influence of resource and predation. Journal of Plankton Research, 2004, 26(6): 697- 709.
[30] Bērzinš B, Pejler B. Rotifer occurrence in relation to temperature. Hydrobiologia, 1989, 175(3): 223- 231.
[31] Conde-Porcuna J M, Ramos-Rodríguez E, Pérez-Martínez C. Correlations between nutrient concentrations and zooplankton populations in a mesotrophic reservoir. Freshwater Biology, 2002, 47(8): 1463- 1473.
[32] Sarma S S S, Gulati R D, Nandini S. Factors affecting egg-ratio in planktonic rotifers. Hydrobiologia, 2005, 546(1): 361- 373.
[33] 席贻龙, 黄祥飞, 汪本勤, 许蕴娴. 环境因子对萼花臂尾轮虫种群动态的影响. 安徽师范大学学报: 自然科学版, 2000, 23(4): 334- 338.
[34] Devetter M, Seda J. Rotifer fecundity in relation to components of microbial food web in a eutrophic reservoir. Hydrobiologia, 2003, 504: 167- 175.
[35] Gilbert J J. Suppression of rotifer populations byDaphnia: a review of the evidence, the mechanisms, and the effects on zooplankton community structure. Limnology and Oceanography, 1988, 33(6): 1286- 1303.
[36] Conde-Porcuna J M, Declerck S. Regulation of rotifer species by invertebrate predators in a hypertrophic lake: selective predation on egg-bearing females and induction of morphological defences. Journal of Plankton Research, 1998, 20(4): 605- 618.
[37] 陈玺. 不同营养状态浅水湖泊中藻类数量和组成与磷的关系研究[D]. 北京: 中国科学院水生生物研究所, 2013.
[38] 况琪军, 夏宜琤. 武汉东湖主要湖区的藻类与营养型评价. 湖泊科学, 1995, 7(4): 351- 356.
ReponsesoftheannualdynamicsoffunctionalfeedinggroupsanddominantpopulationsofrotiferstoenvironmentalfactorsinLakeTingtang
WEN Xinli,XIE Ping,ZHOU Jun,XI Yilong*
KeyLaboratoryofBioticEnvironmentandEcologicalSafetyinAnhuiProvince;CollegeofLifeSciences,AnhuiNormalUniversity;CollaborativeInnovationCenterofRecoveryandReconstructionofDegradedEcosysteminWanjiangCityBelt,Wuhu241000,China
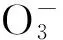
Rotifers; functional feeding groups; dominant populations; dynamics; environmental factors
国家自然科学基金(31470015);安徽省高校自然科学研究重点项目(KJ2017A320);重要生物资源的保护与利用安徽省重点实验室专项基金
2016- 10- 23; < class="emphasis_bold">网络出版日期
日期:2017- 08- 14
*通讯作者Corresponding author.E-mail: ylxi1965@126.com
10.5846/stxb201610232158
温新利,谢萍,周俊,席贻龙.汀棠湖轮虫主要食性功能群及其优势种群的周年动态对水环境变化的响应.生态学报,2017,37(23):8029- 8038.
Wen X L,Xie P,Zhou J,Xi Y L.Reponses of the annual dynamics of functional feeding groups and dominant populations of rotifers to environmental factors in Lake Tingtang.Acta Ecologica Sinica,2017,37(23):8029- 8038.
