松嫩盐单胞菌中Group 2 mrp操纵子敲除及突变株耐盐碱分析
2017-12-29姜巨全孙开福杨立娜张正来
姜巨全,孙开福,杨立娜,陈 金,张正来
松嫩盐单胞菌中Group 2 mrp操纵子敲除及突变株耐盐碱分析
姜巨全,孙开福,杨立娜,陈 金,张正来
(东北农业大学生命科学学院,哈尔滨 150030)
为分析编码多亚基钠/氢逆向转运蛋白Group 2型mrp(mrp2)操纵子耐盐碱能力,首先构建mrp2自杀质粒pK18mobsacB-mrp2-NcoI,电转化野生型菌株-松嫩盐单胞菌(Halomonassongnenensis)NEAU-ST10-39T,基于以上基因敲除原理获得mrp2敲除菌株。PCR验证及测序结果表明,成功获得mrp2敲除菌株,并将其命名为NEAU-ST10-39T-△mrp2。为进一步验证突变株正确性,构建重组穿梭载体pBBR1-MCS5-mrp2,转化敲除菌株NEAU-ST10-39T-△mrp2,获得转化子命名为NEAU-ST10-39T-△mrp2/pBBR1-MCS5-mrp2。耐盐碱测试显示,NEAU-ST10-39T-△mrp2/pBBR1-MCS5-mrp2表现出与野生型菌株类似耐盐碱能力,进一步证实敲除菌株NEAUST10-39T-△mrp2构建正确;随NaCl浓度和pH升高,敲除菌株NEAU-ST10-39T-△mrp2生长受到抑制,表明mrp2对宿主菌NEAU-ST10-39T在高盐碱条件下生长具有重要作用。电转化方法可避免pK18mobsacB在三亲本接合过程中受体菌抗性筛选、突变株纯化弊端,简化质粒导入宿主程序;NEAU-ST10-39T-△mrp2成功构建为敲除盐单胞菌中其他耐盐碱基因和揭示该基因耐盐碱机制奠定基础。
松嫩盐单胞菌;Group 2型Mrp;基因敲除;耐盐碱
中度嗜盐菌(Moderate halophile)是在3%~15%NaCl条件下最适合生长微生物类群[1]。中度嗜盐菌因其丰富耐盐碱基因种类及复杂耐盐碱机制,作为研究耐盐碱分子机制重要对象备受关注[2-3],在医疗环境改造、生物环保、污水处理等方面应用广泛[4-6]。Mrp系统是广泛存在于包括中度嗜盐菌在内原核生物中一类单价阳离子/氢离子多亚基逆向转运蛋白,其在维持胞内Na+,K+和Li+等阳离子及pH平衡等方面起关键作用[7-8]。根据编码基因数量差异,Mrp系统主要分两大类:①Group 1型Mrp由7个基因(mrpABCDEFG)编码,其中mrpA仅含1个mrpB结构域,该类Mrp系统主要分布于金黄色葡萄球菌[9]、芽胞杆菌[10-12]和盐单胞菌[13-14];②Group 2型Mrp由6个基因(mrpA′CDEFG)编码,与Group 1型Mrp主要差异是mrpA′除含mrpA结构域外,还含2个mrpB结构域,该类型Mrp系统主要分布于苜蓿中华根瘤菌[15]和霍乱弧菌[16]。
松嫩盐单胞菌(Halomonassongnenensis)NEAUST10-39T是可在16%NaCl及pH 8碱性环境中生长的中度嗜盐菌[17]。从该菌中克隆出的mrp2是Group 2型Mrp系统操纵子,在异源宿主大肠杆菌(Esche⁃richia coli)中表现高效耐盐碱能力。为进一步探究mrp2在宿主菌中生理功能,本研究构建mrp2敲除菌株并分析其耐盐碱能力,结果显示mrp2对宿主菌NEAU-ST10-39T在高盐碱条件中生长具有重要作用。本研究首次应用电转化方法,可避免pK18mob⁃sacB在三亲本接合过程中受体菌抗性筛选、突变株纯化弊端,简化质粒导入宿主程序;同时为敲除盐单胞菌中其他耐盐碱基因和深入揭示其耐盐碱机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种、质粒和引物
主要菌株、质粒及引物如表1所示。
1.1.2 主要仪器及试剂
高速离心机购自Thermo Scientific公司,超低温冰箱购自Thermo Scientific公司,培养箱购自上海志成生物公司,水浴锅购自北京市永光明医疗仪器厂,电泳仪购自北京六一生物科技有限公司,凝胶成像仪购自美国SIM公司,pH计购自METTLER TOLEDO公司,高压灭菌锅购自上海申安医疗器械厂,电转仪购自Eppendorf公司,PCR仪购自Eppendorf公司,紫外-可见光分光光度计购自天津市普瑞斯仪器有限公司。
1.1.3 主要试剂
氨苄青霉素、卡那霉素、庆大霉素购自美国AMRESCO公司;核酸和蛋白Marker、Taq DNA聚合酶、dNTPs均购自天根生物技术有限公司;琼脂糖凝胶DNA胶回收试剂盒购自Omega公司;Eco RI(15 U·μL-1)、SalⅠ(15 U·μL-1)、NcoⅠ(15 U·μL-1)等限制性内切酶均购自Takara生物公司。
1.1.4 培养基与培养条件
HLB培养基(1 L):胰蛋白胨10 g,酵母浸出物5 g,制备固体平板时加入1.5%琼脂;NaCl浓度按试验要求加入;pH调制:pH 5~6,醋酸和醋酸钠缓冲液(100 mmol·L-1);pH 7~9,BTP-H2SO4缓冲液(100 mmol·L-1);pH 10,碳酸钠和碳酸氢钠缓冲液(100 mmol·L-1);松嫩盐单胞菌(H.songnen⁃ensis)NEAU-ST10-39T及突变株及其转化子在液体培养基中145 r·min-1、35 ℃培养24 h。
LB培养基(1 L):胰蛋白胨10 g,酵母粉5 g,NaCl 10 g,pH 7。大肠杆菌(E.coli)DH5α转化子在含50μg·mL-1氨苄青霉素LBK平板上37℃培养,在LBK液体培养基中160 r·min-1、37℃培养24 h。
LBK培养基(1 L):胰蛋白胨10 g,酵母粉5 g,KCl 6.48 g,pH 7,部分试验中添加NaCl至所需浓度或用BTP-H2SO4缓冲液(pH 7~8.5,100 mmol·L-1)调至所需pH;大肠杆菌(E.coli)KNabc转化子在含50μg·mL-1氨苄青霉素的LBK平板上37℃培养,在LBK液体培养基中160 r·min-1、37℃培养24 h。
1.2 方法
1.2.1 电转化感受态细胞制备
挑取NEAU-ST10-39T单菌落于5 mL含3%NaCl HLB液体培养基中,35℃,145 r·min-1振荡培养16 h;按2%接种量转接于200 mL含3%NaCl HLB液体培养基中,160 r·min-1振荡培养2~3 h,期间注意监测菌体OD600吸光度值;待OD600吸光度值达0.6~0.8后停止培养,冰浴菌液20~30 min;离心收集菌体;去除培养基后用20 mL去离子水重悬菌体,离心,洗涤菌体1次,去除残留培养基;用20 mL冰预冷10%甘油缓慢将菌体悬浮,离心后,去尽残液;重复上一步骤;用1.5 mL冰预冷10%甘油将菌体悬浮,并分装(离心参数4℃,5 000 r·min-1和10 min)。
1.2.2 敲除载体构建
提取pUC-mrp2质粒,NcoI单酶切,将酶切后4.4 kb片段,用琼脂糖凝胶DNA回收试剂盒回收后,25℃连接2 h。取适量连接体系,转化大肠杆菌(E.coli)DH5α感受态细胞。培养后挑取阳性重组子,酶切验证。
为获得含有mrp2两侧同源臂片段(截短的mr⁃pA′和截短的mrpG,即△mrp2)敲除载体,对pUC-mrp2-NcoⅠ和pK18mobsacB质粒分别作SalⅠ和Eco RⅠ双酶切,经胶回收、连接、转化大肠杆菌(E.coli)DH5α感受态细胞和培养后挑取阳性重组子,双酶切验证,用于后续研究。
1.2.3 穿梭载体pBBR1-MCS5-mrp2构建
对穿梭载体pBBR1-MCS5和pUC-mrp2质粒分别SalⅠ和Eco RⅠ双酶切,化转至大肠杆菌(E.coli)DH5α感受态细胞后,双酶切验证,得到重组质粒pBBR1-MCS5-mrp2。
1.2.4 mrp2敲除菌株构建及验证
为获得mrp2敲除菌株,通过电转化将pK18 mobsacB-mrp2-NcoI导入NEAU-ST10-39T感受态细胞,电击参数为2 500 V、5 ms;在含卡那霉素(50 μg·mL-1)和3%NaCl的HLB固体平板上筛选单交换菌株,35℃过夜培养;逐个挑取菌落分别接入不含有和含有卡那霉素(50μg·mL-1)、10%蔗糖和3%NaCl的HLB培养基对应位置,35℃过夜培养,挑取发生双交换菌落菌种保存用于后续研究。
选择mrp2操纵子两端(截短的mrp A′上游和mrpG下游)设计引物,对敲除载体pK18mobsacB-mrp2-NcoI(△mrp2正对照)、双交换菌株NEAUST10-39T-△mrp2-3、NEAU-ST10-39T-△mrp2-4、重组质粒pUC-mrp2(mrp2操纵子的正对照)和野生型菌株NEAU-ST10-39T作PCR验证,体系见表2;经初步验证正确后,送北京华大基因股份有限公司测序,验证敲除正确性。
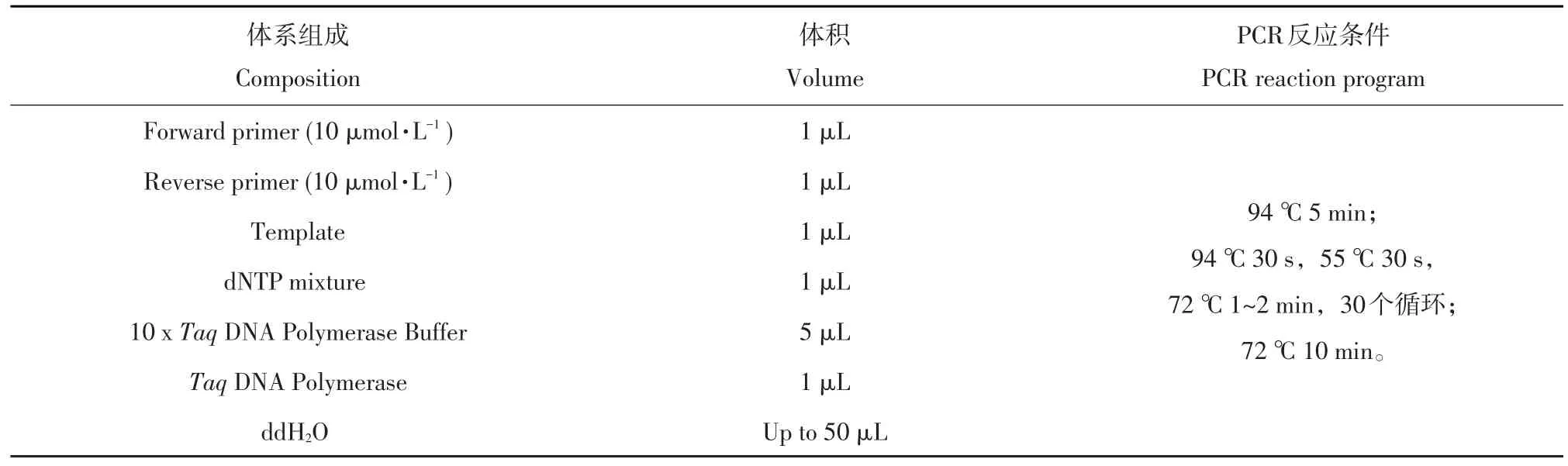
表2 验证NEAU-ST10-39T-mrp2的PCR反应体系Table 2 PCR reaction mixture of NEAU-ST10-39T-mrp2
1.2.5 mrp2敲除菌株转化子获得及验证
按上述方法,将pBBR1-MCS5-mrp2电转化敲除菌株NEAU-ST10-39T-△mrp2感受态细胞系列筛选,获得NEAU-ST10-39T-△mrp2/pBBR1-MCS5-mrp2。提取质粒,通过酶切验证其正确性。
1.2.6 耐盐碱分析
野生型菌株耐盐分析:将野生型菌株NEAUST10-39T接种于分别含有0、0.5%、1.0%、2.0%、3.0%、6.0%、9.0%、12.0%、15.0%、16.0%和20%NaCl HLB培养基(pH 7),确定野生型菌株在HLB液体培养基中耐盐范围。
敲除菌株耐盐分析:野生型菌株、NEAUST10-39T-△mrp2/pBBR1-MCS5-mrp2和基因敲除菌株NEAU-ST10-39T-△mrp2分别接种于含有2.0%、6.0%和16.0%NaCl的HLB培养基中(pH 7),检测其对NaCl耐受差异性。
敲除菌株耐碱分析:将野生型菌株、NEAUST10-39T-△mrp2/pBBR1-MCS5-mrp2和基因敲除菌株NEAU-ST10-39T-△mrp2分别接种于含2%NaCl不同pH(5~10)HLB培养基,检测其对碱性pH耐受差异性。
2 结果与分析
2.1 敲除载体pK18mobsacB-mrp2-NcoI构建
为构建mrp2操纵子敲除载体,应用DNAman 6.0分析pUC-mrp2和自杀质粒pK18mobsacB酶切位点,发现mrp2含多个Nco I酶切位点,而pUC18载体上无NcoⅠ酶切位点(图1 A);且通过SalⅠ和Eco RⅠ双酶切可将含有mrp2两侧同源臂(截短的mrpA′和mrpG,即△mrp2)构建到pK18mobsacB相同酶切位点。因此,通过使用NcoⅠ内切酶完全酶切pUC-mrp2,胶回收5 kb最大片段(含△mrp2 pUC18载体)并用T4 DNA连接酶自连(见图2 A),最终获含mrp2两侧同源臂(△mrp2)自连质粒pUC-mrp2-NcoⅠ(见图1A、图2A)。在此基础上,用SalⅠ和Eco RⅠ对pUC-mrp2-NcoⅠ和pK18mobsacB作双酶切,将pUC-mrp2-NcoⅠ酶切产物的1.8 kb小片段(△mrp2)与pK18mobsacB双酶切产物(1个5.7 kb载体片段)连接,最后获得mrp2敲除载体pK18mobsacB-mrp2-NcoⅠ(图1A、图2A)。经SalⅠ和Eco RⅠ双酶切验证,该载体构建正确(见图2A)。
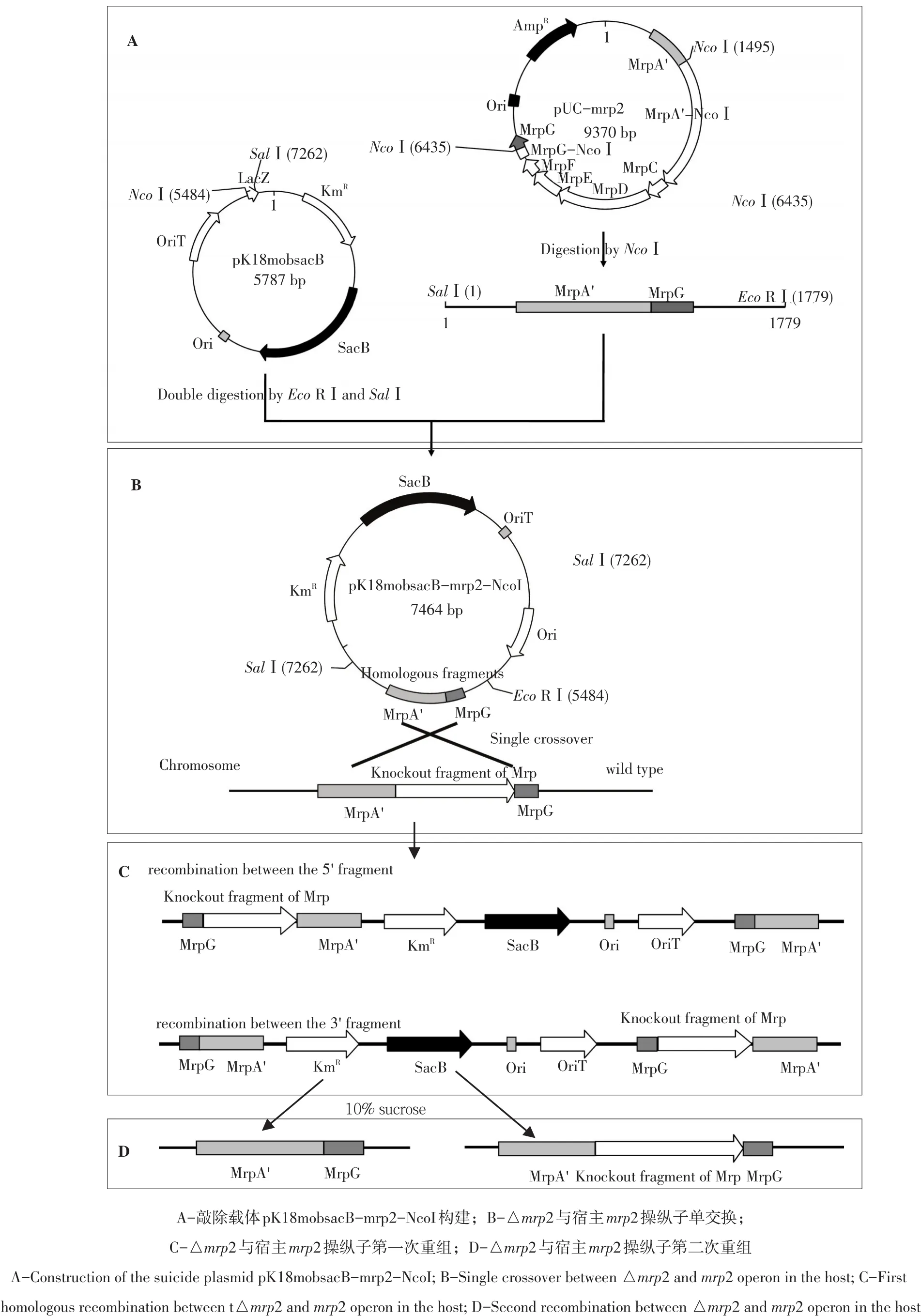
图1 松嫩盐单胞菌NEAU-ST10-39T中mrp2操纵子敲除Fig.1 Schematicsillustrating theknockout of mrp2 operon from Halomonassongnenensis NEAU-ST10-39T

图2 自杀载体p K18mobsacB-mrp2-NcoⅠ构建及其双酶切验证Fig.2 Construction of thesuicideplasmid p K18mobsacB-mrp2-NcoⅠand itsverification by doubleenzymatic digestion
2.2 穿梭载体pBBR1-MCS5-mrp2构建
分析DNAman 6.0对pUC-mrp2和穿梭质粒pB⁃BR1MCS-5酶切位点,发现可通过SalⅠ和Eco RⅠ双酶切将pUC-mrp2中带有启动子和终止子mrp2操纵子构建到穿梭质粒pBBR1-MCS5。因此,用SalⅠ和Eco RⅠ分别对pUC-mrp2和pBBR1-MCS5双酶切(见图3A),回收pUC-mrp2双酶切大片段(6.7 kb)和pBBR1-MCS5双酶切片段(4.8 kb)并用T4 DNA连接酶连接,转化连接产物至大肠杆菌(E.coli)KNabc,最后获得穿梭载体pBBR1-MCS5-mrp2(见图3A)。经SalⅠ和Eco RⅠ双酶切验证,证明该载体构建正确(见图2B)。
2.3 mrp2单交换菌株筛选
为构建mrp2的敲除菌株,首先诱导mrp2两侧同源臂片段(△mrp2)与野生型菌株同源序列单交换(原理如图1B~C)。为此,mrp2敲除载体pK18mobsacB-mrp2-NcoI通过电转化导入野生型菌株NEAU-ST10-39T感受态细胞,将转化子及未经电转化感受态细胞(负对照)均匀涂布在含卡那霉素(50 μg·mL-1)和3%NaCl的HLB固体平板上,经过35℃过夜培养,在涂布转化子平板上出现几十个扁平、光滑、不透明黄色菌落,与野生型菌株NEAU-ST10-39T菌落特征一致;对比发现,在涂布未经电转化感受态细胞平板上,无菌落出现。表明mrp2两侧同源臂片段(△mrp2)与野生型菌株同源序列发生单交换,即第1次同源重组(原理见图2C)。
2.4 mrp2双交换菌株筛选
为最终构建mrp2敲除菌株,需用10%蔗糖筛选压力胁迫单交换菌株发生双交换,促使突变株清除其基因组中自杀质粒pK18mobsacB(原理见图1D)。为此,挑取生长菌落一一对应分别接种在含有卡那霉素(50μg·mL-1)、10%蔗糖和3%NaCl的HLB固体平板上(见图4A)和含有10%蔗糖和3%NaCl的HLB固体平板上(见图4B),35℃培养24 h,发现两个菌落在图4A所示平板上不生长,在图4B所示相应位置上生长良好,表明这2个菌落为双交换菌株,按其接种顺序命名为NEAUST10-39T-△mrp2-3和NEAU-ST10-39T-△mrp2-4,挑取菌落并接种于含有3%NaCl的HLB液体培养基,培养后收集菌体保存于-80℃用于后续试验。

图3 穿梭载体p BBR1-MCS5-mrp2的构建及其双酶切验证Fig.3 Construction of the recombinant plasmid p BBR1-MCS5-mrp2 and itsverification by doubleenzymatic digestion

图4 NEAU-ST10-39T的mrp2操纵子敲除菌株筛选Fig.4 Screening of the mrp2-knockout mutantsof NEAU-ST10-39T
2.5 mrp2的敲除菌株PCR验证
为验证所获双交换菌株是否为mrp2敲除菌株,设计引物(见表1)对敲除载体pK18mobsacB-mrp2-NcoI(△mrp2正对照)、双交换菌株NEAUST10-39T-△mrp2-3、NEAU-ST10-39T-△mrp2-4、重组质粒pUC-mrp2(mrp2操纵子正对照)和野生菌NEAU-ST10-39T作PCR验证(见图5)。发现pK18 mobsacB-mrp2-Nco I(△mrp2正对照)、NEAU-ST10-39T-△mrp2-3和NEAU-ST10-39T-△mrp2-4的PCR产物均约为700 bp;pUC-mrp2(mrp2操纵子正对照)和NEAU-ST10-39TPCR产物均约为5 600 bp。为进一步验证以上2株双交换株是否为mrp2敲除菌株,最后将NEAU-ST10-39T-△mrp2-3和NEAUST10-39T-△mrp2-4的PCR产物送至北京华大基因股份有限公司测序,序列结果用DNAman 6.0作比对分析,最终确定均为mrp2敲除菌株。选取NEAU-ST10-39T-△mrp2-3命名为NEAU-ST10-39T-△mrp2,作为mrp2的敲除菌株用于后续试验。

图5 NEAU-ST10-39T的mrp2操纵子的敲除菌株的PCR验证Fig.5 Verification of the mrp2-knockout mutant of NEAU-ST10-39T by PCR
2.6 转化子NEAU-ST10-39T-mrp2/pBBR1-MCS5-mrp2构建
为进一步验证NEAU-ST10-39T-△mrp2是否为mrp2的敲除菌株,需分析mrp2操纵子是否可互补该突变株。为此,将pBBR1-MCS5-mrp2电转化导入NEAU-ST10-39T-△mrp2感受态细胞,在含有庆大霉素(50μg·mL-1)和3%NaCl的HLB固体平板上,挑取单菌落提取质粒,并经SalⅠ和Eco RⅠ双酶切验证,发现转化子构建正确,将其命名为NEAU-ST10-39T-△mrp2/pBBR1-MCS5-mrp2。
2.7 耐盐碱分析
为分析野生型菌株的耐盐能力,将野生型菌株NEAU-ST10-39T接种于分别含有不同浓度NaCl的HLB培养基(pH 7),确定野生型菌株在HLB液体培养基耐盐范围为0.5%~16%NaCl(见图6A)。在此基础上,分别分析野生型菌株、NEAU-ST10-39T-△mrp2/pBBR1-MCS5-mrp2和敲除菌株NEAU-ST10-39T-△mrp2对NaCl和碱性pH耐受差异性。发现NEAU-ST10-39T-△mrp2/pBBR1-MCS5-mrp2表现出与野生型菌株类似耐盐能力(见图6B、6C),进一步证实敲除菌株NEAU-ST10-39T-△mrp2构建正确。在pH 7,2.0%NaCl浓度条件下,敲除菌株NEAU-ST10-39T-△mrp2的生长情况与野生型菌株、NEAU-ST10-39T-△mrp2/pB⁃BR1-MCS5-mrp2生长情况无差异;6.0%和16.0%NaCl浓度时,敲除菌株NEAU-ST10-39T-△mrp2生长情况受抑制(见图6B),表明mrp2对宿主菌NEAU-ST10-39T在高盐条件下生长具有重要作用。在含有2%NaCl的HLB培养基中,pH 6、7条件下,敲除菌株NEAU-ST10-39T-△mrp2与野生型菌株NEAU-ST10-39T生长表现无差异;pH 8条件下,敲除菌株NEAU-ST10-39T-△mrp2生长受抑制(见图6C),表明mrp2对宿主菌NEAU-ST10-39T在碱性条件下生长具有重要作用。

图6 NEAU-ST10-39T的mrp2操纵子的敲除菌株耐盐碱测试Fig.6 Growth test for salt toleranceand alkalinep H resistanceof the mrp2-knockout mutant of NEAU-ST10-39T
3 讨论与结论
中度嗜盐菌基因敲除十分困难,尤其是革兰氏阳性中度嗜盐菌。目前,基因敲除成功仅限于革兰氏阴性盐单胞菌属(Halomonas),并利用三亲本接合方式导入外源基因[14],使用电转化导入方式敲除未见报道。三亲本接合转化敲除质粒方法,可避免导入双链DNA易被受体菌限制性内切酶降解风险,但所用受体菌必须具有抗生素抗性,难以实现敲除菌株与大肠杆菌分离纯化。电转化方法操作可避免操作过程中大肠杆菌污染,操作简单,工作强度小,试验周期较短。目前,一般使用S-G培养基培养嗜盐菌,利于嗜盐菌快速生长。生长在S-G培养基嗜盐菌形成细胞壁较厚,阻碍质粒等外源DNA转化[18]。因此,本研究在参照革兰氏阴性菌和盐单胞菌的电转化感受态细胞制备方法基础上[19-20],选择含3%NaCl的HLB培养基制备NEAU-ST10-39T电转化感受态细胞,成功将敲除载体pK18mobsacB-mrp2-NcoⅠ并使穿梭载体pBBR1-MCS5-mrp2导入野生型菌株。本研究将电转化方法首次应用于盐单胞菌基因敲除,对敲除盐单胞菌中其他耐盐碱基因具有重要指导意义。
松嫩盐单胞菌(Halomonas songnenensis)NEAUST10-39T是一株可在16%NaCl及pH 8碱性环境下生长中的度嗜盐菌[17]。为分析其高效耐盐碱机制,筛选耐盐碱基因,发现mrp2是一个编码Group 2型Mrp系统操纵子,其在异源宿主大肠杆菌(Esche⁃richia coli)中表现高效耐盐碱能力,与已报道的多亚基钠/氢逆向转运蛋白(Mrp系统的同源物)Sa_Mnh[9]、 Bh_Mrp[11]、 Bs_Mrp[10,12]、 Hz_Mrp[13]、Hs_Mrp[14]、Sm_Pha1[15]一致。
为进一步探究mrp2在宿主菌中生理功能,本研究构建mrp2敲除载体pK18mobsacB-mrp2-NcoI,采用电转化方法导入野生型菌株NEAUST10-39T,通过PCR验证和穿梭载体pBBR1-MCS5-mrp2互补试验,成功构建敲除菌株NEAUST10-39T-△mrp2。耐盐碱分析,发现mrp2操纵子对宿主菌NEAU-ST10-39T在高盐碱条件下生长具有重要作用。在非嗜盐菌和耐盐菌中,Mrp系统敲除显著影响其生理功能,如Bs_ Mrp[10,12]、Sm_Pha1等敲除导致耐盐碱能力显著下降,甚至丧失[15]。然而,革兰氏阴性中度嗜盐菌的盐单胞菌Y2敲除Mrp系统,使宿主在高盐碱条件下生长受到显著抑制。与本研究结果一致,因中度嗜盐菌长期处于高盐碱环境,被迫进化更多数量和类型钠/氢逆向转运蛋白应对外界极端环境变化。因此,NEAU-ST10-39T-△mrp2成功构建,为敲除盐单胞菌中其他耐盐碱基因和揭示基因耐盐碱机制奠定基础。
[1] Ventosa A,Nieto J J,Oren A.Biology of moderately halophilic aerobic bacteria[J].Microbiology and Molecular Biology Reviews,1998,62(2):504-544.
[2] 王爽,杨谦,孙磊,等.盐碱土中可培养中度嗜盐菌的研究[J].东北农业大学学报,2010,41(8):37-42.
[3] 王爽,王玉峰.嗜盐嗜碱菌株20-13的生物学特性及系统发育学分析[J].东北农业大学学报,2013,44(2):42-46.
[4] Sarvari S,Seyedjafari E,Amoozgar MA,et al.Theeffect of moder⁃ately halophilic bacteria supernatant on proliferation and apopto⁃sis of cancer cells and mesenchymal stem cells[J].Cellular and Molecular Biology,2015,61(3):30-34.
[5] Gomaa E Z.Biodegradation of polycyclic aromatic hydrocarbons by exopolymers synthesized by moderately halophilic bacteria:Chemical composition and functional properties[J].Journal of Polymers and the Environment,2013,21(2):495-503.
[6] Bajpai P.Microbial degradation of pollutants in pulp mill effluents[J].Advancesin Appllied Microbiology,2001,48:79-134.
[7] Swartz TH,Ikewada S,Ishikawa O,et al.The Mrp system:A giant among monovalent cation/proton antiporters?[J].Extremophiles,2005,9(5):345-354.
[8] Krulwich TA,Hicks D B,Ito M.Cation/proton antiporter comple⁃ments of bacteria:Why so large and diverse?[J].Molecular Micro⁃biology,2009,74(2):257-260.
[9] Swartz TH,Ito M,Ohira T,et al.Catalytic propertiesof Staphylo⁃coccus aureus and Bacillus members of the secondary cation/pro⁃ton antiporter-3(Mrp)family are revealed by an optimized assay in an Escherichia coli host[J].Journal of Bacteriology,2007,189(8):3081-3090.
[10] Ito M,Guffanti A A,Oudega B,Krulwich TA.mrp,a multigene,multifunctional locus in Bacillus subtilis with roles in resistance to cholate and to Na+and in pH homeostasis[J].Journal of Bacteriology,1999,181(8):2394-2402.
[11] Hamamoto T,Hashimoto M,Hino M,et al.Characterization of a gene responsible for the Na+/H+antiporter system of alkalophilic Bacillus species strain C-125[J].Molecular Microbiology,1994,14(5):939-946.
[12] Kajiyama Y,Otagiri M,Sekiguchi J,et al.Complex formation by the mrpABCDEFG gene products,which constitute a principal Na+/H+antiporter in Bacillus subtilis[J].Journal of Bacteriology,2007,189(20):7511-7514.
[13] Meng L,Hong S,Liu H,et al.Cloning and identification of Group 1 mrp operon encoding a novel monovalent cation/proton antiport⁃er system from the moderate halophile Halomonas zhaodongensis[J].Extremophiles,2014,18(6):963-972.
[14] Cheng B,Meng Y,Cui Y,et al.Alkaline response of a halotoler⁃ant alkaliphilic Halomonas strain and functional diversity of its Na+(K+)/H+antiporters[J].Journal of Biological Chemistry,2016,291(50):26056-26065.
[15] Putnoky P,Kereszt A,Nakamura T,et al.The pha gene cluster of Rhizobium meliloti involved in pH adaptation and symbiosis en⁃codes a novel type of K+efflux system[J].Molecular Microbiology,1998,28(6):1091-1101.
[16] Jiang J,Pan Y,Hu S,et al.Halomonas songnenensis sp.nov.,a moderately halophilic bacterium isolated from saline and alkaline soils[J].International Journal of Systematic and Evolutionary Mi⁃crobiology,2014,64:1662-1669.
[17] Jiang J,Pan Y,Meng L,et al.Halomonas zhaodongensis sp.nov.,a slightly halophilic bacterium isolated from saline-alkaline soils in Zhaodong,China[J].Antonie Van Leeuwenhoek,2013,104(5):685-694.
[18] Dzioba-Winogrodzki J,Winogrodzki O,Krulwich T A,et al.The Vibrio cholerae Mrp system:Cation/proton antiport properties and enhancement of bile salt resistance in a heterologous host[J].Jour⁃nal of Molecular Microbiology and Biotechnology,2008,16(3-4):176-186.
[19]Harris J R,Lundgren B R,Grzeskowiak B R,et al.A rapid and efficient electroporation method for transformation of Halomonas sp.0-1[J].Journal of Microbiological Methods,2016,129:127-132.
[20] 徐蕊,张苓花.四氢嘧啶吸收缺陷突变株高效制备四氢嘧啶[J].微生物学报,2012,55(5):661-667.
Construction of Group 2-mrp-knockout mutant of Halomonas songne⁃nensis and analysis on its halo-alkaline-tolerant capacity
/JIANG uquan,SUN Kaifu,YANG Lina,CHEN Jin,ZHANG Zhenglai
(School of Life Science,Northeast Agricultural University,Harbin 150030,China)
In order to analyze of the halo-alkaline-tolerant capacity of mrp2 operon encoding a Group 2 multi-subunit Na+/H+antiporter in the host Halomonas songnenensis NEAU-ST10-39T,the suicide plasmid of mrp2,p K18mobsac B-mrp2-NcoI,was constructed and then electroporated into the wild type NEAU-ST10-39T.Finally,the mrp2-knockout mutant designated NEAU-ST10-39T-△mrp2 wasobtained by using the homologous recombination and counter-selection on the plate containing 10%sucrose.PCR verification and sequencing analysis showed that mrp2 succeeded in being knockout in the mutant NEAU-ST10-39T-△mrp2.For the confirmation of this result,mrp2 was constructed into a broad-host-range shuttle vector,p BBR1-MCS5,and the resultant construct designated p BBR1-MCS5-mrp2 was electroporated into the mutant NEAU-ST10-39T-△mrp2.The resultant transformant was designated NEAU-ST10-39T-△mrp2/p BBR1-MCS5-mrp2.Growth test for the halo-alkaline tolerance showed that the transformant NEAU-ST10-39T-△mrp2/p BBR1-MCS5-mrp2 exhibited the similar growth to the wild type strain NEAU-ST10-39T.In contrast,the growth of the mutant NEAU-ST10-39T-△mrp2 was inhibited under the highly-saline or highly alkaline conditions,revealing that mrp2 played a critical role in the halo-alkaline tolerance of the host NEAU-ST10-39T.Successful application of gene knockout through the electroporation and construction of the mutant NEAU-ST10-39T-△mrp2 will be very helpful for carrying out the knockout of other halo-alkaline tolerant genes from Halomonas genus and further analysis of the halo-alkaline tolerance of mrp2 in the host NEAU-ST10-39T.
Halomonas songnenensis;Group 2 mrp;knockout;halo-alkaline-tolerance
Q933;Q751
A
1005-9369(2017)12-0011-10
时间2017-12-18 13:40:08 [URL]http://kns.cnki.net/kcms/detail/23.1391.S.20171218.1339.006.html
姜巨全,孙开福,杨立娜,等.松嫩盐单胞菌中Group 2 mrp操纵子敲除及突变株耐盐碱分析[J].东北农业大学学报,2017,48(12):11-20.
Jiang Juquan,Sun Kaifu,Yang Lina,et al.Construction of Group 2-mrp-knockout mutant of Halomonas songnenensis and analysis on its halo-alkaline-tolerant capacity[J].Journal of Northeast Agricultural University,2017,48(12):11-20.(in Chinese with English abstract)
2017-05-05
国家自然科学基金项目(31570045);黑龙江省自然科学基金项目(C201417);博士后科研启动资金(LBH-Q14022)
姜巨全(1977-),男,教授,博士,博士生导师,研究方向主要为分子微生物学与生物制药。E-mail:jjqdainty@163.com.
