产高分子量木聚糖酶细菌的筛选及产酶条件优化
2017-12-26王中月滕超汤回花李秀婷
王中月,滕超,汤回花,李秀婷
1(北京工商大学,食品质量与安全北京实验室,北京,100048)2(北京工商大学,北京市食品添加剂工程技术研究中心,北京,100048)
产高分子量木聚糖酶细菌的筛选及产酶条件优化
王中月,滕超,汤回花,李秀婷*
1(北京工商大学,食品质量与安全北京实验室,北京,100048)2(北京工商大学,北京市食品添加剂工程技术研究中心,北京,100048)
通过透明圈法从土壤中筛选出55株产木聚糖酶的细菌菌株,经产酶发酵培养基复筛及SDS-PAGE酶谱分析得到1株产高分子量木聚糖酶细菌菌株Paenibacillussp. 39631。在单因素实验的基础上,运用响应面分析,对影响产酶发酵的各因素进行优化,得到的最佳产酶发酵条件:碳源(80目玉米芯粉)0.8%,氮源(牛肉膏)1%,初始值pH7.2,培养温度30 ℃,转速158 r/min,接种量2%,装液量50 mL。在最佳培养条件下,经72 h液态发酵,酶活力达到44.12 U/mL,比优化前提高了4.36倍。
高分子量木聚糖酶;细菌菌株;液态发酵;响应面优化
木聚糖酶是一类重要的糖苷键水解酶,能够专一地将木聚糖降解为寡木聚糖、低聚木糖和木糖[1],根据对木聚糖主链作用方式的不同,分为β-1,4-外切木聚糖酶、β-1,4-内切木聚糖酶、β-木糖苷酶[2]。作为一种重要的工业应用酶制剂,木聚糖酶在食品、饲料、造纸等方面具有重要的潜在应用价值[3],如添加适量木聚糖酶到小麦面粉中,可以有效改善面团的质量,其烘烤质量得到显著提升;在制作果汁和酒时木聚糖酶可起到澄清作用[4-5];可以用来增加家畜对饲料的消化吸收率,提高青贮饲料的营养价值[6]。
微生物是木聚糖酶的重要来源,如真菌、放线菌和细菌[7],由于木聚糖酶在不同工业应用上的差异,需要从自然环境中筛选具有不同特性的木聚糖酶。根据木聚糖酶分子量的差异特性,可分为两大类,即小于30 kDa的碱性木聚糖酶和大于30 kDa的酸性木聚糖酶,通常细菌可产生这2种木聚糖酶。研究表明,分子量较大的木聚糖酶具有良好的酶学特性,如底物特异性广泛,因其具有多个底物结合位点,能够高效作用于小分子量的木寡糖;另外对低分子量纤维素底物,特别是对含有芳香族基团的低聚纤维多糖具有相当可观的活性[8]。GUPTA[9]研究发现,Staphylococcussp.SG-13可有效地降解麦麸、甘蔗蔗渣、玉米芯、杨树木材等多种农业废弃物。朱辉[10]对Paenibacilluspolymyxa的研究表明,该菌株所产高分子量木聚糖酶具有分解木聚糖和葡聚糖的能力,这和ZHANG[11]的研究结果相一致。ANTHONY[12]从造纸厂废水筛选出1株耐碱的AspergillusfumigatusAR1,该菌株可产生多个从212 kDa到253 kDa的高分子量木聚糖酶,可适应较宽广的pH范围,并具有较好的耐热性。GHIO[13]等过研究发现,Paenibacillussp.A59所产木聚糖酶在50~70 ℃具有良好的稳定性,酶解产物以木二糖为主。THIAGARAJAN[14]研究了AspergillusfumigatusMKU1所产高分子量木聚糖酶酶学性质,发现其最适温度为90 ℃。SAINZ-POLO[15]研究了分子量为120 kDa的木聚糖酶的分子机制。因此为满足工业对具有不同特性木聚糖酶的多样化需求,筛选不同特性的木聚糖酶极有必要。
本文通过透明圈法从土壤中筛选得到1株产高分子量木聚糖酶的细菌菌株,通过单因素试验及响应面分析对其产酶条件进行优化,以提高其产酶能力。
1 材料与方法
1.1 土样
土壤样品采集于山东济南千佛山山顶、北京国家森林公园、河南漯河花花牛原料间、贵州贵阳十里河滩湿地公园等地,距离地表5~15 cm处的植被土壤。
1.2 试验材料
玉米芯购自北京郊区(新鲜、无虫蛀、无霉变、干燥),用粉碎机粉碎,过80目筛,置于干燥处贮存备用;木糖、榉木木聚糖(Beechwood xylan):美国Sigma公司;玉米芯水不溶性木聚糖:实验室自制;其他试剂如无说明均为国产分析纯。
1.3 试验设备
超净工作台,AIRTECH公司;DYY-10C电泳仪,北京六一仪器厂;DYC P-31BN水平电泳槽,北京六一仪器厂;高速离心机,美国Sigma公司;Image Quant 300凝胶成像仪,美国GE公司;STIK生化培养箱,施都凯仪器设备(上海)有限公司;恒温摇床,美国精琪公司。
1.4 试验方法
1.4.1 培养基及主要试剂配制
平板初筛培养基(%):玉米芯木聚糖1.00、NH4NO30.50、MgSO40.05、NaCl 0.50、K2HPO40.20、(NH4)2SO40.10、酵母粉0.03、琼脂2.00、pH 8.0,121 ℃下灭菌20 min。
斜面保藏培养基(%):胰蛋白胨1.00、酵母提取物0.50、NaCl 0.50、琼脂1.50,pH7.4,121 ℃下灭菌20 min。
种子培养基(%):胰蛋白胨1.00、酵母提取物0.50、NaCl 0.50,pH7.4,121 ℃下灭菌20 min。
初始液体发酵培养基(%):玉米芯2.00、酵母膏2.00、K2HPO40.25、MgSO40.05、NaCl 0.50,pH 7.0,121 ℃下灭菌20 min。
10 μmol/mL的木糖母液:精确称取0.150 g木糖(Sigma),用一定pH的缓冲液溶解并定容至100 mL,即得到10 μmol/mL的木糖母液,置于4℃冰箱中保存备用。
1%木聚糖底物溶液的配制:精确称取2.0 g榉木木聚糖,用高纯水配制2%的木聚糖底物100 mL,需要时用一定pH值的缓冲液接1∶1混合成1%木聚糖底物溶液,置于4 ℃冰箱中保存备用。
1.4.2 菌株的初筛
制备菌液,即称取土样0.1 g,用900 μL无菌水稀释成10-1,混匀,吸取100 μL混合液,用900 μL无菌水稀释成10-2混匀后依次稀释成10-3、10-4混合液,均匀涂布于平板筛选培养基上,置于37 ℃培养箱中培养2~3 d,观察菌株生长状态,挑取周边能够产生透明圈的菌株划线分离进行纯化培养,斜面保存。
1.4.3 菌株的复筛
挑取入选的斜面菌种接入种子培养基,37 ℃、180 r/min培养14 h,将培养好的种子培养液按一定比例接入基础产酶培养基,装液量为250 mL三角瓶装液50 mL,180 r/min,37 ℃振荡培养72 h,培养物经4 000 r/min离心10 min取上清,即为粗酶液。
1.4.4 标准曲线制作
将配置好的木糖母液分别稀释成浓度为0.0、2.0、3.3、5.0、10.0 μmol/mL的标准糖液组,在10 mL试管中用移液枪精确加入0.1 mL标准糖液、0.9 mL木聚糖底物和1 mL DNS试剂(用前加入无水亚硫酸钠,每100 mL加0.05 g),在沸水中煮沸15 min,煮沸完毕加入1 mL 40%酒石酸钾钠护色,凉水冷却,充分摇匀后,在540 nm下测吸光值A。以木糖含量为纵坐标,A为横坐标,绘制标准曲线,求出回归方程。
1.4.5 木聚糖酶酶活力的测定方法
木聚糖酶活力的测定参照DNS法[16]:0.1 mL适当稀释的酶液,加入到0.9 mL用0.05 mol/L、pH5.5乙酸缓冲液配制的10 g/L榉木木聚糖底物溶液中,55 ℃反应5 min,加入1 mL DNS试剂终止反应,后续处理参照1.4.4。利用木糖标准曲线测生成还原糖(以木糖计)的量。木聚糖酶活力单位定义为:在上述条件下,每分钟生成1μmol木糖所需要的酶量(U)。
1.4.6 SDS-PAGE酶谱分析[17]
对粗酶液进行酶谱分析:在12.5%的聚丙烯酰胺凝胶中加入0.5%的榉木木聚糖制备底物胶,在冰浴中进行常规蛋白电泳(浓缩胶80 V恒压,分离胶100 V恒压)。电泳结束后,先用25%异丙醇洗涤凝胶4次使酶蛋白复性,每次15 min;然后用0.05 mol/L、pH7.0 Tris-HCl缓冲液洗涤凝胶4次,每次18 min,洗涤完毕在55 ℃条件下保温1 h;凝胶用0.5%的刚果红染液染色15 min,最后用1 mol/L NaCl溶液脱色直至出现透明条带,用0.5%的醋酸溶液进行护色。
1.4.7 产木聚糖酶发酵条件优化
(1)营养条件对产木聚糖酶活性的影响
在初始液态发酵培养基的基础上,分别改变碳源和氮源的种类,初始含量均为20 g/L,摇瓶培养72 h,测定酶活,确定最佳碳源和氮源,然后改变碳源和氮源的浓度,进行碳源、氮源浓度的产酶发酵优化,所有试验重复3次。
(2)培养条件对木聚糖酶活性的影响
确定最佳碳源和氮源后,考察初始pH值、发酵温度、转速、接种量、装液量5个因素对产酶发酵的影响,分别测定各单因素条件下的酶活性,确定各因素适宜的范围,所有试验重复3次。
(3)Box-Behenken响应面分析法试验设计
在单因素试验基础上,运用DPS软件设计响应面实验。根据Box-Behenken试验设计原理,以木聚糖酶酶活为响应值,选取对发酵影响最为显著的pH值、转速、碳源浓度3个因素,设计因素3水平响应面分析实验,并对数据进行回归分析及显著性检验,以确定产酶发酵的最佳组合,每个试验点重复3次,取试验结果的平均值,其中各自变量的因素水平编码见表1。

表1 因素水平编码表Table 1 Factorsand levels of response surface experiment
2 结果与分析
2.1 产木聚糖酶细菌的筛选
土壤是重要的微生物获取途径,存在丰富多样的微生物,通过透明圈法从土壤中进行产木聚糖酶细菌的平板筛选,共获得目的菌株55株,通过产酶发酵得到粗酶液,测定酶活,产酶情况见表2。

表2 土样中木聚糖酶产生菌的分离情况Table 2 Screening of xylanase produced strains
粗酶液经SDS-PAGE电泳酶谱分析,得到细菌菌株产木聚糖酶分子量情况,经酶谱分析,菌株 39631所产木聚糖酶可以产生4条木聚糖酶透明条带,如图1所示,且分子量均在60 kDa以上,这在目前文献的报道中是比较少见的,具有良好的理论研究价值,作为目标菌株进行后续研究。经鉴定 39631为类芽孢杆菌属,命名为Paenibacillussp. 39631,可在初筛平板上产生明显透明圈,如图2所示。

M-高分子量标准蛋白;1-粗酶液图1 Paenibacillus sp. 39631SDS-PAGE酶谱分析Fig.1 SDS-PAGE andzymogram of xylanase samples

图2 Paenibacillus sp. 39631的透明圈Fig.2 Transparent zone of Paenibacillus sp. 39631(注:培养基为初筛平板;培养时间48 h)
2.2 单因素实验设计与分析
2.2.1 碳源对Paenibacillussp. 39631产酶的影响
木聚糖酶属于诱导性酶,不同碳源对发酵产酶均有影响。实验选取玉米芯、玉米秸秆、麸皮、玉米芯木聚糖、玉米秸秆木聚糖、麸皮木聚糖为碳源底物进行产酶发酵,结果如图3所示。可以看出在发酵培养基中以玉米秸秆木聚糖、麸皮木聚糖为碳源时酶活相对较低,在5 U/mL左右;以玉米芯、玉米芯木聚糖为底物时,酶活分别为10.96 U/mL、11.84 U/mL,酶活相对较高且相差不大。考虑到成本问题,选择玉米芯为发酵培养基的基础碳源。

a-玉米芯;b-麸皮玉米;c-秸秆;d-玉米芯木聚糖;e-玉米秸秆木聚糖;f-麸皮木聚糖图3 碳源种类对Paenibacillus sp. 39631液态发酵产酶的影响Fig.3 The effect of different carbon source on Paenibacillus sp. 39631 xylanase production
在确定最适碳源后,考察碳源质量浓度对木聚糖酶酶活的影响,实验选取 10、20、30、40、50 g/L 5个梯度进行试验,结果如图4所示。由图4可知,随着玉米芯粉添加量的增加,木聚糖酶酶活呈逐渐下降的趋势,可知在单因素改变的条件下,10 g/L的玉米芯粉添加量为最适质量浓度。

图4 玉米芯质量浓度对菌株Paenibacillus sp. 39631液态发酵产酶的影响Fig.4 Effect of corncob concentration on xylanase production by Paenibacillus sp. 39631
2.2.2 氮源对Paenibacillussp. 39631产酶的影响
在产酶基础培养基中,以10%的70目玉米芯粉为培养基的碳源,添加20 g/L的不同氮源进行产酶发酵,实验结果如图5所示。

a-安琪酵母浸粉;b-酵母膏;c-胰蛋白胨;d-大豆蛋白胨;e-牛肉膏;f-硝酸铵;g-硝酸钠;h-磷酸氢二氨;i-尿素图5 不同氮源对Paenibacillus sp. 39631液态发酵产酶的影响Fig.5 Effect of nitrogen sources on xylanase production by Paenibacillus sp. 39631
由图5可知,牛肉膏作为氮源时,酶活最高达到12.43 U/mL,酵母膏、大豆蛋白胨次之,总体来说有机氮源优于无机氮源,因为有机氮成分复杂,能够为微生物的生长提供更加丰富的营养物质[18],最终选取牛肉膏作为后续产酶发酵的基础氮源。
在确定最适氮源后,考察氮源质量浓度对木聚糖酶活的影响,实验选取5、10、15、20、25、30、35、40 g/L 八个梯度进行试验,结果如图6所示。随着氮源质量浓度的增加,木聚糖酶活呈先上升后逐渐下降的趋势,在10 g/L时酶活最高达到16.68 U/mL,由此可知在单因素改变的条件下,10 g/L的氮源添加量为最适质量浓度。

图6 氮源质量浓度对Paenibacillus sp. 39631液态发酵产酶的影响Fig.6 Effect of nitrogen sources concentration on xylanase production by Paenibacillus sp. 39631
2.2.3 初始pH对菌株Paenibacillussp. 39631产酶的影响
在最优培养基的基础上,分别设置4.0、5.0、6.0、7.0、8.0、9.0、10.0共7个pH梯度考察其对液体发酵产酶的影响。在恒温震荡箱中培养72h后,取发酵液进行酶活测定,共测3组,取平均值,结果见图7。

图7 发酵液初始pH值对Paenibacillus sp. 39631产酶的影响Fig.7 Effect of fermentation liquor pH value on xylanase production by Paenibacillus sp. 39631
由图7可知,在pH4.0~10.0的范围内木聚糖酶活性呈先增大后下降的趋势,在pH7.0的中性条件下酶活力最高,达到19.11 U/mL,而在酸性或碱性较强的条件下酶活较低,这主要是因为发酵液的初始pH影响菌株对营养物质的利用效率,通过改变细胞膜的通透性达到影响代谢产物的形成和分泌[19],而较强的酸性或碱性pH条件下菌体的生长状况不好,进而导致产酶降低。故选择pH7.0为最佳初始pH。
2.2.4 发酵温度对菌株Paenibacillussp. 39631产酶的影响
在以上最优培养基的基础上,分别设置20、25、30、35、40、45 ℃共6个温度梯度考察其对液体发酵产木聚糖酶活性的影响,结果见图8。

图8 发酵温度对Paenibacillus sp. 39631液态发酵产酶的影响Fig.8 Effect of temperature on xylanase production by Paenibacillus sp. 39631
由图8可知,产酶发酵培养最适反应温度范围为25~30 ℃,其中30 ℃最有利于该菌株产酶发酵,此时产酶能力最强,而温度过低或过高的条件均不利于产酶发酵。这是因为过低的温度造成菌体生长缓慢,从而影响菌体产酶的速度;温度过高,菌体虽然生长旺盛,但是培养基中的营养物质被过多的用于菌体自身生长繁殖,产酶速率则会相对降低[20]。因此,对菌株Paenibacillussp. 39631而言,最适宜的发酵温度为30 ℃。
2.2.5 接种量对Paenibacillussp. 39631产酶的影响
由图9可知,在接种量为2%时,Paenibacillussp. 39631产木聚糖酶活力最高,接种量大于2%后,酶活开始降低。接种量较大时,酶活降低的原因可能是菌体生长过快导致发酵液的黏度增加,在供氧量不变的情况下,会造成溶氧不足而影响到木聚糖酶的生成[21],所以选择2%为最适接种量。

图9 接种量对Paenibacillus sp. 39631液态发酵产酶的影响Fig.9 Effect of inoculum dosage on xylanase production by Paenibacillus sp. 39631
2.2.6 转速对Paenibacillussp. 39631产酶的影响
由图10可知,摇床转速对菌株Paenibacillussp. 39631的产酶活力影响比较明显。当摇床转速为90 r/min时,产酶活力最低,仅有9.0 U/mL,在摇床转速为150 r/min时具有最高酶活24.66 U/mL。故将产酶发酵最佳转速设定为150 r/min。
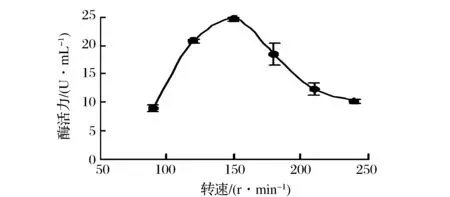
图10 摇床转速对Paenibacillus sp. 39631液态发酵产酶的影响Fig.10 Effect of rotating speed on xylanase production by Paenibacillus sp. 39631
2.2.7 装液量对Paenibacillussp. 39631产酶的影响
在以上条件优化的基础上,考察装液量对发酵产酶的影响,发酵液中溶氧量与氧气的传递效率和摇瓶装液量直接相关,进而影响发酵液中菌体对营养物质的利用速率,从而影响木聚糖酶的生产效率[22]。Paenibacillussp. 39631为需氧微生物,所以装液量的大小直接影响着它的生长和木聚糖酶的产生,由图11可知,在250 mL锥形瓶中加入20~80 mL的液体发酵培养基,木聚糖酶活力呈现先增大后减小的趋势,在装液量为50 mL时产木聚糖酶活力为最高,达到36.12 U/mL。故选取50 mL为最适装液量。

图11 装液量对Paenibacillus sp. 39631液态发酵产酶的影响Fig.11 Effect of liquid volume on xylanase production by Paenibacillus sp. 39631
2.3 响应面实验设计与结果分析
利用统计软件DPS进行实验设计,根据表3的实验结果进行响应面回归分析,以木聚糖酶活力(Y)为响应值进行回归拟合得到响应值(Y)对pH值(A)、转速(B)、碳源浓度(C)的二次多项回归方程:
Y=-788.43+169.16A+2.17B+8.82C-12.69A2-0.01B2-0.29C2+0.11AB-0.46AC-0.01BC
对回归模型进行显著性检验和方差分析结果如表4和表5所示。结果显示,实验所用模型经Fr检验:p=0.000 9<0.01,拟合回归方程有意义,达到极显著水平;并且该模型的拟合度指数R2=0.980 7,失拟项p=0.145 8>0.05,失拟项不显著,这说明实验数据纯误差较小,实验精度较高,能够较好地描述本次试验的结果。
根据方差分析结果绘制各因素间响应面立体分析图,它们反映了pH值(A)、转速(B)、碳源质量浓度(C)这3个因素之间对响应值(Y)的影响。由图12~14可知,pH和转速的交互作用最为显著,pH和转速之间,当转速一定时,木聚糖酶的酶活随着pH的增大呈现先增加后减小的趋势。
由统计软件分析可知,Y预测最大值为44.601 8 U/mL,pH值7.219 7、转速158.806 5 r/min,碳源质量浓度8.104 1 g/L。此时响应值值经实验验证,发酵得到的实际酶活为44.12 U/mL,实验值与预测值基本相符,说明预测模型可应用于该木聚糖酶发酵条件的优化。

表3 Box-Behenken实验设计及其结果Table 3 Design and result of Box-Behnken experiment

表4 模拟回归系数显著性检验和结果Table 4 Test and result of significance for simulated regression coefficient

表5 模型方程的方差分析结果Table 5 Variance analysis result of model eqution

图12 pH值和转速对木聚糖酶酶活的响应面分析图Fig.12 Response surface showing the effects of pH and speed on xylanase production

图13 碳源质量浓度和转速对木聚糖酶酶活交互作用的的响应面分析图Fig.13 Response surface showing the effects of carbon concentration and speed on xylanase production

图14 pH值和碳源质量浓度对木聚糖酶酶活的响应面分析图Fig.14 Response surface showing the effects of carbon concentration and pH on xylanase production
3 结论
通过透明圈法从土壤中筛选出了1株产高分子量木聚糖酶的细菌菌株,并对该菌株的木聚糖酶产酶条件进行了单因素实验优化和响应面分析,得到该菌株木聚糖酶发酵最佳产酶条件:碳源(80目玉米芯粉)0.8%,氮源(牛肉膏)1%,初始pH值7.2,培养温度30 ℃,转速158 r/min,接种量2%,装液量50 mL。该菌株所产木聚糖酶活力虽不是处于较高水平,但其所产的木聚糖酶分子量较高,具有很好的研究价值,且以玉米芯为最佳碳源,培养基原料成本低,为该酶的理论研究和工业应用奠定了理论基础。
[1] 吴萍,李正鹏,何庆元,等.金针菇固态发酵产木聚糖酶的纯化及其性质研究[J].药物生物技术,2012(1):31-34.
[2] 叶波,周娅琴.木聚糖酶综述[J].轻工科技,2012(7):14-16.
[3] 付冠华,李端,周晨妍,等.木聚糖酶的研究进展及其应用[J].安徽农业科学,2011,39(35):21566-21568.
[4] CUI Feng-jie,ZHAO Li-ming.Optimization of Xylanase Production fromPenicilliumsp.WX-Z1 by a Two-Step Statistical Strategy:Plackett-Burmanand Box-Behnken Experimental Design[J].International Journal of Molecular Sciences,2012,13(8):10630.
[5] COURTIN C,DELCOUR J.Arabinoxylans and Endoxylanases in Wheat Flour Bread-making[J].Journal of Cereal Science,2002,35(3):225-243.
[6] TCHAOUN C,POOSARAN N,WATANABE M,et al.Thermostable and alkaline-tolerant microbial cellulase-free xylanasesproduced from agricultural wastes and the properties required for use in pulp bleaching bioprocesses: a review[J].Process Biochemistry,2003, 38(9):1 327-1 340.
[7] 马焕,权淑静,刘德海,等.产木聚糖酶菌株的筛选、鉴定及其酶学性质研究[J].中国酿造,2016,35(12):123-128.
[8] 王国增.不同环境中木聚糖酶基因多样性分析及宏基因组来源的新基因克隆与表达[D].北京:中国农业科学院,2011.
[9] GUPTA S,KUHAD R,BHUSHAN B,et al.Improved xylanase production from a haloalkalophilicStaphylococcussp. SG-13 using inexpensive agricultural residues[J].World Journal of Microbiology and Biotechnology,2001,17(1):5-8.
[10] 朱辉,丁延芹,田方,等.多粘类芽孢杆菌SC2 xynD和gluB的克隆及序列分析[J].生物技术通报,2008,(4):171-174.
[11] ZHANG Qing-hua,LI Hang-guang,ZHU Xina-dong,et al.Exploration of the key functional proteins from an efficient cellulolytic microbial consortium using dilution-to-extinction approach[J].Journal of Environmental Sciences,2015,43(5):199-207.
[12] ANTHONY T, RAJ K.High molecular weight cellulase-free xylanase from alkali-tolerantAspergillusfumigatusAR1[J].Enzyme & Microbial Technology,2003,32(6):647-654.
[13] GHIO S,INSANI E,PINNINNY F,et al.GH10 XynA is the main xylanase identified in the crude enzymatic extract ofPaenibacillussp. A59 when grown on xylan or lignocellulosic biomass[J].Microbiological Research,2016,186:16-26.
[14] THIAGARAJAN S,JEYA M,GUNASEKARAN P.Purification and characterization of a high molecular weight endoxylanase from the solid-state culture of an alkali-tolerantAspergillusfumigatusMKU1[J].World Journal of Microbiology and Biotechnology,2006,22(5):487-492.
[15] SAINZ M,GONZALEZ B,MENENDEZ M,et al.Exploring multimodularity in plant cell wall deconstruction: structural and functional analysis of xyn10C containing the CBM22-1-CBM22-2 tandem[J].Journal of Biological Chemistry,2015,290(28):17 116.
[16] 沈诚,李戎,胡婷莉,等.木聚糖酶活力的二硝基水杨酸(DNS)测定法[J].印染,2011,37(2):35-39.
[17] HUA Yun,HONG Tian.Novel cold-adaptivePenicilliumstrain FS010 secreting thermo-labile xylanase isolated from Yellow Sea[J].Acta Biochimica Et Biophysica Sinica,2006,38(2):142-149.
[18] 刘程程,刘波,蓝江林,等.产木聚糖酶芽胞杆菌的筛选及产酶条件优化[J].福建农业学报,2014,29(8):757-767.
[19] UEDA M,KOO H.Cellulase treatment of cotton fabrics. II. Inhibitory effect of surfactants on cellulase catalytic reaction.[J].Textile Research Journal,1994,64(64):615-618.
[20] 李雪龙.细菌性木聚糖酶高产菌株的筛选及其酶学性质研究[D].哈尔滨:东北林业大学,2008.
[21] 李群良,韩玉璐,张欣英,等.产木聚糖酶菌株的筛选及产酶条件优化[J].可再生能源,2011,29(2):89-91.
[22] 马建卢.降解木糖渣真菌的筛选及其发酵条件和酶学性质的研究[D].郑州:郑州大学,2012.
Screeningofhighmolecularweightxylanase-producingbacteriaandoptimizationoffermentationconditions
WANG Zhong-yue,TENG Chao, TANG Hui-hua, LI Xiu-ting*
1(Beijing Laboratory of Food Quality and Safety, Beijing 100048, China)2(Beijing Engineering and Technology Research Center of Food Additives, Beijing 100048, China)
55 Xylanase-producing bacteria from the different sources of soil samples through the transparent circle method a high molecular weight xylanase-producing bacteriaby liquid fermentation and SDS-PAGE zymogramanalysis.Through single factor experiment and response surface analysis,the factors affecting the enzyme production fermentation optimizedthe best enzyme production fermentation conditions : carbon source (corn cob powder)0.8%, nitrogen source (beef paste) 1%, initial pH value of 7.2, culture temperature 30 ℃, rotational speed of 158 r/min, of 2%, the fluid volume 50 mL. Under the optimized condition, the enzyme activity reached 44.12 U/mL after fermentation,which 4.36 times higher than before optimization.
high molecular weight xylanase; bacterial strains; liquid fermentation; the response surface optimization
10.13995/j.cnki.11-1802/ts.014537
硕士研究生(李秀婷教授为通讯作者,E-mail:lixt@th.btbu.edu.cn)。
国家自然科学基金(31671793;1201449)
2017-04-15, 改回日期:2017-06-12
